牡丹根际溶磷真菌的筛选及其促生效应
2018-09-28薛冬黄向东宋根娣杨瑞先王慧敏罗秋玲
薛冬,黄向东,宋根娣,杨瑞先,王慧敏,罗秋玲
洛阳理工学院环境工程与化学学院,河南 洛阳 471023
磷是植物生长发育的重要物质基础,但土壤中95%以上的磷是难以被植物吸收利用的难溶性磷(Pérez et al.,2007)。通过施肥进入土壤的磷大部分与钙、铁、铝等金属阳离子相结合形成难溶性磷酸盐而在土壤中积累,容易造成磷矿资源浪费以及土壤板结、环境污染等生态环境问题(李海云等,2015)。溶磷微生物能够将土壤中难溶性磷转化为植物可吸收利用的形态,提高磷肥利用率,减少环境污染,被认为是安全、高效活化土壤难溶磷的生物措施(Sharma et a1.,2013)。溶磷微生物在土壤中存活及其溶磷能力易受植物种类和根际土壤环境等因素影响,因此,从特定植物根际环境筛选获得与植物亲和性好、易于在根际定殖的高效溶磷微生物,是当前亟待解决的科学问题。
迄今为止,从植物根际土壤筛选得到的溶磷微生物主要包括细菌、真菌和放线菌,并且溶磷真菌的数量和种类远少于溶磷细菌,但其溶磷能力普遍高于溶磷细菌,并具有较强的溶磷遗传稳定性(赵小蓉等,2002;王光华等,2003;于群英等,2012)。目前,已研究报道的溶解难溶无机磷能力较强的真菌主要有曲霉属(Aspergillus)和青霉属(Penicillium),其中,拜莱青霉(Penicillium bilaii)能显著提高土壤有效磷含量,促进多种作物产量的提高,是国际上普遍认可的溶磷效果非常好的溶磷真菌,应用该菌制成的溶磷微生物肥料已在加拿大被商业化生产(王光华等,2003;Elias et al.,2016)。国内主要应用巨大芽孢杆菌(Bacillus megatarium)生产溶磷微生物肥料(史发超等,2014)。因此,不断挖掘高效溶磷真菌菌种资源具有重要意义和应用前景。
牡丹(Paeonia suffruticosa)属于毛茛科芍药属落叶小灌木,素有“国色天香”、“花中之王”之美誉,随着牡丹产业由观赏、药用拓展至食用、保健等多个领域,其种植面积逐年增加。施肥是非常重要的牡丹栽培管理措施,为使牡丹花大色艳和高产,过量施用无机磷肥已成为普遍现象,这造成牡丹园土壤理化性状及结构恶化、微生物种群结构失衡、病害严重(Xue et al.,2014;Huang et al.,2014)。然而,有关牡丹根际土壤溶磷微生物的研究鲜见报道。本研究从牡丹根际土壤中筛选溶磷效果较好的溶磷真菌,研究确定其对不同难溶磷的溶磷效果及其对牡丹生长的影响,旨在为牡丹高效生物肥料的研制提供优良菌种资源以及为维持牡丹产业可持续发展提供科学依据。
1 材料与方法
1.1 培养基
无机磷培养基:葡萄糖10.0 g,NaCl 0.3 g,KCl 0.3 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.3 g,FeSO4·4H2O 0.036 g,MnSO4·4H2O 0.03 g,Ca3(PO4)25.0 g,琼脂 18.0 g,蒸馏水 1000 mL,pH 7.0~7.5。
PDA培养基:马铃薯 200 g,葡萄糖20 g,琼脂18 g,蒸馏水1000 mL,自然pH值。
1.2 根际土壤样品的采集
从河南省洛阳市国家牡丹园选择品种为洛阳红的牡丹健康植株,随机挖出5株,抖落根系外围土,再用毛刷将粘在根上的根际土壤收集到无菌塑料袋中混匀,立即保存于4 ℃冰箱中,用于牡丹根际溶磷真菌的筛选。
1.3 溶磷真菌的筛选
称取10 g根际土壤样品于250 mL三角瓶中,加90 mL无菌水,180 r·min-1振荡15 min制备土壤悬液,再用 10倍稀释法,依次制备 10-2、10-3和 10-4的土壤稀释液,分别涂布于无机磷固体培养基上,然后置于28 ℃生化培养箱倒置培养,待菌落长出后,挑取有明显溶磷圈且培养特征有明显区别的菌落进行分离纯化,保存。将纯化菌株接种于无机磷固体培养基,于28 ℃培养4 d,测量菌落的溶磷圈直径(D)与菌落直径(d),每个菌株重复3次。
将纯化菌株接种于PDA培养基中培养,使其大量产孢,然后洗入无菌水中,振荡分散孢子,制备成1×108cfu·mL-1的孢子悬浮液,按照1%的接种量接入到无机磷液体培养基,同时以加入等量的无菌水作为对照,每个处理 3次重复。于28 ℃、180 r·min-1下振荡培养 7 d,将培养液于4 ℃、10000 r·min-1下离心 10 min,采用钼锑抗比色法测定上清液中有效磷含量(中华人民共和国农业部种植业管理司,2010)。
根据菌株在无机磷固体培养基上的D/d值和液体培养基中的溶磷量,筛选出溶磷效果较好的菌株,对其进行进一步研究。
1.4 溶磷菌株的鉴定
将菌株接种于 PDA培养基平板,参照《真菌鉴定手册》观察其培养特征,显微镜下观察菌丝有无隔膜、孢子的形状、颜色及其着生方式等菌体形态特征(魏景超,1979)。
采用真菌基因组DNA抽提试剂盒提取菌株的基因组 DNA,以通用真菌引物 NS1( 5′-GTAGTCATATGCTTGTCTC-3′) 和 NS6(5′-GCATCACAGACCTGTTATTGCCTC-3′)扩增菌株的18S rDNA序列,测序由上海生工生物工程股份有限公司完成,将所测得序列通过NCBI的Blast程序与GenBank数据库中核酸序列进行比对,将该菌株序列以及相似性较高序列使用ClustalX 2.1软件进行完全比对分析,然后采用MEGA 6.06软件的Neighbor-Joining法构建系统发育树。
1.5 菌株的溶磷遗传稳定性试验
将菌株接种到PDA培养基上传代培养30次,将每代培养物接种于无机磷液体培养基中,于28 ℃、180 r·min-1下振荡培养7 d,测定其有效磷含量,分析菌株溶磷量随传代次数的变化。
1.6 菌株对难溶磷源的溶解能力分析
以无机磷液体培养基为基础,将难溶磷源分别设置为等量的磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉,培养基的其他成分不变,按照 1%的接种量将菌株的孢子悬液接入到含不同难溶磷源的培养基中,同时设不接菌对照,每个处理3次重复,28 ℃、180 r·min-1下振荡培养7 d,分别于第24、48、72、96、120、144、168小时测定培养液中有效磷含量和pH值。
1.7 菌株的土壤溶磷效果及促生效果试验
供试土壤取自河南省洛阳市国家牡丹园褐土,有机碳 13.2 g·kg-1,全氮 1.26 g·kg-1,有效磷 12.8 mg·kg-1,pH 值 7.40。采用口径为 16 cm,深为 15 cm的塑料盆钵进行试验,每盆装土1 kg。试验设置对照处理(不接菌,分别施用磷酸钙、磷酸铝、磷酸铁、磷酸锌、磷矿粉)、接种菌株处理(接菌,分别施用磷酸钙、磷酸铝、磷酸铁、磷酸锌、磷矿粉),每种处理6个重复。将无菌水制备的菌株孢子悬液(1×108cfu·mL-1)以 10 mL·kg-1的用量均匀施加到土壤中,每种难溶磷源以 1 g·kg-1的用量与其充分混匀。采用沙藏层积和低温处理洛阳红牡丹种子,选取生根长度一致的种子种植于盆中,每盆1株,80 d后,测量牡丹株高、叶面积、根长、地上部干重、地下部干重,同时测定土壤有效磷含量(鲍士旦,2000)。
1.8 数据分析
运用Microsoft Excel 2007对数据进行处理,图表中数据表示为平均值±标准差。运用软件 SPSS 19.0进行统计分析,采用单因素方差分析(One-way ANOVA),在0.05显著性水平下进行LSD差异显著性检验和多重比较分析。
2 结果与分析
2.1 溶磷真菌的筛选
经过初筛,能在无机磷固体培养基上形成明显溶磷圈的真菌菌株共 3株(表 1),将菌株编号为PPSF1-3,其中,菌株PPSF1的溶磷圈D/d>2.0(图1)。通过无机磷液体培养基复筛,菌株PPSF1的溶磷量显著高于菌株PPSF2和PPSF3。无论采用无机磷固体培养基还是无机磷液体培养基,菌株PPSF1均表现出较好溶磷效果,因此,将其作为进一步研究的供试菌株。

表1 牡丹根际溶磷真菌的溶磷能力Table 1 Phosphate solubilization capacity of strains isolated from Paeonia suffruticosa rhizosphere

图1 菌株PPSF1在无机磷固体培养基上形成的溶磷圈Fig. 1 Soluble phosphorus halo generated by strain PPSF1 in inorganic phosphate solid medium

图2 菌株PPSF1在PDA 培养基上的菌落(a)、菌丝(b)、分生孢子头(c)及分生孢子(d)形态Fig. 2 Morphologies of the colony (a), mycelium (b), conidial head (c), and conidiophore (d) of strain PPSF1 on PDA medium
2.2 菌株的分类鉴定
菌株PPSF1在PDA固体培养基上的形态特征见图2。该菌生长迅速,菌落不透明,正面呈黑色,边缘有白色绒状菌丝,反面有放射性凹沟。菌丝多细胞有隔膜,分生孢子梗顶端膨大形成球形顶囊,表面以放射状生出小梗,分生孢子为球形,呈褐黑色。根据以上特征,初步确定该菌株为曲霉属(Aspergillus)的黑曲霉(Aspergillus niger)。
菌株 PPSF1的 18S rDNA序列经测定长度为1300 bp,提交于GenBank数据库,序列登录号为MG890328。在NCBI上通过Blast同源性比对分析,以同源性较高的序列构建系统发育树(图3),菌株PPSF1与黑曲霉(Aspergillus niger)的同源性达到100%,处于发育树的同一分支,亲缘关系最为接近。结合菌株的形态特征,进一步确定菌株PPSF1为黑曲霉(Aspergillus niger)。
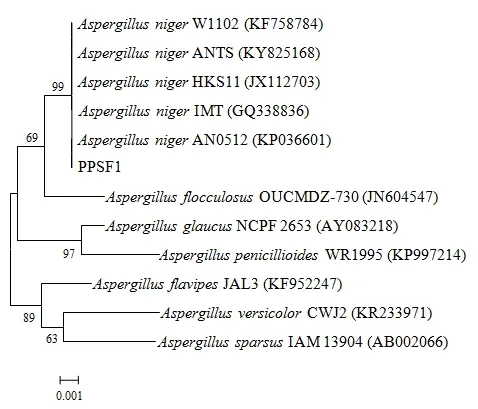
图3 基于18S rDNA序列同源性构建菌株PPSF1的系统发育树Fig. 3 Phylogenetic tree of strain PPSF1 constructed based on the homology of 18S rDNA sequences
2.3 菌株的溶磷遗传稳定性
将菌株PPSF1传代培养30次,随传代次数的增加,其溶磷量未发生显著变化(图4),基本稳定在(711.2±22.8) mg·L-1范围内,表明菌株 PPSF1的溶磷能力具有较好的遗传稳定性,此特性有助于该菌株的后续深入研究及开发应用。

图4 菌株PPSF1的溶磷遗传稳定性Fig. 4 Genetic stability of phosphate solubilizing strain PPSF1
2.4 菌株对不同磷源的溶解效果
由图5可知,菌株PPSF1在以磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉为磷源的液体培养基中的溶磷量均随着培养时间的延长呈现先逐渐升高而后基本趋于稳定的趋势。以磷酸钙和磷酸锌为磷源时,溶磷量在培养的第 96小时达到最高;以磷酸铝和磷酸铁为磷源时,溶磷量在培养的第120小时达到最高;以磷矿粉为磷源时,溶磷量在培养的第144小时达到最高。菌株PSPSF1在不同无机难溶磷源下的最大溶磷量表现为磷酸钙(720.6 mg·L-1)>磷酸锌(633.3 mg·L-1)>磷酸铝(495.7 mg·L-1)>磷酸铁(386.4 mg·L-1)>磷矿粉(173.9 mg·L-1),表明菌株PPSF1对磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉均有较强的溶解能力,并且对不同难溶磷源的溶磷特性有较大差异。
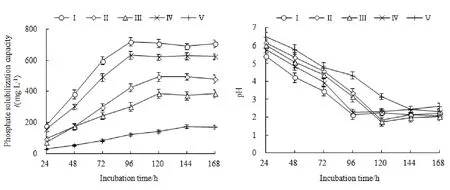
图5 菌株PPSF1在不同磷源条件下的溶磷量(a)及pH(b)Fig. 5 Phosphate solubilization capacity (a) and pH (b) of PPSF1 under different phosphorus sources
菌株培养液的pH在5种无机难溶磷源下均呈现先下降后趋于稳定的变化趋势。以磷酸钙和磷酸锌为磷源时,在培养的第 96小时下降到最低;以磷酸铝和磷酸铁为磷源时,在培养的第120小时下降到最低;以磷矿粉为磷源时,在培养的第144小时下降到最低。相关性分析显示,在磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉培养液中,菌株溶磷量与pH的相关系数分别为-0.953、-0.957、-0.947、-0.962、-0.959,均呈现显著负相关关系(P<0.01)。
2.5 菌株对土壤难溶磷的溶解能力

图6 菌株PPSF1对土壤有效磷含量的影响Fig. 6 Effect of strain PPSF1 on soil available phosphate contentn=3
由图6可知,无论在施用哪种难溶磷源条件下,接种菌株 PPSF1的土壤有效磷含量均显著高于未接菌对照。接种菌株PPSF1在施用磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉的土壤中有效磷含量分别比相应的未接菌对照提高386.5%、265.3%、175.7%、327.6%和95.7%,菌株PPSF1对土壤中不同难溶磷源的溶解能力大小为磷酸钙>磷酸锌>磷酸铝>磷酸铁>磷矿粉,在以磷酸钙为磷源条件下其溶磷效果最好。
2.6 菌株对牡丹生长指标的影响
在施用磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉条件下,接种菌株PPSF1对牡丹生长指标的影响见表2。与未接菌对照相比,接种菌株PPSF1使牡丹株高、叶面积、根长、地上部干重和地下部干重均显著增加,分别提高了19.8%~40.7%、13.6%~22.7%、29.7%~46.2%、34.5%~58.5%和 41.2%~64.4%。菌株PPSF1在不同难溶磷源条件下对牡丹生长的促进效果表现为磷酸钙>磷酸锌>磷酸铝>磷酸铁>磷矿粉,在以磷酸钙为磷源条件下对牡丹生长的促进效果最好,使牡丹的株高、叶面积、根长、地上部干重和地下部干重分别增加40.7%、22.7%、46.2%、58.5%和64.4%。
3 讨论
牡丹根际溶磷真菌相对较少,仅分离到3株能在无机磷固体培养基上形成明显溶磷圈的真菌菌株,溶磷效果较好的菌株 PPSF1被鉴定为黑曲霉(Aspergillus niger),目前已有从小麦(Triticum aestivum)、大豆(Glycine max)、花生(Arachis hypogaea)、白菜(Brassica pekinensis)、西红柿(Lycopersicon esculentum)、类芦(Neyraudia reynaudiana)等植物根际土壤分离到具有溶磷能力的黑曲霉的研究(冯宏等,2010;刘文干等,2012;Lietal.,2015;Tallapragada,2015;Xiao et al.,2015;杨顺等,2018)。然而,已报道的黑曲霉的溶磷能力有较大差异,其对磷酸钙的溶磷量大都在300~500 mg·L-1。本研究从牡丹根际分离到的菌株PPSF1对磷酸钙的最高溶磷量为720.6 mg·L-1。可能由于黑曲霉分离地覆盖植物不同,不同植物根系分泌物及根部脱落物长期为其提供的生长环境及营养物质的差异,导致同种溶磷菌因来自不同环境而出现定殖能力及溶磷能力的差异(Dassen et al.,2017;丁晶等,2017;黄艺等,2018)。
液体培养试验及盆栽试验均表明,溶磷真菌PPSF1对磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉等不同无机难溶磷源均具有较强溶解能力,表明该菌应用范围很广,在含有多种难溶态磷源的土壤中均能发挥溶磷作用。本研究发现,溶磷真菌PPSF1对不同难溶态磷源的溶解特性有较大差异,可能由于不同难溶态磷源的结构和成分差异较大,导致溶磷微生物对其溶解能力显著不同。
刘文干等(2012)从花生根际筛选到的溶磷菌黑曲霉(Aspergillus niger)B1-A,在不同接种量下,对磷酸铁和磷酸铝的溶磷量与培养液pH呈极显著负相关。乔志伟等(2013)从石灰性土壤分离到的黑曲霉(Aspergillus niger)Z60,在磷酸铁培养液中的有效磷含量与培养液pH呈显著负相关,而在磷酸铝培养液中的有效磷含量与 pH相关性不显著。冯宏等(2010)从类芦根际土壤分离到的黑曲霉(Aspergillus niger)FP1,在磷酸钙、磷酸铝和磷酸铁培养液中的溶磷量与培养液的pH值均无显著相关性。本研究发现,菌株PPSF1在磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉培养液中,菌株溶磷量与pH均呈现显著负相关关系。这些结果表明,溶磷菌的溶磷量与培养液pH的关系比较复杂,即使是同种溶磷菌,也可能受菌株不同株型、不同种类难溶性磷酸盐和不同种类碳氮源的影响。

表2 菌株PPSF1对牡丹生长的影响Table 2 Effect of strain PPSF1 on the growth of Paeonia suffruticosa
有关溶磷真菌对植物促生效应的研究已有报道。Singh et al.(2011)的研究发现,施加溶磷真菌草酸青霉(Penicillium oxalicum)使小麦和玉米植株的地上部生物量和地下生物量相对于对照均有显著增加。Xiao et al.(2009)研究表明,土壤中施加溶磷真菌Penicillium expansumHB-1能显著增加小麦植株的茎与根的干重。史发超等(2014)报道溶磷真菌斜卧青霉(Penicillium decumbens)P83对玉米生长具有显著作用,使玉米植株鲜重提高9.5%~89.2%、干重增加35%~231%。本研究显示,施加Aspergillus nigerPPSF1使牡丹的株高、叶面积、根长、地上部干重和地下部干重均显著高于未接菌对照。众所周知,植物体内多种生理生化过程都需要磷的参与,磷促进细胞分裂,促使植物生长发育。牡丹生长指标的改善很可能由于该溶磷真菌能将土壤中的难溶态磷溶解为能被牡丹吸收利用的有效态磷所致(Reyes et al.,2002)。此外,溶磷真菌通过向根际分泌植物生长素也可促使牡丹生长(代金霞等,2017)。
4 结论
(1)从牡丹根际土壤分离到一株具有较强溶磷能力的真菌菌株 PPSF1,结合形态学特征和 18S rDNA序列分析将其鉴定为黑曲霉(Aspergillus niger)。
(2)菌株PPSF1对磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉均具有较强溶解能力,其对不同磷源的溶磷量表现为磷酸钙>磷酸锌>磷酸铝>磷酸铁>磷矿粉,在 5种难溶磷源培养液中的溶磷量均与pH呈现显著负相关。
(3)菌株PPSF1在含有磷酸钙、磷酸铝、磷酸铁、磷酸锌和磷矿粉的土壤中溶磷效果显著,使牡丹的株高、叶面积、根长、地上部干重和地下部干重均显著增加,有望成为高效生物磷肥的优良菌种资源。
