安石榴苷对小鼠巨噬细胞生长因子及M1/M2型极化的影响
2018-09-28古丽米热阿比来提朱俊宇梁华平顾政一
古丽米热·阿比来提, 朱俊宇, 梁华平, 严 欢, 顾政一
(1新疆医科大学药学院, 乌鲁木齐 830011; 2新疆维吾尔自治区药物研究所, 乌鲁木齐 830004;3陆军军医大学第三附属医院野战外科研究所第一研究室,创伤、烧伤与复合伤国家重点实验室, 重庆 400042)
石榴皮为石榴科植物石榴(PunicagranatumL. )的干燥果皮,主要含有安石榴苷(PUN)、没食子酸、绿原酸等化学成分,其中PUN是石榴皮中的主要活性成分,具有抗炎、抗氧化、抗癌、抗菌、抗病毒等药理作用[1-4]。国内外学者研究表明PUN具有促进皮肤溃疡和创伤愈合的作用[5-6],但其作用机制尚不明确。研究证实巨噬细胞被认为参与创面愈合炎症期、修复期、重塑期整个过程,机制是通过分泌生长因子及促进极化[7]。本研究采用体外巨噬细胞培养实验探讨PUN对生长因子及M1/M2型极化的影响,现报道如下。
1 材料与方法
1.1细胞RAW264.7细胞系由重庆第三军医大学野战外科研究所保存;原代腹腔巨噬细胞自雌性C57BL/6小鼠提取。
1.2仪器倒置光学显微镜(日本Olympus公司),电动移液器(美国Thermo公司),低速水平离心机(美国Becton Dickinson公司),低温高速离心机(美国Beckman公司),实时定量PCR扩增仪(美国Bio-Rad公司),酶标仪(美国Bio-Tek公司)。
1.3试剂PUN单体(美国Sigma公司,批号WXBC7358V),LPS(美国Sigma公司,批号095M4163V),胎牛血清(FBS,美国Gibco公司,批号8118021),RPMI 1640培养基(美国Gibco公司,批号8118073),胰蛋白酶消化液(美国Gibco公司,批号1852914),兔精氨酸酶1(Arg-1)单抗(美国CST 公司),iNOS单抗(美国CST 公司),二抗(英国Abcam公司,批号129259),小鼠肿瘤坏死因子α(TNF-α)(武汉博士德公司,批号2411327314),白细胞介素-6(IL-6)(武汉博士德公司,批号1321415206),白细胞介素-1β(IL-1β)(武汉博士德公司,批号1161412206),IL-10(武汉博士德公司,批号1371147603);总RNA快速抽提试剂盒(北京百泰克公司,批号B020010017),逆转录试剂盒(日本TaKaRa公司,批号AK4710)。
1.4方法
1.4.1 10%胎牛血清培养基的配制 取RPMI 1640培养基180 mL至无菌瓶中,加入20 mL FBS。在加入2 mL青-链霉素溶液,使之终体积为202 mL,混匀后于4℃保存。
1.4.2 LPS与PUN储备液的配制 (1)LPS储备液:称取5 mg LPS粉末,加入10 mL RPMI 1640培养基溶解,配制成500 μg/mL 储备液,封口后4℃保存,使用时用基础培养基稀释至10 μg/mL。(2)PUN储备液:称取10 mg PUN粉末,加入922.5 μL RPMI 1640培养基配成10 mmol/L 的储备液,封口后-20℃保存,使用时用基础培养基稀释至50 μmol/L。
1.4.3 RAW264.7细胞的培养 取RAW264.7细胞用含10% FBS和1%青-链霉素溶液的RPMI-1640培养基于37℃、5%CO2培养箱中过夜培养,镜下观察细胞生长密度,更换培养液后继续培养,待细胞生长至对数期后(细胞密度约占10 cm2培养皿面积的80%~90%)进行传代。超净台预先用紫外照射30 min,操作过程均需保证无菌。用移液器吸弃培养皿中培养液,无菌PBS洗涤细胞3次后弃去,加入适量500 μL胰蛋白酶消化,室温放置3 min,倒置显微镜下观察,轻晃培养皿发现有细胞脱落,加入2 mL的完全培养基终止消化,轻轻吹打使细胞完全脱落,加入到离心管中1 300 r/min离心5 min,弃上清,细胞悬液用完全培养基重悬平均加于2个培养皿中,每个培养皿加入完全培养液8 mL,于37℃、5%CO2培养箱中过夜培养后换液,根据细胞状态及密度定期进行换液或传代,并计数接种于不同种类孔板,加药处理。
1.4.4 小鼠原代腹腔巨噬细胞的提取 雌性C57BL/6小鼠,体质量20~25 g,颈椎脱臼处死,用 75%的乙醇浸泡片刻,置于超净台,无菌条件下剪开肚皮,腹腔注射冰生理盐水5 mL,灌洗,并收回于离心管,1 300 r/min离心5 min,弃上清,用含10%FBS和1%青-链霉素溶液的RPMI-1640培养基将细胞量调至2×106~3×106个/mL,接种于6孔板,于37℃、5%CO2培养箱中培养,2 h后进行加药处理。
1.4.5 MTT法考察PUN的细胞活性 将细胞按上述“1.4.3”,“1.4.4”项下培养方法计数接种于96孔板中,每孔加入完全培养基0.1 mL,37℃、5%CO2培养箱中过夜培养,弃上清,考察不同浓度 (0~800 μmol/L,0、5、25、50、100、200、400、800 μmol/L)PUN对RAW264.7细胞以及原代腹腔巨噬细胞增殖功能的影响。每组设置3个复孔,药物作用24 h后,每孔加入5 mg/mL MTT 10 μL,37℃孵育4 h,用酶标仪测定490 nm处检测各组细胞的吸光度A490并计算细胞存活率。空白组细胞存活率为100%,其他各组细胞存活率=(处理组A490/空白组A490)×100%。
1.4.6 RT-PCR检测RAW264.7细胞相关生长因子的mRNA水平 将处于对数生长期的RAW264. 7 细胞接种于96孔板,每孔细胞数为2×106个,随机分为4组(每组n=3):正常细胞组(不加药,其余操作与对照组一致)、LPS组(10 μg/mL)、PUN组(50 μmol/L)、药物干预组(LPS 10 μg/mL与PUN 50 μmol/L),分别收集作用4、12 h细胞。按照百泰克总RNA抽提试剂盒、TaKaRa逆转录试剂盒说明书进行提取检测,生长因子引物序列见表1。
1.4.7 RT-PCR检测RAW264. 7、原代腹腔巨噬细胞M1、M2型巨噬细胞相关的炎性因子表达 将RAW264. 7、原代腹腔巨噬细胞随机分为4组(每组n=3),按“1.4.6”项下方法分组、干预及检测,RAW264. 7作用时间为12 h ,原代腹腔巨噬细胞作用时间为4 、8 、12、24 h,检测TNF-α、IL-Iβ、IL-6、IL-10、Arg-1、iNOS等因子的表达水平,见表1。

表1 qRT-PCR各引物序列
1.4.8 ELSIA 法检测原代腹腔巨噬细胞上清液TNF-α、IL-Iβ、IL-6、IL-10 水平 显微镜下观察细胞较为饱满时,加入500 μL胰蛋白酶消化,放置3 min,加入完全培养基终止,用细胞计数板计数制成细胞悬液2×106个,接种于6孔板中,过夜培养。按“1.4.6”项下方法分组,干预12 、24 h后收集上清液,按说明书步骤检测上清液TNF-α、IL-Iβ、IL-6、IL-10 等细胞因子水平,酶标仪检测450 nm波长处的吸光度A450。以每一个细胞因子以标准品A450值为横坐标,对应浓度作为纵坐标,制作标准曲线,得出相应公式,将测得的样品A450值带入公式后算出待测样品的浓度,即细胞因子的表达量。无其他特殊说明本文中出现的药物作用为PUN(50 μmol/L)、LPS(10 μg/mL)。
1.4.9 Western blot 法检测原代腹腔巨噬细胞iNOS、Arg-1的表达 将提好的原代腹腔巨噬细胞进行相应处理后接种于 6孔板,每孔细胞数为3×106个,按 “1.4.6”项下方法分组及干预12、24 h。弃掉上清各组细胞用PBS洗涤2次,加入200 μL RIPA裂解液,吹打细胞涡旋混匀收集后,冰上放置一会儿,刮取细胞,移入1.5 mL 预冷EP管中,13 000 r/min离心10 min,将上清液(约能吸160 μL)移入另一个 预冷的1.5 mL EP 管中。加入 40 μL 5 ×Loading Buffer,混匀后煮沸10 min 变性,储存于-80℃冰箱。配制10%SDS-PAGE胶,加入30 μL样本后电泳,电泳结束将蛋白转移至PVDF膜上。用5%脱脂奶粉室温封闭1 h,一抗(iNOS、Arg-1) 4℃ 摇床孵育过夜,1×TBST(TBS粉末溶于2 000 mL 双蒸水中,滴加2 mL吐温20) 洗涤4次,每次5 min ,二抗室温孵育 1 h ,1×TBST 洗涤 5次,每次5 min ,洗涤后吸掉上面多余液体,用ECL发光液(A、B液等比例混合)覆盖含蛋白的部分,放入凝胶成像仪曝光,用Image J分析灰度值。

2 结果
2.1体外RAW264.7、原代腹腔巨噬细胞MTT结果与对照组比较(浓度为0),PUN在200~800 μmol/L浓度范围内能够抑制RAW264. 7细胞活力,细胞存活率下降,差异有统计学意义(P<0.05);原代细胞中,细胞存活率分别上升,且存活率在该浓度的范围内与之呈正相关。与对照组比较,PUN在50~800 μmol/L浓度范围内能够提高细胞活力,细胞存活率上升,差异有统计学意义(P<0.05),见图1。
2.2PUN对几种生长因子mRNA的影响与LPS组比较,PUN干预后部分生长因子的表达量被抑制,差异有统计学意义(P<0.05),而对于一些生长因子检测不出mRNA(TGF-β、FGF、EGF),表明PUN对于巨噬细胞中上述生长因子并无正性调控作用,见图2。
2.3PUN对巨噬细胞M1/M2极化相关因子mRNA的影响
2.3.1 PUN对RAW264.7细胞作用12 h后,M1/M2极化相关因子mRNA的影响 与LPS组比较,PUN干预后可下调促炎因子TNF-α 、IL-1β、IL-6的基因表达,差异有统计学意义(P<0.05),对于IL-10抗炎因子的基因表达,差异有统计学意义(P<0.05),但并无明显上调作用,见图3A。与LPS组比较,PUN作用后可下调M1/M2型巨噬细胞iNOS、上调Arg-1的基因表达水平,差异有统计学意义(P<0.05),见图3B。
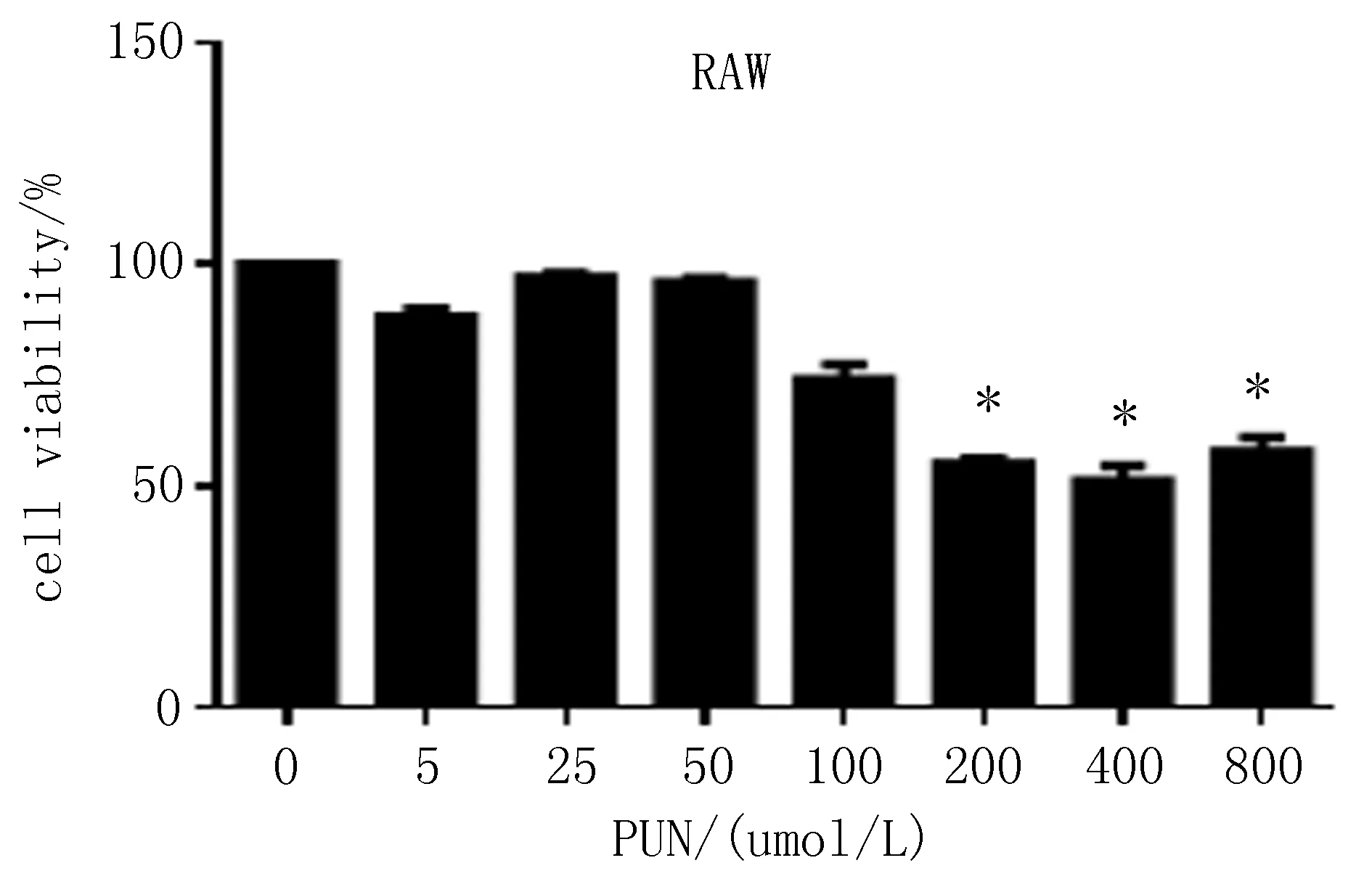
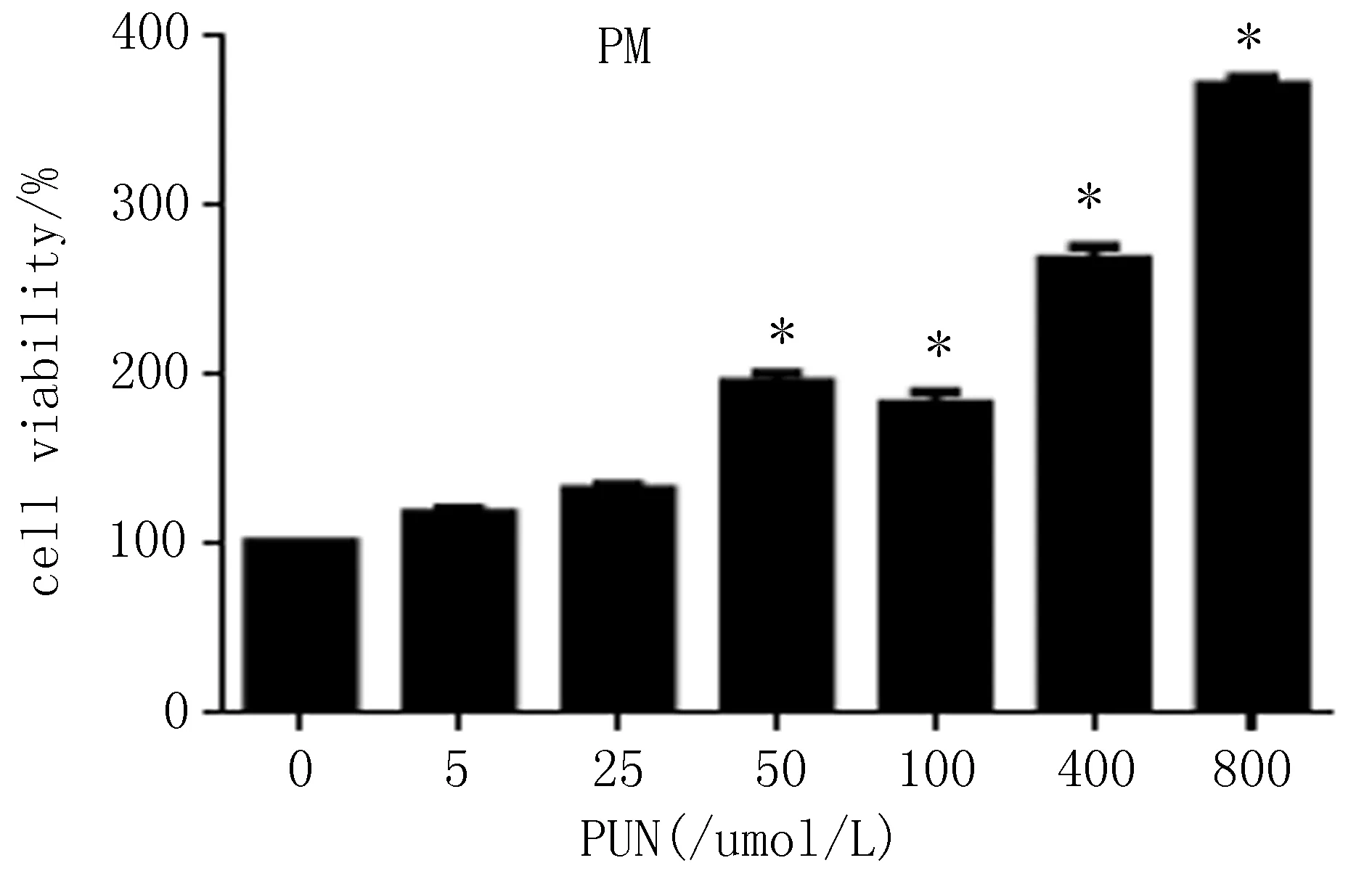
图1 PUN对RAW264.7及原代腹腔巨噬细胞存活率的影响

图2 PUN对RAW264.7细胞中生长因子的作用
2.3.2 PUN在不同时间点对原代腹腔巨噬细胞M1/M2极化相关因子mRNA的影响 PUN可下调促炎因子TNF-α 、IL-1β、IL-6的基因表达,上调IL-10抗炎因子的基因表达,差异有统计学意义(P<0.05),见图4 A、B、C、D。检测M1/M2型巨噬细胞表征性酶iNOS和 Arg-1的基因表达水平,结果与RAW264.7表达一致,差异有统计学意义(P<0.05),见图4 E、F。检测到Arg-1的基因表达水平在PUN(12.5、25.0、50.0 μmol/L)作用12 h时,呈剂量依赖性,见图4 G。
2.4ELISA检测M1/M2极化相关因子的水平PUN在不同时间点(12、24 h)对原代腹腔巨噬细胞作用下,与LPS组比较,PUN干预后可下调促炎因子IL-1β、IL-6的水平,上调IL-10的水平,差异有统计学意义(P<0.05),见图5B、C、D;但对TNF-α作用不明显,差异无统计学意义(P>0.05),见图5A。
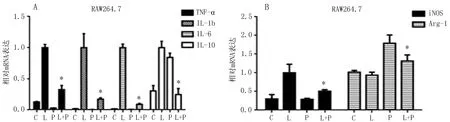
图3 PUN作用后的RAW264.7细胞中M1/M2型巨噬细胞相关性因子及酶的mRNA水平


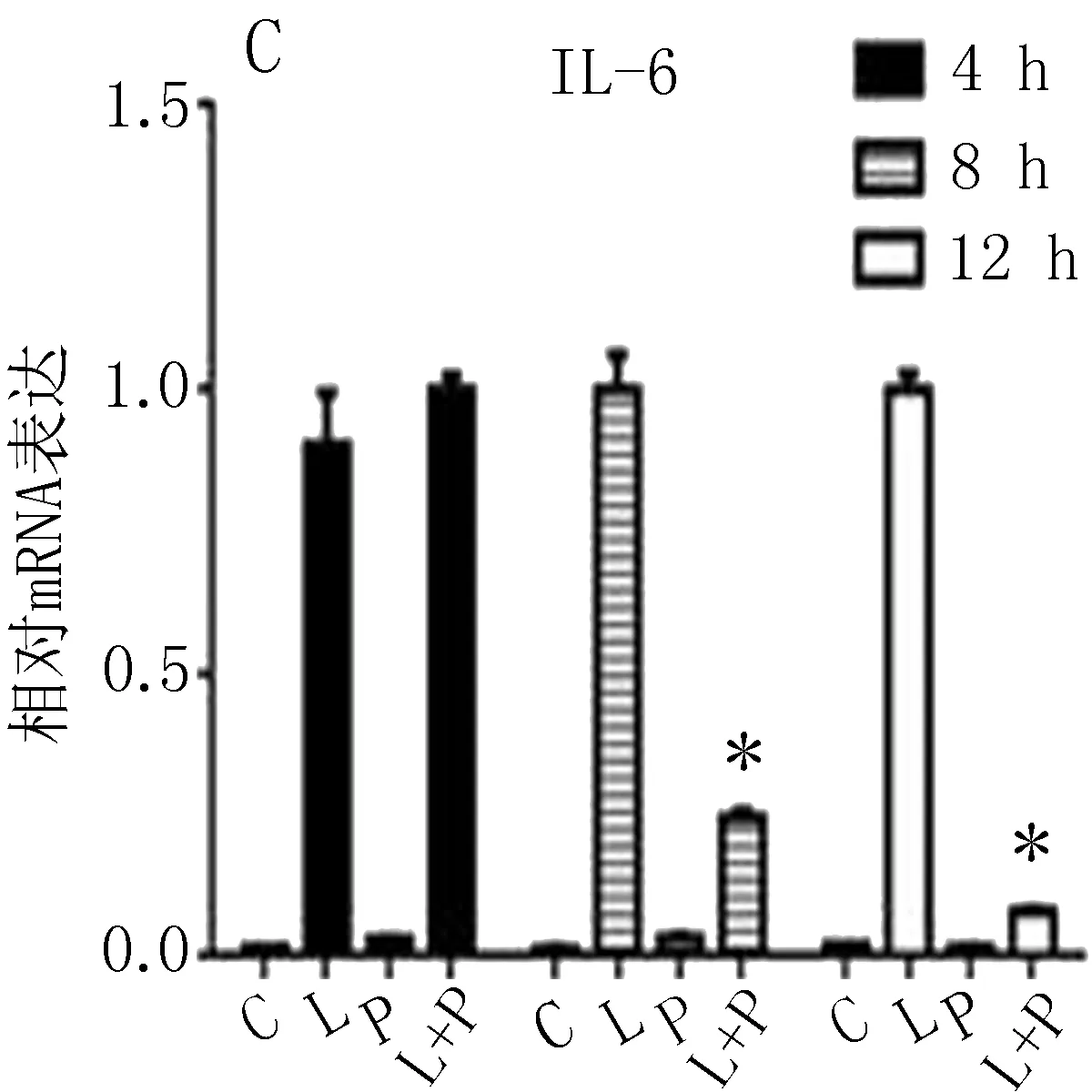



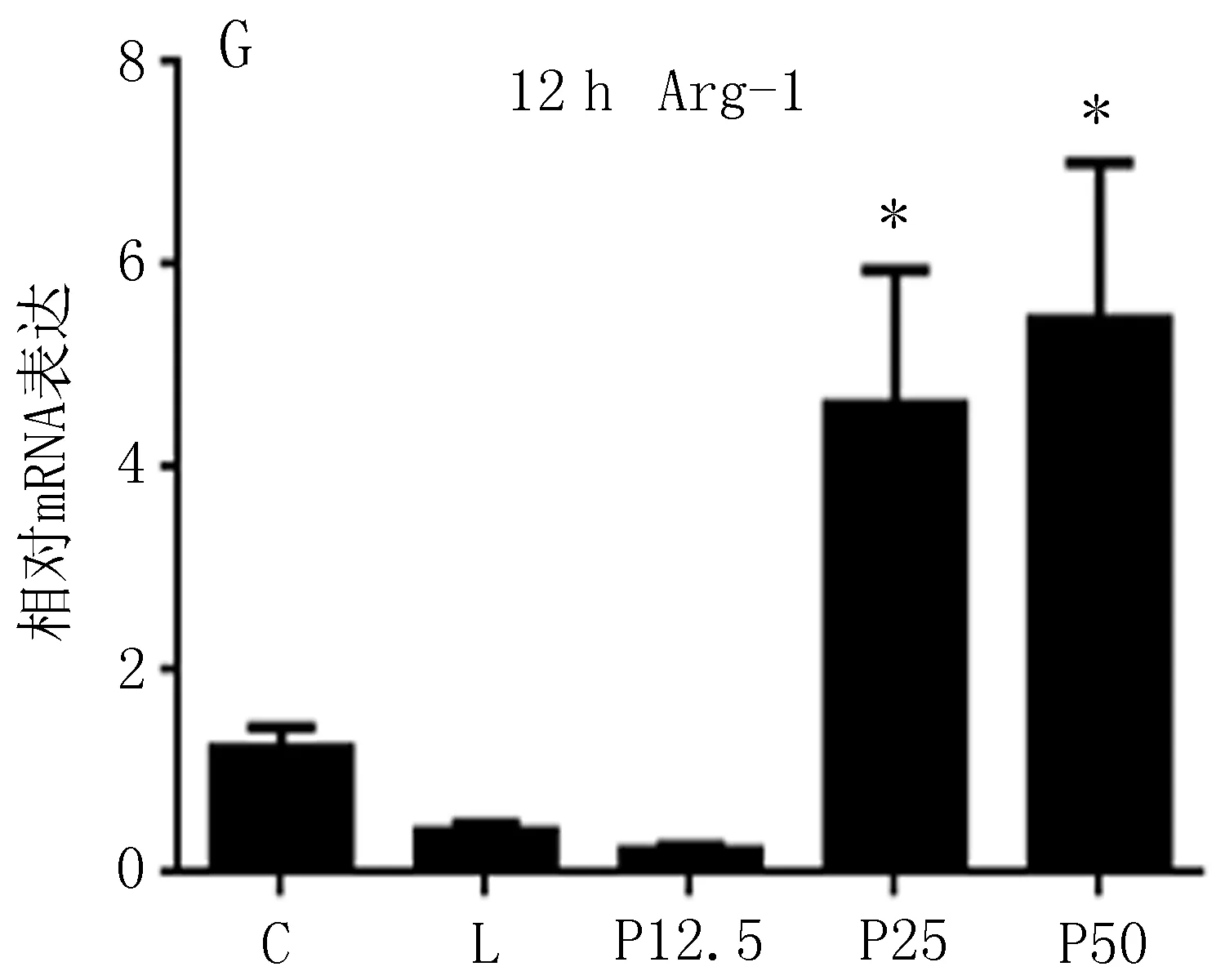
图4 PUN干预后的原代腹腔巨噬细胞中M1/M2型巨噬细胞相关性因子及酶的mRNA水平
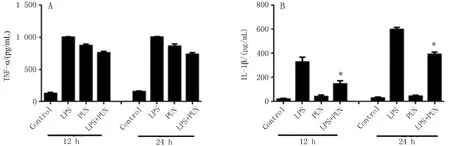
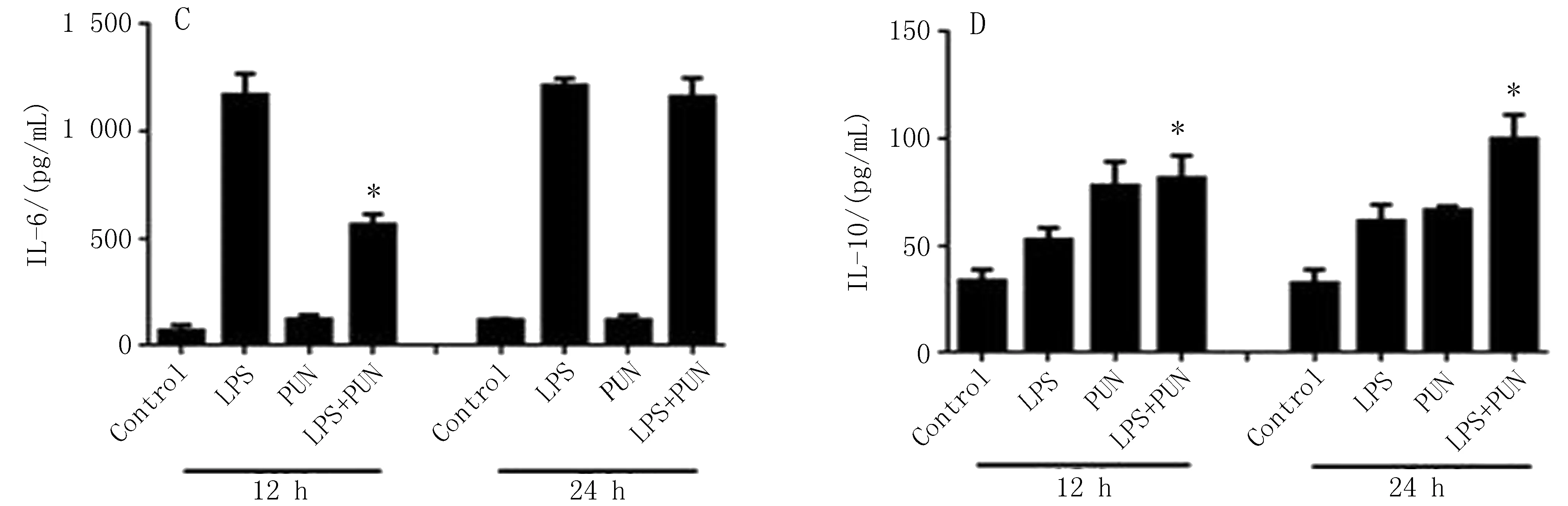
图5 PUN干预后的原代腹腔巨噬细胞细胞上清中M1/M2型巨噬细胞相关性因子的表达水平
2.5Westernblot法检测PUN对M1/M2型极化相关蛋白iNOS和Arg-1表达的影响与LPS组比较,PUN在不同时间点(12、24 h)对原代腹腔巨噬细胞作用下,可下调M1型巨噬细胞表征性酶iNOS的蛋白表达量,差异有统计学意义(P<0.05),但对于M2型巨噬细胞表征性酶Arg-1的蛋白表达量作用不明显,差异无统计学意义(P>0.05),见图6。

图6 PUN干预后的原代腹腔巨噬细胞中M1/M2型巨噬细胞相关酶的蛋白水平
3 讨论
创面愈合是为弥补皮肤组织缺损而继发的具有序惯性和时相性的病理生理过程。整个愈合过程有多种细胞和细胞因子共同参与,最主要的有巨噬细胞、成纤维细胞、表皮细胞、血管形成细胞以及白介素、表皮生长因子、成纤维细胞生长因子等,这些细胞与细胞外因子的协同作用,可促进创面的组织再生和表皮形成[7]。经测定 PUN是石榴皮多酚中最主要的活性成分,约占石榴皮多酚提取物中含量的60%~70%。本课题组通过石榴皮总多酚外用给药对急性皮肤创伤的单纯性创伤和细菌感染性创伤模型都具有良好的促愈合作用[8];另外本课题组制备的石榴皮多酚凝胶,对糖尿病大鼠慢性皮肤溃疡2种模型均有良好的愈合效果,并通过组织学、免疫组化及分子生物学实验揭示石榴皮多酚凝胶对糖尿病慢性皮肤创伤愈合作用机理。但PUN是否通过调控巨噬细胞而发挥促愈作用尚不清楚。本研究检测了PUN作用于巨噬细胞后,对转化生长因子(transforming growth factor-β,TGF-β)、血管内皮生长因子(vascu1ar endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factors,FGF)血小板源性生长因子(platelet-derived growth factor,PDGF)等生长因子的影响。结果显示, PUN对上述部分生长因子并无正性调控作用。
巨噬细胞主要可分为M1型和M2型,M1型巨噬细胞高表达诱导性一氧化氮合酶(inducible nitric oxide synthases,iNOS)、白介素-6(interleukin-6,IL-6)等,主要特点是促进炎症,参与正向免疫调节,被认为在吞噬病原微生物和促发细胞性免疫反应中起关键作用。M2 型巨噬细胞高表达精氨酸酶1(arginase 1,Arg-1)、白介素-10 (interleukin-10,IL-10)等,可下调免疫应答,主要表现为抗炎症,吞噬病原微生物能力减弱,在组织修复及针对寄生虫的体液细胞免疫过程中发挥作用[9-10]。有研究表明[11-12]用石榴汁及几种石榴皮提取物进行相关实验,发现石榴汁由于可以使炎性M1型巨噬细胞表型转换为抗炎M2型,从而抑制随着动脉粥样硬化的发展使得衰老的主动脉进行性前炎症状态。其中,在细胞系J774.A1中,用LPS+IFNγ诱导该细胞系向M1型极化,ELISA结果显示,发现PUN作用24 h后可下调IL-6的水平;IL-4诱导该细胞系向M2型极化,发现PUN作用24 h后可上调IL-10的水平。但该作者并未提及iNOS、Arg-1的表达。本研究结果,进一步证实了前人有关PUN是否促进巨噬细胞M1向M2极化的结果。但PUN促进M1向M2型转化的机制尚不清楚,还需后续的实验证实。
