微塑料暴露对罗非鱼肌肉中磺胺甲噁唑残留的影响
2018-09-28张石云张敬卫陈泽秋裘丽萍陈家长
张石云,宋 超,张敬卫,陈泽秋,张 聪,裘丽萍,陈家长,②
〔1.南京农业大学无锡渔业学院,江苏 无锡 214081;2.中国水产科学研究院淡水渔业研究中心,江苏 无锡 214081;3.农业农村部水产品质量安全环境因子风险评估实验室(无锡),江苏 无锡 214081;4.农业农村部水产品质量安全控制重点实验室,北京 100000〕
塑料及其制品为人类生产活动及日常生活提供了极大便利,据统计,全球每年使用塑料不少于2.4亿t[1]。然而,塑料的难降解性造成了严重的环境污染问题[2]。目前,主要采用回收和填埋方式来缓解塑料污染压力,但仍有大量塑料残体进入水环境[3]。这些塑料残体受到太阳辐射(光降解、脆化)或波浪等作用,并且在长期的物理、化学作用下会分解成更为微小的塑料碎片或颗粒[4-5],当其直径小于5 mm时即成为微塑料(micro-plastics)[6]。我国的太湖[7]、长江入海口[8]、渤海湾[9]和江汉平原的内陆湖泊与河流[10]等地区水体和沉积物中均存在严重的微塑料污染,以太湖为例,平均每升地表水中有25.6个微塑料颗粒。此外,在人迹罕至的西藏高原湖泊[11]也存在微塑料,可见,我国水环境中微塑料污染非常普遍且严重。
近年来,我国水产养殖行业迅猛发展,抗生素发挥了很大作用。抗生素不仅能防治细菌性疾病[12],还能促进养殖鱼类生长[13],因此,大量抗生素通过拌料投喂或泼洒方式进入养殖池塘中[14-15]。对环太湖水产养殖区抗生素使用情况的调查结果表明磺胺类是被广泛使用的一类抗生素;其中,磺胺甲噁唑(sulfamethoxazole,SMZ)是被广泛使用的磺胺类抗生素之一[16]。在养殖过程中,SMZ常在高温养殖季节用来防治细菌性疾病,保证养殖鱼类的正常生长。然而,抗生素能提高动物饲料转化效率和促进生长的特性,使得SMZ预防性使用变得普遍化,导致SMZ在我国养殖水环境和周边水域环境中处于“伪持久”状态。抗生素污染排查研究结果表明太湖[17]、长江三角洲[18]、渤海湾[19]和武汉[20]等地区水体和沉积物中均有不同程度的SMZ残留。尽管暂时尚未有养殖池塘中存在微塑料的报道,但作为养殖用水的源头,如上述江河湖泊和地下水等均有不同程度的微塑料污染。因此,无论是在养殖池塘中还是在野外水环境中,SMZ和微塑料均可能同时存在。
研究表明微塑料不仅能够给各种微生物提供生存和繁殖场所[21],还可以富集多种有毒化学物质[22];此外,在海洋无脊椎动物[23]、鱼类[24]、海鸟[25]和哺乳动物[26]体内能检测到微塑料,这表明水环境中的微塑料可能会被鱼类吞食。微塑料和抗生素对水环境和水生生物的影响是国内外高度关注的研究热点,但微塑料和抗生素的复合暴露研究较鲜见。此外,有关在水产养殖过程中,微塑料对SMZ的吸附作用影响SMZ在养殖系统中的归趋,以及养殖鱼类吞食微塑料后可能对鱼体SMZ残留量和SMZ消化吸收产生影响的研究尚鲜见。笔者拟以环境微塑料污染水平为参照标准设置无、低和高3个微塑料暴露组来研究微塑料对罗非鱼肌肉中SMZ残留的影响,为后续研究微塑料对抗生素在养殖系统中的迁移转化、微塑料在养殖水环境中的生态风险以及在微塑料影响下抗生素对养殖鱼类和渔业环境的生理生态风险提供一定的理论依据。
1 材料与方法
1.1 试剂与材料
微塑料:聚苯乙烯交联微球,实际粒径为20~50 μm(购自天津倍思乐色谱技术开发中心)。将原液稀释50倍后定量显微观察(3个重复操作)得到原液浓度约为64 500 粒·mL-1。微塑料原液稀释50倍后在40倍显微镜下的视野观察图见图1。

20和50 μm尺寸用来表示微塑料粒径,1 000 μm为比例尺。
SMZ纯度w>98.0%,25 g·瓶-1〔购自梯希爱(上海)化成工业发展有限公司〕。采用液质联用仪检测SMZ标准品(w>98%,购自安普)和供试药品中SMZ含量。两者均配制1、5、10、20和50 μg·L-15个浓度供液质联用仪检测,检测结果(表1)表明两者在同一浓度下响应基本一致,说明该药品纯度w在98%以上,符合试验要求。
表1SMZ标准品和SMZ药品在液质联用仪上的响应值对比
Table1ThecomparisonoftheresponsevaluesofSMZstandardproductsandSMZdrugsundertheinstrument(LC/MS)

ρ/(μg·L-1)响应值SMZ标准品SMZ药品1 490 50752 0012 197104 6894 559209 2019 1795023 71323 201
仪器:液质联用仪(Waters,TQD),粉碎机,涡旋振荡器,移液枪,离心机,分析天平等。其他试剂与材料:乙腈、甲醇、甲酸和乙酸乙酯均为色谱纯,水为超纯水。
1.2 试验设计
1.2.1SMZ与微塑料剂量
参考SC/T 1084—2006《磺胺类药物水产养殖使用规范》[27],考虑到实际生产中SMZ使用的浮动性,确定低剂量(20 mg·kg-1·d-1)、中剂量(即SC/T 1084—2006推荐的治疗剂量,200 mg·kg-1·d-1)和高剂量(为正常剂量的5倍,1 000 mg·kg-1·d-1)3种SMZ添加量,将其换算成饲料中SMZ含量分别为0.67、6.67和33.33 g·kg-1。饲料配方:小麦粉、w=43%的豆粕、菜粕、棉粕、纯米糠、磷脂粉、豆油、磷酸二氢钙、国产鱼粉、w=50%的氯化胆碱、VC和维生素矿物质预混料的质量含量分别为18.35%、24%、27%、10%、10%、1%、1%、1.5%、6%、0.1%、0.05%和1%,饲料中蛋白质和脂肪的质量含量分别为31.6%和4.9%。
微塑料暴露,选取粒径为20~50 μm的聚苯乙烯交联微球,根据太湖微塑料污染水平[7],同时考虑60%~70%的微塑料沉降率[28],以及微塑料污染增加趋势,设置无、低(130 粒·L-1,即太湖水环境中微塑料残留水平)和高(1 300 粒·L-1,10倍太湖水环境中微塑料残留水平)3个梯度微塑料暴露组。
1.2.2养殖组与养殖周期设定
制作含不同剂量SMZ的4种饲料,即空白(NS,不添加SMZ, SMZ含量实测值约为0.019 g·kg-1)、低SMZ(LS)、中SMZ(MS)和高SMZ(HS)剂量,设置无微塑料(NP)、低微塑料(LP)和高微塑料(HP)3种养殖水体环境,塑料处理和SMZ剂量处理一一对应形成12个不同养殖条件处理组:NPNS、NPLS、NPMS、NPHS、LPNS、LPLS、LPMS、LPHS、HPNS、HPLS、HPMS和HPHS。每组设置3个平行,共计36个养殖缸,每池罗非鱼初始数量为30尾;养殖缸体积为500 L,养殖水体体积为400 L。
养殖周期为8周,所有SMZ饲料投喂组(LS、MS和HS)投喂4周后改投喂空白饲料。第4、6和8周采集鱼肌肉(采样时间距最近投饲时间为12~16 h),每次采样每组样本数为 5 条,肌肉混匀均质后测定其SMZ残留量。每天投喂量为鱼体总质量的3%,分9:00和15:00两次投喂。保证养殖环境稳定、适宜。为减少影响SMZ含量的因素,整个养殖试验不换水。
整个养殖试验鱼生长正常,养殖至4周时,平均饵料系数为1.14±0.11。
1.2.3试验鱼类
以罗非鱼(Oreochromisniloticus)苗种〔(16.33±0.50) g〕为研究对象,用液质联用仪测得其肌肉中SMZ含量初始值约为4.39 μg·kg-1。
1.3 SMZ测定方法
鱼肌肉和饲料中SMZ含量均采用分散固相萃取-液质联用法测定。除提取液不同外,其他前处理步骤及仪器条件均一致。鱼肉提取液为10 mL乙腈(4 925 μL)、乙酸乙酯(4 925 μL)和甲酸(50 μL)混合物,饲料提取液为10 mL纯乙腈。
1.3.1样品前处理
(5±0.01) g饲料或鱼肉和10 mL提取液,按2 000 r·min-1涡旋混匀15 min,以12 000 r·min-1离心5 min(相对离心力为15 576);用5 mL纯水活化脂质去除净化管(EMR-Lipid净化管)后取5 mL提取液的上清液到净化管中,按2 000 r·min-1涡旋混匀5 min,以4 000 r·min-1离心5 min(相对离心力为2 486);将离心后的上清液移取到含1.7 g EMR-Lipid Polish MgSO4的离心管中,按2 000 r·min-1涡旋混匀5 min,以4 000 r·min-1离心5 min(相对离心力为2 486);取上层有机相待稀释相应倍数后上机检测。
1.3.2仪器条件
色谱条件:色谱柱为ACQUITY UPLC BEH C18 1.7 μm,2.1×50 column;流动相:φ=0.1%的甲酸甲醇溶液,φ=0.1%的甲酸水溶液;流速为0.3 μL·min-1;柱温设为30 ℃;自动进样器温度设为10 ℃;进样量为5 μL。梯度洗脱程序见表2。
表2液相梯度洗脱程序
Table2ThegradientelutionofHPLCprogram
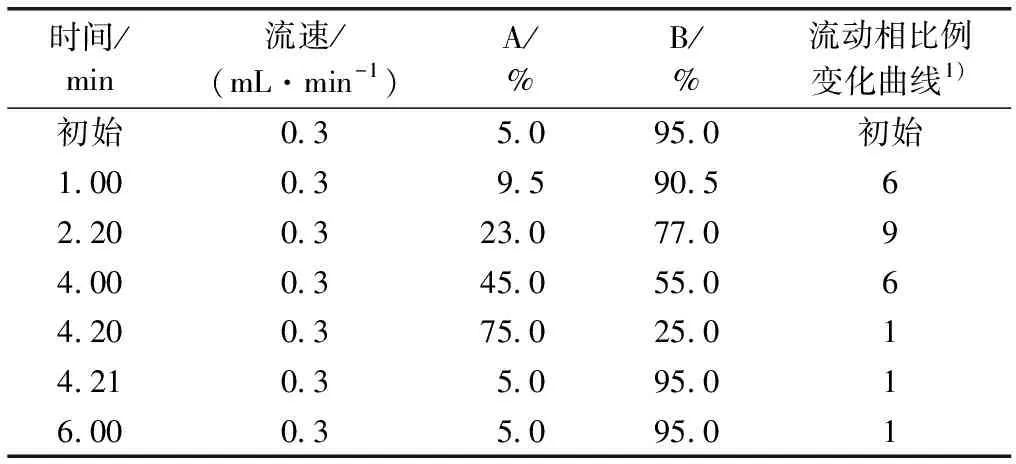
时间/min流速/(mL·min-1)A/%B/%流动相比例变化曲线1)初始0.35.095.0初始1.000.39.590.562.200.323.077.094.000.345.055.064.200.375.025.014.210.35.095.016.000.35.095.01
A为φ=0.1%的甲酸甲醇溶液,B为φ=0.1%的甲酸水溶液。1)此列中的6表示流动相呈线性变化,1表示流动相呈开始迅速、后期平缓变化,9表示流动相呈开始缓慢、后期迅速变化。
质谱条件:电喷雾离子源(ESI+);多反应检测模式(MRM)。毛细管电压为3.5 V;离子源温度为150 ℃;脱溶剂气温度450 ℃;脱溶剂气流速为800 L·h-1;锥孔气流速为50 L·h-1;碰撞能量为3 V。MRM监测模式下SMZ的母离子质荷比(m/z)为254.145;定量子离子m/z为92.084,锥孔电压和碰撞能量分别为36和40 V;定性子离子m/z为155.974,锥孔电压和碰撞能量分别为36和28 V;保留时间为0.77 min。
1.3.3质量控制
选择1、5、10、20和50 μg·L-1浓度梯度绘制标准曲线和加标曲线,曲线线性良好,回归系数均大于0.998;选取1、10和50 μg·L-1浓度梯度做3个重复加标回收率试验,回收率在78.65%~116.50%之间。样品上机检测限(3倍信噪比,3S/N)和定量限(10倍信噪比,10S/N)均小于0.01 μg·kg-1。
1.4 数据处理
采用Microsoft Excel 2013软件整理分析数据,采用SPSS 20.0软件进行差异显著性分析(P<0.05表示差异显著),采用Graphpad Prism 5.01和Microsoft Office 2013软件作图。
2 结果与分析
2.1 不同养殖时段罗非鱼肌肉中SMZ残留量
整个养殖试验周期内,在微塑料暴露浓度相同条件下,不同剂量SMZ饲料投喂组鱼肉中SMZ残留量总是呈HS>MS>LS>NS这一规律;HS、MS和LSNP为无塑料,LP为低塑料,HP为高塑料;NS为无磺胺,LS为低磺胺,MS为中磺胺,HS为高磺胺。就同一试验时间同一SMZ添加量而言,同一列数据后英文小写字母不同表示不同梯度微塑料暴露组间SMZ残留量差异显著(P<0.05)。
饲料组改投NS饲料后,鱼肉中SMZ含量均迅速下降(表3)。
表3不同养殖时间不同微塑料和SMZ饲料处理组鱼肉中SMZ残留量
Table3TheSMZresiduesinfishmuscleofdifferenttreatmentgroupsunderdifferentconcentrationofmicro-plasticsandSMZfeed
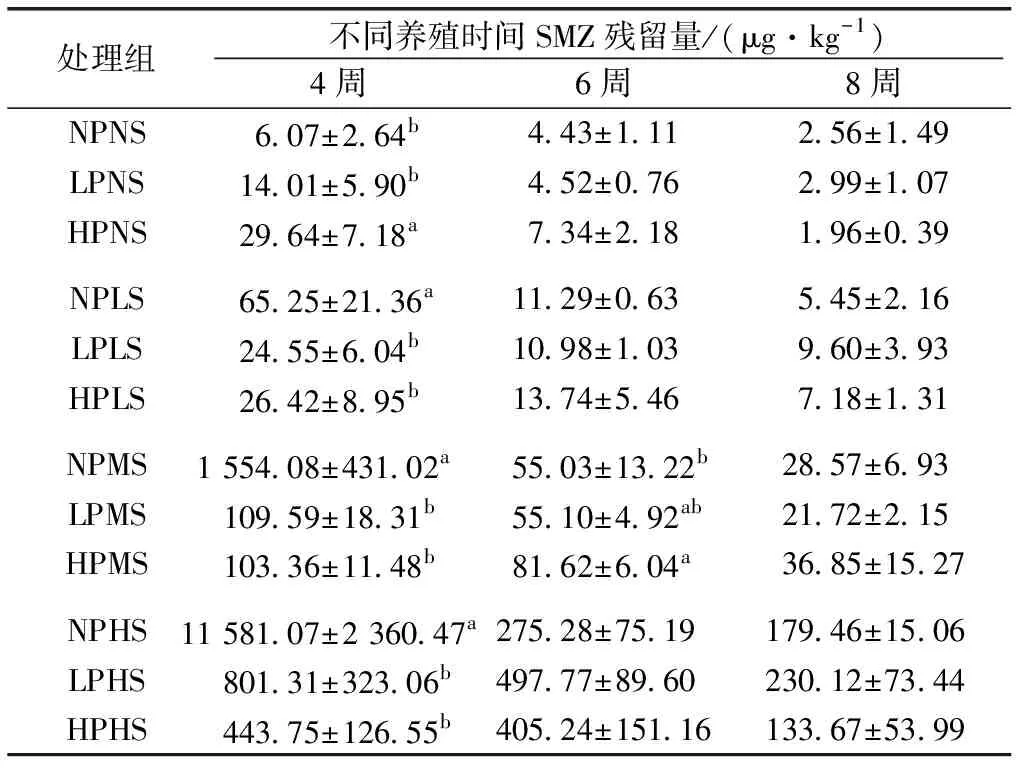
处理组不同养殖时间SMZ残留量/(μg·kg-1)4周6周8周NPNS6.07±2.64b4.43±1.112.56±1.49LPNS14.01±5.90b4.52±0.762.99±1.07HPNS29.64±7.18a7.34±2.181.96±0.39NPLS65.25±21.36a11.29±0.635.45±2.16LPLS24.55±6.04b10.98±1.039.60±3.93HPLS26.42±8.95b13.74±5.467.18±1.31NPMS1 554.08±431.02a55.03±13.22b28.57±6.93LPMS109.59±18.31b55.10±4.92ab21.72±2.15HPMS103.36±11.48b81.62±6.04a36.85±15.27NPHS11 581.07±2 360.47a275.28±75.19179.46±15.06LPHS801.31±323.06b497.77±89.60230.12±73.44HPHS443.75±126.55b405.24±151.16133.67±53.99
由表3可知,试验4周时,鱼肉中SMZ残留量表明,投喂SMZ饲料期间,HS、MS、LS和NS饲料组鱼肉中SMZ残留量与有无微塑料暴露密切相关。在投喂HS、MS和LS饲料条件下,所有微塑料暴露组鱼肉中SMZ残留量均显著低于无微塑料组(P<0.05);然而,相同剂量SMZ饲料投喂条件下,微塑料浓度高低对鱼肉中SMZ残留量的影响却无显著差异(P>0.05);NS饲料投喂条件下HPNS分别与LPNS、NPNS处理组之间鱼肉中SMZ残留量存在显著差异(P<0.05),LPNS和NPNS处理组之间无显著差异(P>0.05)。6周时,只有MS饲料投喂条件下HPMS与NPMS处理组之间鱼肉中SMZ残留量存在显著差异(P<0.05),其余剂量SMZ饲料投喂条件下有无微塑料组之间鱼肉中SMZ残留量均无显著差异(P>0.05);8周时,4种SMZ饲料投喂条件下不同微塑料处理组(NP、LP和HP)之间鱼肉中SMZ残留量均无显著差异(P>0.05)。
因此,鱼肉中SMZ残留量不仅与饲料中SMZ添加量有关,还与微塑料暴露密切相关;同时上述结果还表明微塑料暴露对鱼肉中SMZ残留量的影响可能与是否有源源不断的SMZ投入相关。
2.2 微塑料暴露对鱼肉中SMZ残留量的动态影响
2.2.1NS饲料投喂组鱼肉中SMZ残留的动态变化
供试NS饲料也含有一定量SMZ(0.019 g·kg-1),这是由于饲料原料中含有SMZ。由图2可知,从鱼肉中SMZ残留量随养殖时间的变化规律来看,LPNS和HPNS处理组鱼肉中SMZ残留量的动态变化规律:从养殖试验开始至第6周,鱼肉中SMZ残留量达到最大值之后开始下降并趋于平稳;NPNS处理组鱼肉中SMZ残留量随养殖时间无明显变化。试验4和6周时鱼肉中SMZ残留量从高到低依次为HPNS、LPNS和NPNS,4周时差异显著高于6周时;到8周时各组之间鱼肉中SMZ残留量基本无显著差异。所有NS饲料投喂的各微塑料处理组在整个养殖试验周期内,鱼肉中SMZ残留量均低于原农业部235公告[29]规定的最大限量值(MRLs值,100 μg·kg-1)。
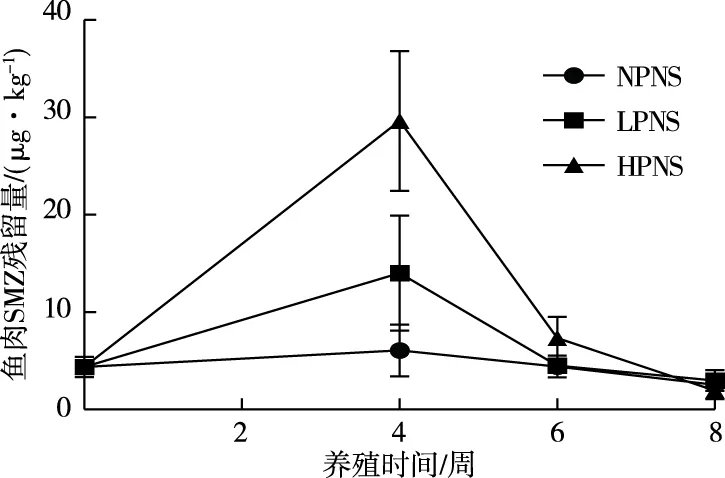
NP—无塑料;LP—低塑料;HP—高塑料。
2.2.2LS、MS和HS饲料投喂条件下不同浓度微塑料暴露组鱼肉中SMZ残留的动态变化
从鱼肉中SMZ残留量随养殖时间的变化规律来看,LS、MS和HS饲料投喂条件下各微塑料暴露组鱼肉中SMZ残留量的动态变化规律为从养殖试验开始至前4周鱼肉中SMZ残留量达到最大值之后开始降低。鱼肉中SMZ残留量显示,饲养至4周时LS、MS和HS饲料投喂条件下HP和LP处理组均显著低于NP处理组,6周时各微塑料暴露组之间鱼肉中SMZ残留量基本无显著差异(图3)。从4~8周时LS、MS和HS饲料投喂条件下各微塑料暴露组鱼肉中SMZ含量的下降比例来看,NP暴露组下降速度及比例明显高于HP和LP暴露组(图4)。
在整个养殖试验周期内,LS饲料投喂条件下各微塑料暴露组鱼肉中SMZ残留量均低于MRLs值。试验4周时MS饲料投喂条件下各微塑料暴露组鱼肉中SMZ残留量均略高于或高于MRLs值,6和8周时鱼肉中SMZ残留量均低于MRLs值。在整个养殖试验周期内,HS饲料投喂条件下各微塑料暴露组鱼肉中SMZ残留量均高于MRLs值(图3)。

NP—无塑料;LP—低塑料;HP—高塑料。
3 讨论
3.1 影响罗非鱼肌肉中SMZ残留差异的可能归因
在养殖池塘中,拌料投喂SMZ是鱼肉中SMZ残留的主要来源。SMZ被鱼消化吸收后,肌肉中SMZ残留量会在短短数小时内达到峰值,然后迅速下降;20 ℃条件下,罗非鱼口灌SMZ(剂量为100 mg·kg-1),肌肉中SMZ残留量6 h时就达到峰值(12.8 mg·kg-1),12和24 h时分别为3.96和1.69 mg·kg-1,36和72 h时分别为0.37和0.05 mg·kg-1[30]。根据SMZ的药代动力学数据可知,每次投喂的SMZ在3 d后其残留量相对于最近一次用药的残留量可忽略不计;因此,可推断鱼肉中SMZ含量主要与前2 d是否投喂SMZ有关。此外,拌料投喂与口灌给药方式不同,饲料被不完全摄食,会导致同一剂量条件下前者被鱼类吸收的有效成分会显著低于后者。试验4周时NPLS、NPMS和NPHS处理组鱼肉中SMZ残留量分别为(65.25±21.36)、(1 554.08±431.02)和(11 581.07±2 360.47) μg·kg-1(表3);其中,NPMS鱼肉中SMZ含量接近口灌一次给药24 h后肌肉中SMZ含量(1.69 mg·kg-1),改投NS饲料后鱼肉中SMZ含量快速下降,证明鱼肉中SMZ含量主要与前2 d投喂SMZ有关。因此,无微塑料条件下罗非鱼肌肉中SMZ残留量主要取决于饲料中SMZ添加量和72 h内是否投喂SMZ。
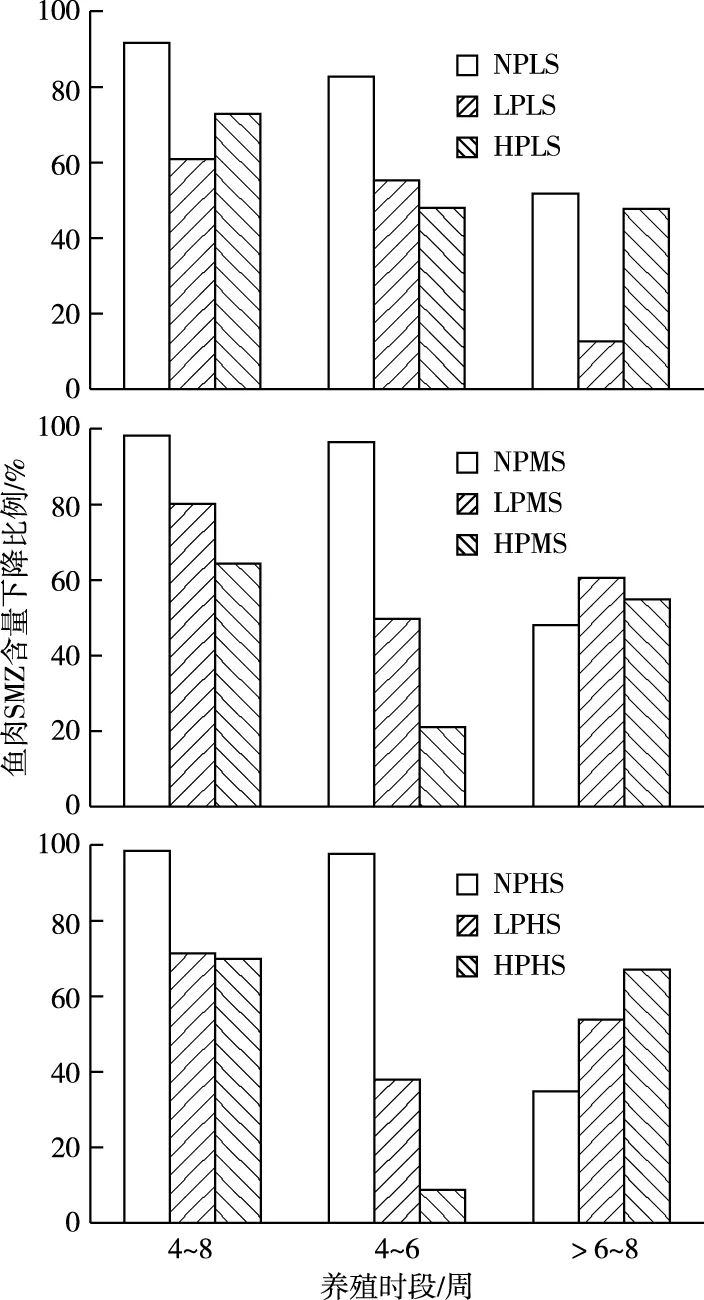
LS—低磺胺;MS—中磺胺;HS—高磺胺;
试验4周时鱼肉中SMZ残留量结果显示,在投喂相同剂量SMZ饲料条件下,微塑料的存在会显著降低鱼肉中SMZ残留量。有研究表明,水生生物摄入微塑料后会导致假性饱食进而影响摄食量[31-32];然而,笔者试验中,供试罗非鱼平均饵料系数为1.14±0.11,说明微塑料并未影响鱼类的摄食能力,因此排除20~50 μm微塑料影响鱼类摄食进而影响鱼肉中SMZ残留量的可能。那么,在SMZ摄食量一致的情况下,不同微塑料暴露组罗非鱼对SMZ的消化吸收差异可能是肌肉SMZ含量存在差异所致。>20 μm粒径微塑料不能进入组织细胞,只会在肠道、鳃和鱼体表面累积附着[33],这说明笔者试验中微塑料可能并未进入细胞中。因此,在微塑料暴露下,鱼体对SMZ的消化吸收差异可能与肠内壁微塑料的累积与附着有关,造成这种差异的原因需要进一步研究。
研究表明,<200 μm粒径微塑料可能具有转移持久性有机污染物(POPs)的能力[34],张凯娜等[35]发现微塑料在环境中能通过分子间的范德华力和微孔填充机制吸附抗生素;笔者所在课题组通过向SMZ溶液中添加微塑料后检测SMZ浓度,发现微塑料的存在能显著降低溶液中SMZ浓度,说明微塑料对SMZ具有较强的吸附能力。值得一提的是,水体中60%~70%的微塑料会迅速沉降至养殖缸底部[28]。因此,水体和底层沉积物中可能存在大量微塑料。而被鱼类摄入的抗生素中有40%~90%会以母体或代谢物形式随尿液和粪便排出体外而进入养殖环境中[36-37]。考虑到微塑料对环境微生物、微粒和SMZ的吸附能力,推测养殖池塘的水体和沉积物中可能存在大量富含微塑料和SMZ的颗粒,而这些颗粒的存在为SMZ再次进入鱼体提供可能。因此微塑料和SMZ颗粒的存在也许是在停止投喂SMZ后,微塑料暴露组鱼肉中SMZ残留量相对平缓下降的原因。
在监测鱼肉中SMZ含量的同时,笔者还测定了水体中SMZ浓度(表4)。试验4周时,水体中SMZ浓度受微塑料的影响恰与微塑料对肌肉中SMZ残留量的影响相反,相同剂量SMZ饲料投喂条件下,微塑料暴露组水体中SMZ浓度均高于无微塑料暴露组;水体SMZ浓度升高可能归因于鱼体对SMZ的消化吸收差异。因此,微塑料暴露显著降低鱼肉中SMZ含量,可能是因为微塑料降低了鱼对SMZ的消化吸收能力,并随着排泄物排除体外。试验6周时,水体SMZ浓度则与4周时相反,相同剂量SMZ饲料投喂条件下,微塑料暴露组水体中SMZ浓度均显著低于无微塑料暴露组;然而,水体中SMZ含量的这种差异并未影响肌肉中SMZ残留量。
表4不同养殖时间不同微塑料和SMZ饲料处理组水体中SMZ残留量
Table4TheSMZresiduesinwaterofdifferentmicro-plasticsandSMZfeedtreatmentgroups

处理组不同养殖时间SMZ残留量/(μg·kg-1)4周6周8周NPLS37.79±5.0192.81±28.800.87±0.07LPLS81.97±6.101.17±0.681.41±0.98HPLS49.26±4.951.85±0.420.84±0.63NPMS616.90±11.981 216.91±18.466.30±1.63LPMS802.09±90.795.56±0.514.82±0.59HPMS1 026.31±198.07317.40±25.873.13±1.83NPHS2 217.24±51.263 127.66±369.7915.24±8.16LPHS2 807.77±43.239.16±1.3011.30±3.22HPHS3 290.06±405.091 214.75±121.3613.40±7.18
NP为无塑料,LP为低塑料,HP为高塑料;LS为低磺胺,MS为中磺胺,HS为高磺胺。
3.2 微塑料对罗非鱼SMZ膳食风险的影响
抗生素在确保养殖鱼类健康生长、产量提高的同时,伴随而来的风险问题也日益突出。长期食用含有磺胺类抗生素的农产品会导致人体内磺胺严重积累从而引起过敏或引发由耐药细菌引起的化学中毒,严重损害人体健康[38-39],因此,鱼肉中抗生素残留带来的膳食风险一直备受关注。拌料投喂SMZ时,微塑料能够显著降低由拌料投喂SMZ进入鱼体所致的肌肉中SMZ残留,但4周时LPMS和HPMS处理组鱼肉中SMZ残留量〔(109.59±18.31)和(103.36±11.48) μg·kg-1〕仍然接近于原农业部235公告规定的最大限量值(MRLs,100 μg·kg-1)[29],表明低于治疗剂量未经休药时,微塑料能够降低SMZ的膳食风险。SMZ休药期为12 d(原农业部235公告)[29],6周时SMZ残留量表明,休药后鱼肉中SMZ残留量与微塑料暴露与否基本无关。然而,从4~8周时LS、MS和HS饲料投喂条件下各处理组鱼肉中SMZ含量下降比例来看,NP处理组下降速度及比例明显高于HP和LP处理组;同时,考虑到微塑料对环境中微生物、微粒和SMZ的吸附能力使得养殖池塘水体和沉积物中可能存在大量富含微塑料和SMZ的颗粒,这些颗粒的存在为SMZ再次进入鱼体提供可能,拖延了鱼肉SMZ残留下降时间。这种现象可能造成在较长时间内肌肉中SMZ残留量恒定,从而增加SMZ的膳食风险。
4 结论
拌料投喂SMZ时,养殖水环境中微塑料的存在能显著降低鱼肉中SMZ残留量。休药时间超过2周后,鱼肉中SMZ残留量基本无明显变化,说明微塑料对鱼肉中SMZ残留量的影响取决于是否有一定量的SMZ投入。停止投喂SMZ后,微塑料暴露下其拖延鱼肉SMZ残留下降的现象可能会增加SMZ的膳食风险。
