子宫内膜癌患者肿瘤组织和血清中SOX1和VIM启动子的甲基化检测及其临床意义
2018-09-26舒新红范红莉李小燕
舒新红 范红莉 李小燕
子宫内膜癌(endometrial carcinoma,EC)是女性生殖系统最常见的恶性肿瘤之一,绝大多数为雌激素依赖型(即Ⅰ型)子宫内膜样腺癌[1]。国内外研究均表明[2-3],EC的发病率不断增长,且趋于年轻化,美国等发达国家EC发病率高居妇科恶性肿瘤首位,中国EC的总死亡率居妇科恶性肿瘤第二位。表观遗传学改变在肿瘤的形成过程中起重要作用,尤其是基因启动子区异常甲基化,可造成抑癌基因沉默,从而促进肿瘤的发生、发展[4]。性别决定区Y框蛋白1(sex determining region Y-box 1,SOX1)属于SOX家族,具有调控胚胎神经系统和晶状体发育的作用。研究发现[5],SOX1在多种肿瘤中呈现低表达,且发现SOX1基因启动子区发生甲基化。波形蛋白(vimentin,VIM)属于中间丝家族,主要在结缔组织中表达,作用在于维持细胞形态、保持细胞质完整等。研究发现,VIM基因启动子区异常甲基化与乳腺癌、宫颈癌等多种癌症有关,但其在EC患者血清中的甲基化情况还未见报道[6]。本研究采用甲基化特异性PCR(methylation specific PCR,MSP)技术检测EC患者血清中SOX1、VIM基因启动子的甲基化状态,并探讨其对EC的临床意义。
1 材料与方法
1.1 研究对象
选择英山县人民医院2013年7月至2015年12月收治的120例EC患者为观察组,年龄33~76岁,平均(52.62±12.24)岁,平均体质指数(26.86±2.53)kg/m2,其中绝经期患者38例,所有患者均经病理检查确诊,且术前无进行放化疗及激素治疗。根据2009年国际妇产科联盟的手术病理分期标准[7]:Ⅰ~Ⅱ级104例,Ⅲ~Ⅳ级16例;根据世界卫生组织EC组织分类标准[8]:子宫内膜样腺癌83例,浆液性腺癌23例,透明细胞腺癌14例;子宫肌层浸润深度<1/2者79例,浸润深度≥1/2者41例;淋巴结转移者25例,无淋巴结转移者95例。另选择同期于本院接受治疗的50例功能性子宫出血患者作为对照组,年龄35~70岁,平均(50.38±10.96)岁,平均体质指数(27.35±1.78)kg/m2,其中绝经15例。观察组与对照组的年龄、绝经情况、体质指数比较,差异无统计学意义(P>0.05)。所选受试者均排除心、肝、肾等器质性病变者。所有受试者均签署知情同意书,本研究经医院伦理委员会审核批准。
1.2 试剂和仪器
OIAamp DNA Blood Mini Kit购自德国Qiagen公司;QIAamp DNA Mini Kit购自德国Qiagen公司;EZ DNA Methylation-Gold Kit购自美国Zymo Research公司;Zymo Taq DNA Polymerase购自美国Zymo Research公司;SOX1,VIM基因启动子甲基化引物购自上海生工生物工程有限公司;溴化乙锭(EB)购自美国Sigma-Aldrich公司;琼脂糖购自西班牙Gene公司;微量移液器购自德国Eppendorf公司;离心机购自美国贝克曼库尔特公司,型号:Allegra X-12;斡旋震荡器购自广州仪科实验室技术有限公司;PCR仪购自德国Eppendorf公司;蛋白核酸测定仪购自Gene Quant公司;紫外灯箱购自美国Coleparmer公司;凝胶电泳图像分析系统购自上海复日科技有限公司。
1.3 方法
1.3.1 血液采集
采集受试者清晨空腹5 mL肘静脉血液,3 000 r/min离心5 min,取上清液分装于2 mL EP管中,保存于-80℃冰箱备用。
1.3.2 血清DNA的提取
分别用OIAamp DNA Blood Mini Kit和QIAamp DNA Mini Kit提取血清DNA和肿瘤组织DNA,实验操作方法严格按照说明书进行。用蛋白核酸测定仪测定DNA浓度及纯度,OD260/OD280在1.6~1.8之间的DNA样品用于后续实验。
1.3.3 DNA重亚硫酸盐修饰
用EZ DNA Methylation-Gold Kit对1 μg DNA进行重亚硫酸盐修饰。向PCR管中分别加入130 μL CT Conversion Reagent,20 μL DNA样品,震荡混匀,瞬时离心;将PCR管放入PCR仪中98℃10 min,64℃2.5 h,4℃保存;向PCR管中加入600 μL M-洗涤缓冲液,充分混匀;将混合溶液转移至套有2 mL收集管的Zymo-Spin TM IC柱中,离心30 s;依次向柱内加入100 μL M-Wash,200 μL M-脱磺化,200 μL M-Wash,10 μL M-Elution缓冲液,每次缓冲液加入后离心30 s;所得滤液即为修饰好的DNA,立即使用或于-20℃冰箱中保存。
1.3.4 SOX1、VIM基因启动子甲基化的检测
用SOX1和VIM基因启动子甲基化引物扩增修饰后的DNA,配制25 μL MSP反应体系:12.5 μL Premix Taq,1 μL修饰DNA,0.5 μL上游引物,0.5 μL下游引物和10.5 μL DNase-free H2O。MSP反应条件:95℃预变性5 min;95℃30 s,58℃40 s,72℃40 s,45个循环;72℃延伸10 min;4℃保存。最后用2%琼脂糖凝胶电泳,紫外灯箱中曝光,用凝胶电泳图像分析系统采集并分析图像数据,见表1。

表1 SOX1和VIM基因启动子甲基化引物Table 1 Methylation primers for the promoters of SOX1 and VIM genes
1.3.5 结果评定
甲基化引物扩增结果阳性,非甲基化引物阴性代表“完全甲基化”;甲基化引物扩增结果阳性,非甲基化引物阳性代表“部分甲基化”;甲基化引物扩增结果阴性,非甲基化引物阳性代表“未甲基化”。“完全甲基化”与“部分甲基化”认定为甲基化阳性,“未甲基化”认定为甲基化阴性。甲基化阳性率=甲基化阳性数/总例数×100%。
1.4 数据统计分析
本研究利用SPSS 20.0统计软件进行数据处理,计量资料采用表示,用t检验;计数资料用“率”描述,用χ2检验,并对单独及联合检测的灵敏度、特异度进行分析。当P<0.05时,差异有统计学意义。
2 结果
2.1 EC患者SOX1基因启动子甲基化情况
EC患者血清SOX1基因启动子甲基化率为71.67%,对照组血清SOX1基因启动子甲基化率为10.00%,2组间的差异具有统计学意义(P<0.05)。EC患者肿瘤组织SOX1基因启动子甲基化率为95.83%,对照组肿瘤组织SOX1基因启动子甲基化率为2.00%,2组间的差异具有统计学意义(P<0.05),见图1和表2。
2.2 EC患者VIM基因启动子甲基化情况
EC患者血清VIM基因启动子甲基化率为60.83%,对照组血清VIM基因启动子甲基化率为12.00%,2组间的差异具有统计学意义(P<0.05)。EC患者肿瘤组织VIM基因启动子甲基化率为94.17%,对照组肿瘤组织SOX1基因启动子甲基化率为4.00%,2组间的差异具有统计学意义(P<0.05),见图2和表3。

图1 SOX1基因启动子甲基化MSP检测结果Figure 1 The promoter of SOX1 gene MSP detection results
2.3 血清SOX1、VIM基因启动子甲基化与EC患者临床病理特征的关系
血清SOX1、VIM基因启动子甲基化水平与EC患者的病理分期、子宫肌层浸润深度、淋巴结转移情况有关(P<0.05),与HCC患者的年龄、肿瘤类型无关(P>0.05),见表4。
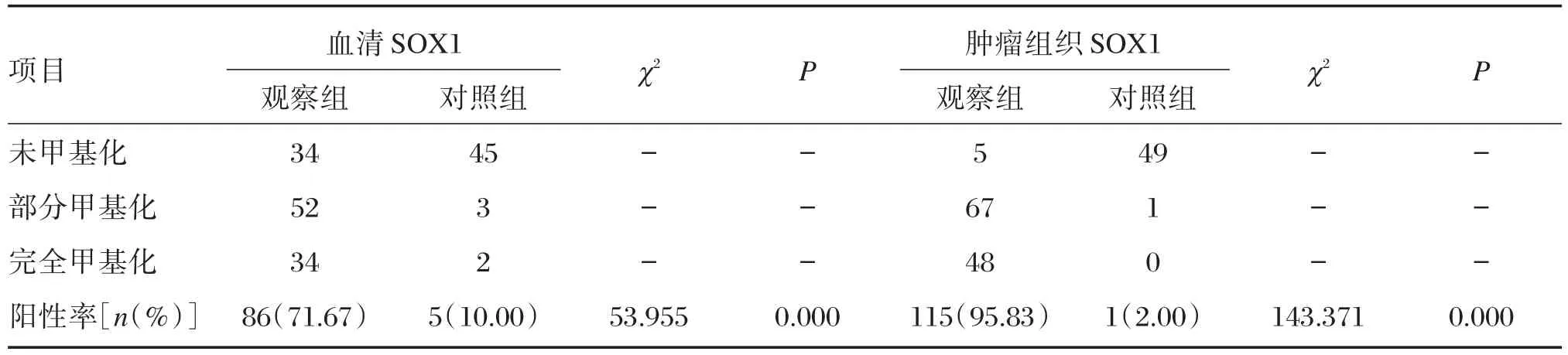
表2 血清及肿瘤组织SOX1基因启动子甲基化阳性数目统计Table 2 Statistics of methylation positivity of the promoter of SOX1 gene in serum and tumor tissues

图2 VIM基因启动子甲基化MSP检测结果Figure 2 The promoter of VIM gene MSP detection results
2.4 血清SOX1、VIM基因启动子甲基化对EC的诊断价值
血清SOX1、VIM启动子甲基化单独及联合诊断的灵敏度依次为71.67%、60.83%、81.67%,特异度依次为90.00%、88.00%、84.00%,准确度依次为77.06%、68.82%、86.47%。与SOX1、VIM单独诊断比较,联合诊断的灵敏度、准确度均显著升高(P<0.05);不同诊断方式的特异度比较,差异无统计学意义(P>0.05),见表5。

表3 血清及肿瘤组织VIM基因启动子甲基化阳性数目统计Table 3 Statistics of methylation positivity of the promoter of VIM gene in serum and tumor tissues
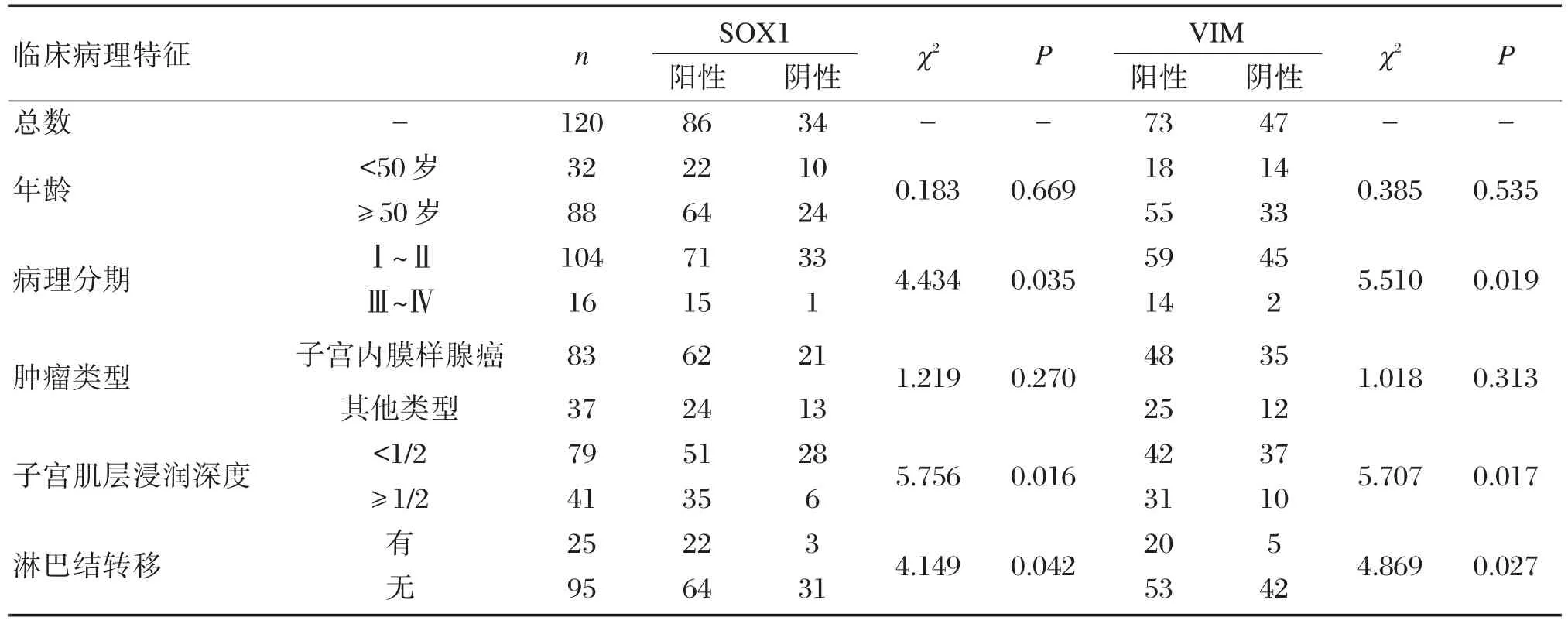
表4 血清SOX1、VIM基因启动子甲基化情况与EC患者临床病理特征的关系Table 4 Relationship between serum of the promoter of SOX1 and VIM methylation and clinicopathological characteristics of EC patients
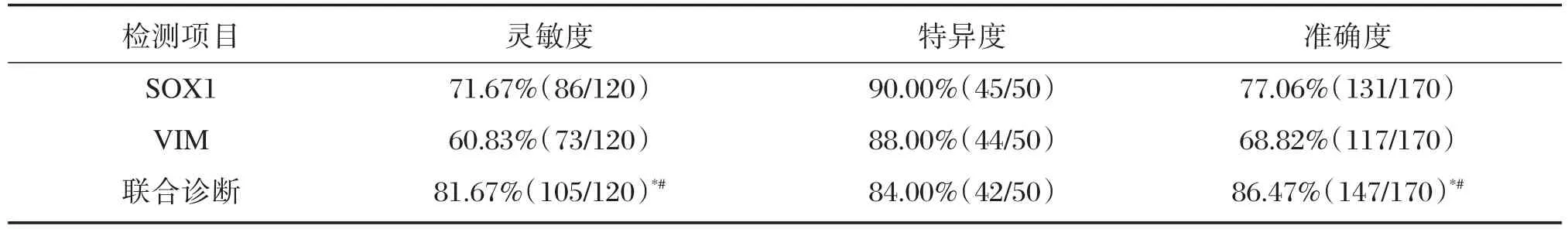
表5 血清SOX1、VIM启动子甲基化单独或联合诊断结果对比Table 5 Comparison of diagnostic results of serum of the promoter of SOX1 and VIM methylation alone or in combination
3 讨论
EC多发于中老年女性,在西方发达国家较为多发,在中国的发病率逐年上升[9]。目前关于EC的具体发病机制尚未明确,大部分研究者认为是遗传信息改变,内分泌因素及外界环境因素共同作用的结果[10]。虽然早期子宫内膜样腺癌(Ⅰ型)的预后比较好,然而晚期,复发性及Ⅱ型子宫内膜癌的预后极差,平均生存时间仅1年,及时治疗仍不能使中位生存时间提高。临床诊断EC的方法主要有诊断性刮宫、B超、电子计算机断层扫描(computed tomography,CT)、核磁共振成像(magnetic resonance imaging,MRI)、淋巴造影等。但B超难以分辨早期EC和子宫内膜炎;CT、MRI和淋巴造影步骤繁琐,费用昂贵,准确率仅为70%;诊断性刮宫不能确切评估病变范围,且可能会有漏诊或过度诊断[11-12]。因此,寻找经济高效的肿瘤标志物是目前医学领域研究的方向。
本研究对EC患者血清SOX1基因启动子甲基化率进行检测,结果显示,EC患者血清SOX1基因启动子甲基化率较对照组女性显著升高,EC患者肿瘤组织SOX1基因启动子甲基化率显著高于对照组。DNA甲基化是一种常见的表观遗传学改变,其可抑制靶基因的表达,进而参与肿瘤的形成过程。SOX1蛋白在多种肿瘤中呈现低表达,SOX1基因启动子甲基化功能近年颇受关注。刘志礼等[5]研究发现,宫颈癌组织中SOX1水平较良性组织明显降低,SOX1基因在宫颈鳞癌中呈现出高甲基化水平,甲基化率达81.5%,与本研究结果一致,说明EC患者血清SOX1启动子高甲基化水平,可用于EC的临床诊断。血清及肿瘤组织SOX1基因启动子甲基化水平与EC患者的病理分期、子宫肌层浸润深度、淋巴结转移情况有关,说明血清SOX1基因启动子甲基化水平越高,EC患者病情越严重,故血清SOX1启动子甲基化水平可一定程度上反映出EC患者病情的严重程度,其具体机制可能是SOX1基因启动子高甲基化而造成SOX1表达降低,对肿瘤细胞局部侵袭和远处转移的影响。
本研究发现,EC患者血清VIM基因启动子甲基化率显著高于对照组女性,EC患者肿瘤组织VIM基因启动子甲基化率显著高于对照组。VIM为间充质细胞的特异性标志物,在细胞粘附、微管组装和骨架重塑过程中发挥重要作用。有研究发现[6,13-14],VIM与上皮-间质转化过程有关,而上皮-间质转化过程是癌细胞侵袭、转移的重要过程;VIM还可影响细胞凋亡,其在胞质内能与p53蛋白结合,影响p53的入核过程,从而促进细胞凋亡。以上研究结果说明VIM高表达能够抑制癌细胞侵袭、转移,促进癌细胞凋亡,而EC患者血清及肿瘤组织VIM启动子高甲基化水平,导致VIM表达降低,可能利于癌细胞增殖、侵袭和转移。与患者临床病理特征关系结果显示,血清VIM基因启动子甲基化水平与EC患者的病理分期、子宫肌层浸润深度、淋巴结转移情况有关,说明血清VIM启动子甲基化水平可一定程度上反映出EC患者病情的严重程度,其具体作用机制可能是因为VIM基因启动子甲基化而造成VIM及其他相关基因表达降低,进而导致EC患者发生病理学改变,但是具体机制尚不明确,还有待进一步分析。
本研究结果表明,血清SOX1、VIM启动子甲基化对EC均有一定的诊断价值,而与单独指标检测相比,血清SOX1、VIM启动子甲基化联合检测诊断EC的灵敏度、准确度均显著升高,与相关研究结果一致[15-16],说明血清SOX1和VIM基因甲基化联合检测可用于临床EC的筛查及早期诊断,由于基因甲基化很容易在恶性肿瘤患者的个体或高危人群中检测到,因此对SOX1和VIM基因甲基化联合检测可进一步判定是否能作为临床筛查以及诊断的标准。
综上所述,EC患者血清SOX1、VIM启动子甲基化水平较对照组女性均显著升高,与患者病理分期、子宫肌层浸润深度及淋巴结转移情况有关,联合检测诊断EC的效能最高,说明SOX1和VIM基因甲基化是影响EC发生的潜在标志物,其联合检测可用于临床EC的筛查及早期诊断。然而,EC发生发展的机制复杂,血清SOX1、VIM启动子甲基化能否用于EC的临床诊断还需扩大样本进一步深入的探究。