原发性乳腺弥漫大B细胞淋巴瘤临床和病理特征
2018-09-26汪园园杨喆邓元常红云李晓锋张冠军刘希
汪园园 杨喆 邓元 常红云 李晓锋 张冠军 刘希
原发性乳腺弥漫大B细胞淋巴瘤(primary breast diffuse large B-cell lymphoma,PB-DLBCL)是恶性程度较高的淋巴瘤,约占原发性乳腺恶性肿瘤的0.5%,占非霍奇金淋巴瘤的1%,占结外淋巴瘤的3%[1]。由于PB-DLBCL进展较快,同时又较为少见,临床表现不典型,初诊时难以与乳腺癌或炎症等疾病区别,因此需重视对本病的诊治研究,避免误诊漏诊。尽管近年来证据表明,MYC基因重排已成为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)预后判断的重要指标之一[2],但在PB-DLBCL中MYC重排的情况仍少见报道。本研究分析西安交通大学第一附属医院8例PB-DLBCL的临床、病理组织学及免疫表型特点,采用原位杂交技术检测EB病毒编码的小RNA(epstein-Barr virus-encoded RNA,EBER)的表达,再使用荧光原位杂交(fluorescence in situ hybridization,FISH)技术检测MYC基因遗传学改变,探讨PB-DLBCL的临床病理及MYC基因遗传学特征,并进行文献复习,以加强对本病的认识。
1 材料与方法
1.1 材料
收集西安交通大学第一附属医院2010年1月至2018年4月在病理科确诊的8例PB-DLBCL。参照2008年国际结外淋巴瘤研究小组[3]提出的原发性乳腺淋巴瘤诊断标准和2016年世界卫生组织(World Health Organization,WHO)淋巴组织肿瘤分类修订版[2],本研究PB-DLBCL的纳入标准为:①患者无乳腺外恶性淋巴瘤的既往史;②乳腺为病变首发部位,可伴有同时性或继发性的同侧腋窝淋巴结累及;③镜下可见乳腺组织与恶性淋巴组织共存,淋巴瘤细胞浸润乳腺小叶和导管,而乳腺上皮细胞无恶变;④高年资病理医师复阅病理切片,满足2016年WHO淋巴组织肿瘤分类修订版中弥漫大B细胞淋巴瘤的病理诊断标准。结合临床及影像学检查结果,按照Ann Arbor分期系统,对纳入的病例进行分期[4]。
8例PB-DLBCL均为女性患者,发病年龄34~68岁(平均为53.1岁)。均以发现乳腺肿物为主诉就诊,病程1周~30年。7例患者均无皮肤红肿、溃疡,无乳头糜烂及溢液;1例患者肿物进行性增大并伴皮肤红肿,局部疼痛。所有患者均无发热、盗汗和体重下降等淋巴瘤的全身表现即B症状。6例患者血清乳酸脱氢酶(lactate dehydrogenase,LDH)正常,2例升高,分别为258.4 U/L和261.3 U/L。7例患者为单侧乳腺肿物,其中左侧5例,占62.5%,另1例患者为双侧乳腺肿物伴淋巴结累及。肿瘤最大直径1.8~7.4 cm,平均3.3 cm。行肿物穿刺活检术4例,占50%;行肿物局部切除活检术2例,占25%;行乳腺单纯切除术2例,占25%。根据Ann Arbor分期,ⅠEA期5例,ⅡEA期2例,ⅣE期1例(表1)。

表1 8例原发性乳腺弥漫大B细胞淋巴瘤的临床特征Table 1 Clinical features of the 8 cases of primary breast diffuse large B-cell lymphoma
1.2 方法
1.2.1 苏木精-伊红染色(hematoxylin-eosin staining,HE)、免疫组织化学染色和判读
病变组织均由4%中性福尔马林液固定、石蜡包埋和HE染色。免疫组织化学染色方法为柠檬酸缓冲液微波修复抗原,使用BenchMark Ultra Ventana(Roche公司,瑞士)全自动免疫组织化学染色仪,按照说明书进行EnVision两步法行免疫组织化学染色。即用型一抗抗体如下:LCA、CD20、CD79α、CD3、CD10、BCL6、MUM1、BCL2、C-MYC、ALK、CD30、Ki-67、CK,抗体购自北京中杉和福州迈新生物技术开发有限公司。染色均设阳性对照及阴性对照。CD10、BCL6、MUM1、BCL2和C-MYC的免疫组织化学染色结果的判读标准采用半定量法,计算10个高倍视野下阳性细胞百分数的平均值。阳性细胞>30%时为CD10、BCL6或MUM1(+),阳性细胞>50%时为BCL2(+)[2,5];阳性细胞≥40%为C-MYC(+)[6]。根据Hans分型法,将入组的PB-DLBCL分为生发中心B细胞型(germinal center B-cell,GCB)和非生发中心B细胞型(non-GCB)[5]。
1.2.2 EBER原位杂交
使用EBER原位杂交检测试剂盒(北京中杉金桥生物技术有限公司)检测肿瘤石蜡切片EBV的感染情况。主要步骤为切片脱蜡、水化后,室温下蛋白酶K消化切片5 min;蒸馏水洗涤后滴加杂交液,在ThermoBrite FISH杂交仪(Abbott Molecular公司,美国)中进行杂交,过夜。滴加一抗,37℃孵育30 min,PBS洗涤后加二抗,室温孵育20 min,PBS洗涤后加HRP,室温10 min,DAB显色,苏木精复染,脱水,封片。EBER原位杂交阳性信号位于细胞核。
1.2.3 FISH检测及判读
使用MYC双色分离探针(CytoTest Inc公司,美国)对肿瘤组织的3 μm石蜡切片进行FISH染色,操作步骤按照试剂盒说明书进行。主要步骤为组织学切片脱蜡后,于95℃蒸馏水中煮片20 min;室温晾干,滴加胃蛋白酶消化液,37℃消化25 min;梯度乙醇(70%、90%和无水乙醇)脱水各3 min。室温晾干切片后,避光滴加MYC双色分离探针,盖好盖玻片并注意避免产生气泡,使杂交液分布均匀。橡胶水泥封片后于ThermoBrite FISH杂交仪内进行变性、杂交过夜。切片洗涤后,滴加DAPI复染剂到杂交区,盖上盖玻片,利用BX41荧光显微镜成像系统(Olympus公司,日本)和FISH图像分析软件进行荧光图像的观察、采集和分析。按试剂盒说明书判读标准,MYC正常信号为红色和绿色荧光融合的2个黄色信号,基因易位时为1黄1红1绿信号,基因扩增时为≥3个黄色信号。每个组织样本观察200个间期细胞核,计算异常信号细胞的百分比。以5例反应性增生淋巴结标本的MYCFISH结果按如下公式计算建立本实验室阈值,阳性阈值=假阳性信号频率的平均值+3倍标准差。按照试剂盒说明书及上述方法得到本实验室的MYC探针基因易位阳性阈值为4%,MYC基因扩增阳性阈值为8%。
2 结果
2.1 病理组织学形态结果
8例病例中,行肿物局部切除活检术及乳腺单纯切除术的4例肿物,病理大体检查显示,肿物切面灰白、灰黄及灰红色,实性,质地细腻或稍硬,肿物周界不清。
光镜下见肿瘤细胞弥漫或略呈结节状浸润乳腺组织,致乳腺正常结构消失,可见残存的乳腺小叶。2例病例可见松散的肿瘤细胞围绕残余乳腺导管略呈同心圆状排列(图1A)。肿瘤细胞呈中等-大的中心母或免疫母细胞样形态,其间可见散在的小淋巴细胞(图1B)。肿瘤细胞核呈圆形、卵圆形或空泡样,1例病例的肿瘤细胞核稍不规则。核膜增厚,中心母样肿瘤细胞核染色质较细,可见多个靠近核膜的小核仁;免疫母样肿瘤细胞核染色质较粗,可见位于中心的大核仁。肿瘤细胞胞浆较少至丰富,嗜碱性。核分裂象多见,并可见病理性核分裂象。8例病例均未见坏死,3例病例伴有间质轻度纤维化。
2.2 免疫表型结果
8例病例的肿瘤细胞均弥漫强阳性表达LCA、CD20(图1C)和CD79α。5例(62.5%)BCL6阳性、7例(87.5%)MUM1阳性、3例(37.5%)BCL2阳性(图1D)、3例(37.5%)C-MYC阳性(图1E)、Ki-67阳性率为65%~95%(图1F)。肿瘤细胞均呈CD10、CD3、ALK、CD30和CK阴性。残余的乳腺导管上皮可见CK阳性。根据Hans分型,本研究8例PB-DLBCL中,non-GCB型7例(87.5%),GCB型1例(12.5%)。根据C-MYC和BCL2蛋白表达结果,1例为C-MYC和BCL2双表达淋巴瘤,Hans分型为non-GCB(表2)。
2.3 EBER原位杂交和MYC FISH结果
8例病例EBER原位杂交均为阴性,无EBV感染(图1G)。MYC基因FISH染色结果显示,>96%的细胞具有正常融合的2个黄色信号,8例病例基因易位和基因扩增均为阴性(图1H,表2)。

图1 原发性乳腺弥漫大B细胞淋巴瘤的病理学染色结果Figure 1 Pathological staining results of primary breast diffuse large B-cell lymphoma
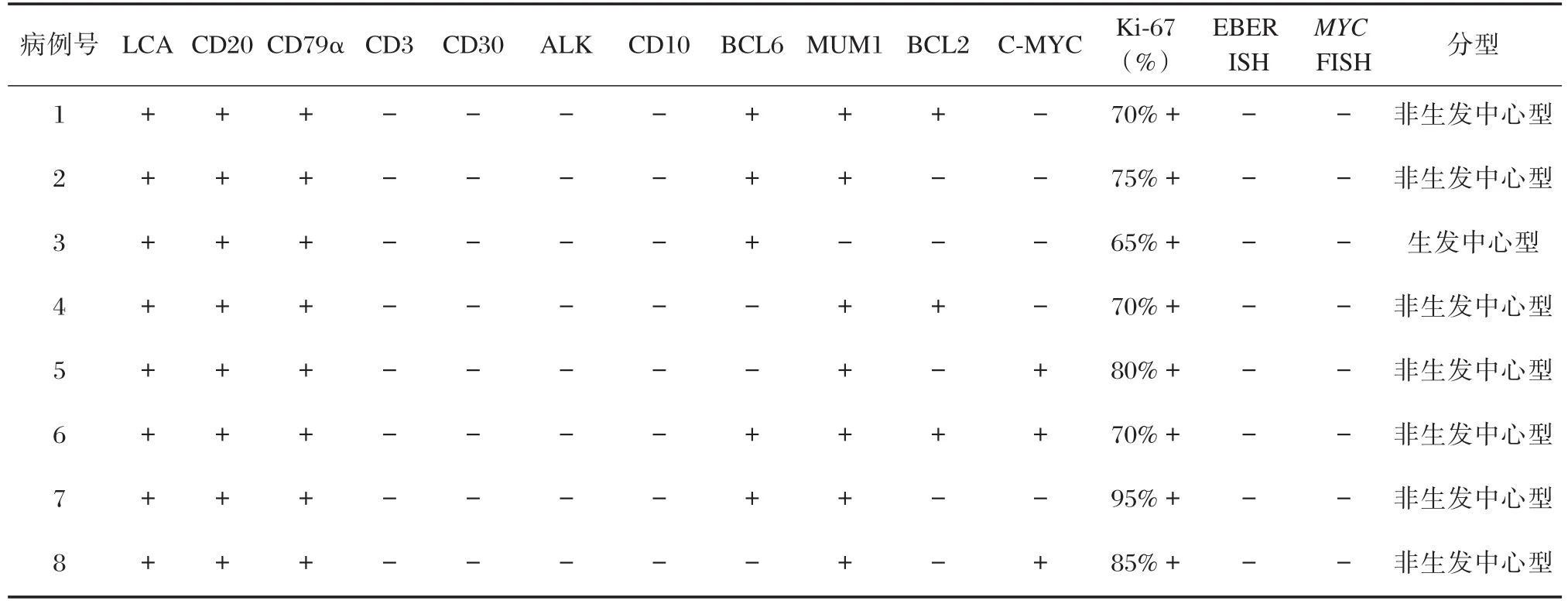
表2 8例原发性乳腺弥漫大B细胞淋巴瘤的病理学特征Table 2 Pathological features of the 8 cases of primary breast diffuse large B-cell lymphoma
3 讨论
发生在乳腺的淋巴瘤分为原发性和继发性。1972年Wiseman等[7]提出原发性乳腺淋巴瘤诊断标准如下:①有足够的组织标本进行诊断,经病理确诊为淋巴瘤;②发病时无乳腺外淋巴瘤病史;③乳腺为首发部位,除区域淋巴结(同侧腋窝和锁骨上淋巴结)可受累外,无其他部位累及;④乳腺组织与淋巴瘤组织密切相连。2008年国际结外淋巴瘤研究小组对该诊断标准更新为,单侧或双侧乳腺病变为主要临床表现,伴/不伴区域淋巴结侵犯[2]。而继发性乳腺淋巴瘤是指全身性淋巴瘤继发累及乳腺。
原发性乳腺淋巴瘤少见,Taniguchi等[8]、Ryan等[3]和周智俊等[9]的报道显示,DLBCL是原发性乳腺淋巴瘤中的最常见的类型。由于DLBCL的优化管理有时与肿瘤原发部位相关,因此,研究起源于特定结外部位的DLBCL的独特的临床生物学行为是十分必要的。正如WHO将原发中枢神经系统的DLBCL列为一个独立亚型并进行特异性的评价和治疗[2],由于PB-DLBCL原发部位的特殊性,Bierman等[10]和国际结外淋巴瘤研究小组的Ryan等[3]对PB-DLBCL是否可作为DLBCL的一个独立亚型进行了相关研究。通过该大宗病例分析,发现PB-DLBCL具有在对侧乳腺和其他结外部位复发等独特的临床病理特征[3]。因此,研究分析PB-DLBCL的临床病理特征,可促进临床病理诊治水平的进一步提高。
PB-DLBCL好发于中老年女性,大多数为单侧乳腺发病,Ryan等[3]的报道中,发病部位为右侧乳腺的占51%,左侧乳腺的占43%,双侧乳腺约占5%。本组研究中左侧的占62.5%,另有1例发病于双侧乳腺。需要注意的是,当双侧乳腺受累时,需仔细排除继发性乳腺淋巴瘤。PB-DLBCL一般表现为无痛性肿物,与皮肤无粘连,皮肤表面无橘皮样改变,乳头无凹陷和溢液,B症状少见[3,8-9]。部分病例可出现局部红肿、不适等,临床上难与乳腺炎症鉴别。既往报道和本组病例术前大多数诊断为乳腺癌或炎症[3,9,11]。Ryan等[3]的报道中约19%的患者LDH升高,本组有2例病例LDH升高,分别为258.4 U/L和261.3 U/L。根据1972年Wiseman等[7]提出的原发性乳腺淋巴瘤诊断标准,患者分期均为早期,即Ann ArborⅠE(仅表现为乳腺肿物)或ⅡE(乳腺肿物并累及区域淋巴结)。累及双侧乳腺的淋巴瘤分期仍有争议,研究发现该类病例侵袭性更强,预后更差,因此建议将其归为ⅣE期,约占5%[3]。
PB-DLBCL的确诊依靠肿物细针穿刺、肿物局部切除或乳腺切除术后的病理学检查。其组织学形态和免疫表型类似于淋巴结内原发的DLBCL。组织学形态上,乳腺原有结构被破坏,可见中-大的异型肿瘤细胞弥漫性或略呈结节状浸润,肿瘤细胞间可见残存的乳腺导管和散在的小淋巴细胞。部分病例肿瘤细胞粘附性差,呈单个散在的或单行条索状浸润于间质中或围绕乳腺导管,类似乳腺小叶癌的列兵样排列或靶环样结构。肿瘤细胞大多呈中心母或免疫母细胞样形态,核分裂象易见。肿瘤间质可有轻度的纤维化。免疫表型上,肿瘤细胞表达淋巴细胞标记物LCA和B细胞标记物(CD20和CD79α),而不表达上皮标记物CK[2,11]。本组的8例PB-DLBCL均符合上述病理诊断标准。
根据细胞起源,通过基因表达谱(gene expression profile,GEP)可以将弥漫大B细胞淋巴瘤分型为GCB和活化B细胞样(activated B-cell-like,ABC)[2]。这2种亚型在染色体突变、信号通路和临床预后等方面均存在差异,GCB亚型患者总体生存率好于ABC亚型[12]。但由于GEP尚未常规开展,因此2016年WHO淋巴组织肿瘤分类修订版推荐基于CD10、BCL6和MUM1的IHC染色的Hans分型法,作为GEP分型的有效替代[2]。既往研究报道PB-DLBCL中GCB和non-GCB的比例变化范围较大,GCB比例可从11.1%~39.3%[8-9,11,13-14]。本研究根据Hans分型[5],7例(87.5%)为non-GCB,1例(12.5%)为GCB。2种亚型的预后意义有待积累更多病例进行随访和统计学分析。此外,具有生发中心B细胞免疫表型特征的DLBCL发生于结外比如乳腺等部位的病理机制仍不明确,有待进一步阐明[11]。
近来研究表明,C-MYC作为癌基因参与了DLBCL的发生发展过程,MYC的遗传学改变已成为DLBCL预后判断的重要指标之一[2]。MYC转录因子可起基因扩增和通过调节P53凋亡通路下调肿瘤细胞增殖能力的双重作用[15]。当用FISH检测确定淋巴瘤具有MYC重排伴BCL2重排和/或BCL6重排时,即为“双打击”或“三打击”淋巴瘤。2016年WHO分类已将其定义为“高级别B细胞淋巴瘤,伴MYC和BCL2和(或)BCL6重排”,预后较差[2]。如果淋巴瘤免疫表型呈C-MYC(>40%)和BCL2(>50%)阳性而基因重排阴性时,可归为“双表达”淋巴瘤,预后也不良,但稍好于“双打击”或“三打击”淋巴瘤[2,16-17]。因此在DLBCL中检测MYC的遗传学改变对指导临床治疗和预后评估具有重要意义。然而,我们注意到,尽管7%~21%的DLBCL可发生MYC基因重排[15],在Taniguchi等[8]及本研究的报道中,PB-DLBCL均呈MYC基因重排FISH检测阴性,同时少数病例可呈C-MYC免疫表型阳性。目前,由于病例数有限,仍需累积病例进一步分析MYC基因在PB-DLBCL中的重排情况及与预后的关系。
综上,PB-DLBCL是原发于乳腺的少见的淋巴瘤,临床表现难与乳腺癌、乳腺炎症区别。其确诊需依赖病理组织学和免疫表型分析。组织学上,PB-DLBCL肿瘤细胞多表现为中等-大的中心母或免疫母细胞样形态,免疫表型分型大部分为non-GCB。目前研究尚未见PB-DLBCL中MYC基因重排阳性报道。PB-DLBCL的遗传性特征仍需积累病例进一步分析,特别是MYC基因重排在PB-DLBCL中的发生比例和意义。