多房棘球蚴蛋白TSP3的原核表达及分离纯化#
2018-09-26刁晓艳李润乐李子安杨全余
刁晓艳,周 虎,李润乐,彭 海,李子安,汤 锋*,杨全余**
( 1.青海省人民医院,青海 西宁 810007;2.青海大学附属医院,青海 西宁 810001;3.青海大学高原医学研究中心,青海 西宁 810001)
泡型包虫病(Alveolar echinococcus)是一种多房棘球蚴感染引发的,危害极大的寄生虫病,手术和药物治疗为主要干预手段,但手术治疗存在创伤大、术后易复发的弊端,而药物治疗存在品种相对单一、治疗效果不理想的缺点[1]。疫苗具有针对性强,疗效确切,已经成为防治疾病的重要手段。但研制疫苗需要寻找出有效而稳定的抗原。
OkuY等人研究发现TSP3是在多房棘球蚴感染过程中产生的免疫原性最好的虫体蛋白[2-3]。本研究也是基于前人研究的基础上,利用分子生物学信息与基因重组技术,获得TSP3基因信息,构建TSP3表达的质粒载体,借助大肠杆菌的表达获得目的蛋白TSP3。
1 材料与方法
1.1 材料
TOP10 菌株及质粒pCzn1从南京钟鼎生物技术有限公司购置;限制性内切酶由TaKaRa公司提供;Ni-IDA-Sepharose CL-6B亲和层析柱由BIO-RAD公司提供;His抗体、羊抗兔抗体由ThermoFisher公司提供;DNA胶纯化试剂盒、质粒小提试剂盒由AXYGEN公司提供。
1.2 方法
1.2.1 TSP3的序列获得
在GenBank程序中检索TSP3的核苷酸序列及氨基酸序列显示,TSP3含有碱基267 bp。对TSP3进行基因合成(南京钟鼎生物技术有限公司)。如下所示,划线部位即为TSP3基因序列。
GTGCACATTCCTTTAACGCTTCAAAATCTGTAA
AGCACGCCATATCGCCGAAAGGCACACTTAATTATT
AAGAGGTAATACACCATGAATCACAAAGTGCATCAT
CATCATCATCATATGCATGAATTCGTTGGTTTAGTTG
GTAAAGAAATGCAACGTGAAATTAAAGATCTGACCG
CACACGGCCGTAACGCAAGCGATCCCTTATTAAAAA
GCATTTACAAACTGCAAGAGGAACTTGAATGTTGTG
GGGGTGTGGGTCCGACAGACTGGAGCAAACCGTACC
CGGCCAGCTGTTGTAAATCAGGCAAAGAAAATTGTA
CGCAGCCGTATCAGCAGGGATGTGCAGTGGCAATGT
ATGAGCAGATTAAAGATAGCAGCCTGTAACTCGAGG
GATCCGAATTCAAGCTTGTCGACCTGCAGTCTAGAT
AGGTAATCTCTGCTTAAAAGCACAGAATCTAAGATC
CCTGCCATTTGGCGGGGATTTTTTTATTTGTTTTCAGG
AAATAAATAATCGATCGCGTAATAAAATCTATTATT
ATTTTTGTGAAGAATAAATTTGGGTGCAATGAGAAT
GCGCAGGCCCTTTCGTCTCGCGCGTTTCGGTGATGAC
GGTGAAAACCTCTGACACATGCAGCTCCCGGAGACG
GTCACAGCTTGTCTGTAAGCGGATGCCGGGAGCAGA
CAAGCCCGTCAGGGCGCGTCAGCGGGTGTTGGCGGG
TGTCGGG
1.2.2 重组质粒pCzn1-TSP3的测序
采用基于PAS(PCR-based Accurate Synthesis)的方法,设计全长拼接引物,将重组质粒pCzn1-TSP3转入感受态的TOP10中,挑取阳性单菌落测序(南京钟鼎生物技术有限公司),测序结果与预期序列进行比对,可见测序结果部分与预期序列完全一致。截取部分比对序列示意(图1)。

图1部分序列比对结果图
Figure1Partialsequencealignmentresultsmap
2 质粒酶切鉴定
2.1 酶切体系

质粒3 μLNdeI0.25 μLXhoI0.25 μL10×Buffer1.0 μL DDWUp to 10 μL
pCzn1-TSP3经酶切后,再经1%琼脂糖凝胶电泳对酶切结果进行分析。
2.2 酶切鉴定结果(图2)
经琼脂糖凝胶电泳分析,在200 bp大小附近有浓聚的条带,即与目的基因TSP3 267 bp的大小相吻合,见酶切鉴定结果(图2)。

M:Marker;1:酶切前质粒pCzn1-TSP3;2: 酶切后质粒pCzn1-TSP3
图2pCzn1-TSP3的酶切鉴定图
Figure2IdentificationofplasmidspCzn1-TSP3byrestrictionendonucleaseanalysis
2.3 载体构建示意图
构建的重组基因是基于pCzn1质粒载体之上的基因序列,可以看出pCzn1质粒本身具有Amp抗性(图3),这也为实验的下一步开展奠定了基础。
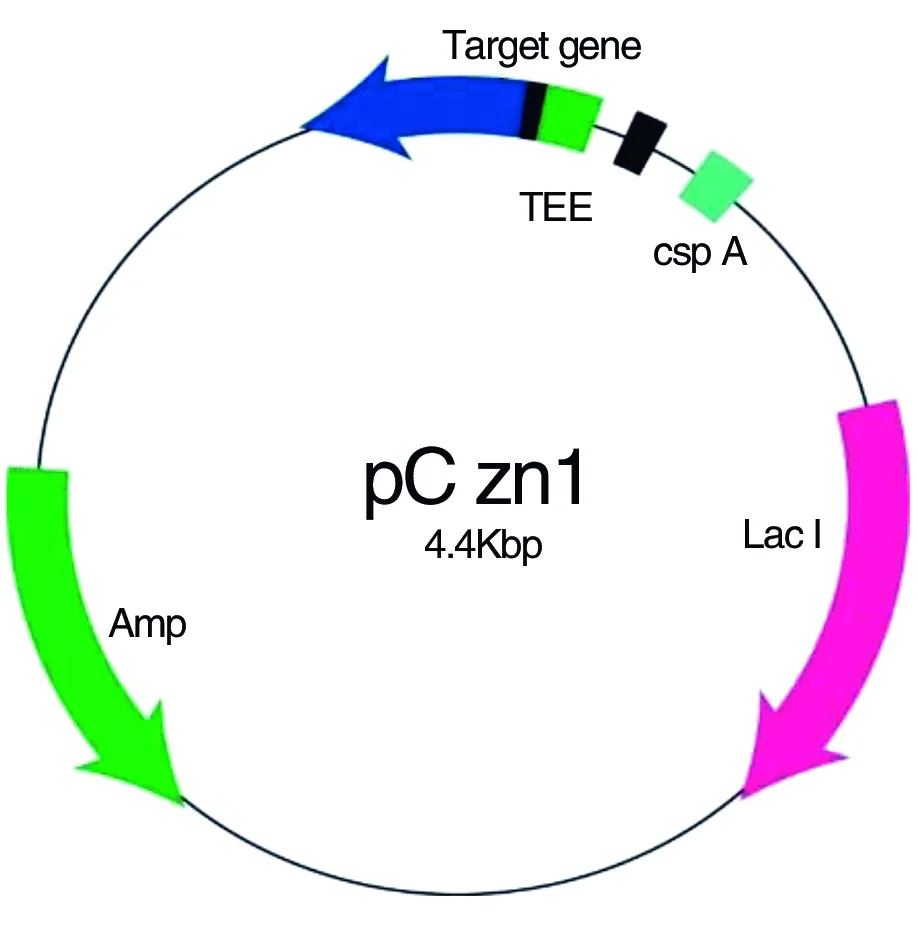
图3pCzn1-TSP3质粒载体构建示意图
Figure3ThestructureofplasmidpCzn1-TSP3
3 蛋白原核表达
3.1 TSP3的氨基酸信息
TSP3理论分子量为11.29 KD左右(含His-tag),氨基酸序列如下:
MNHKVHHHHHHMHEFVGLVGKEMQREIKDLT
AHGRNASDPLLKSIYKLQEELECCGGVGPTDWSKPYP
ASCCKSGKENCTQPYQQGCAVAMYEQIKDSSL。
3.2 pCZN1-TSP3转化及表达的过程
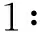
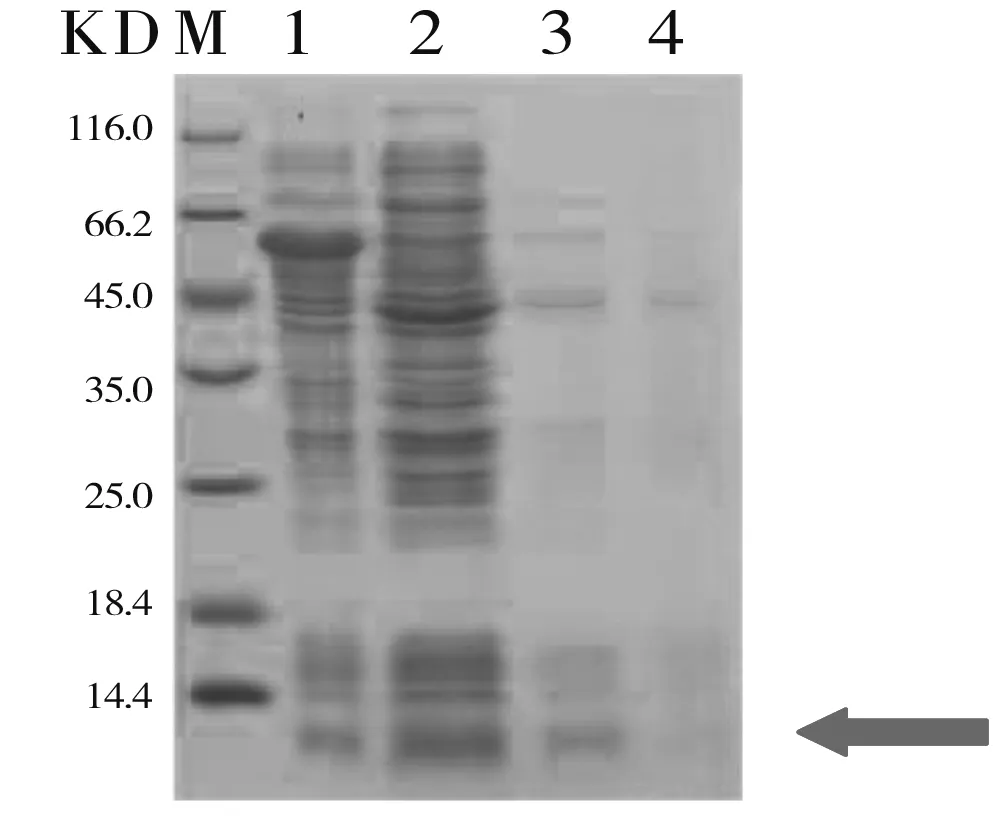
M:Maker;1:未经IPTG诱导的菌体蛋白;2:经IPTG诱导后的菌体蛋白;3:诱导破碎后的上清液;4:诱导破碎后的沉淀
图4蛋白原核表达部位的SDS-PAGE鉴定效果图
Figure4Expression,localizationandidentificationofproteinsTSP3bySDS-PAGE
3.3 TSP3蛋白的纯化步骤
离心法收集诱导表达后的细菌。将得到的细菌用PBS混悬离心,重复3次,以减少细菌中的培养上清液成分。后用PBS混悬细菌并在冰上行细胞破碎处理(20min),离心(12000r/min,20min)后分别取上清液和沉淀,经SDS-PAGE电泳明确目的蛋白TSP3表达的部位。
明确TSP3表达部位后,纯化蛋白的主要步骤如下:蛋白溶液加入到经Binding-Buffer预平衡的Ni-IDA-Sepharose CL-6B亲和层析柱中;以Binding-Buffer流速冲洗(0.5mL/min),至流出液OD280值达到基线;用Washing-Buffer(20mM Tris-HCl,20mM咪唑,0.15M NaCl,pH8.0)冲洗(流速1mL/min),待OD280值达到基线;后经Elution-Buffer(20mM Tris-HCl,250mM咪唑,0.15M NaCl,pH8.0)洗脱(流速1mL/min),收集流出液即目的蛋白。将收集溶液加入透析袋中,在含有20 mm Tris-HCl、0.5 M NaCl的溶液中(pH8.0)进行透析(12h)后,将溶液离心(12000r /min,20min)并收集上清液。用聚乙二醇20000(PEG20000)浓缩离心上清液。并进行12% SDS-PAGE电泳分析(图5)。
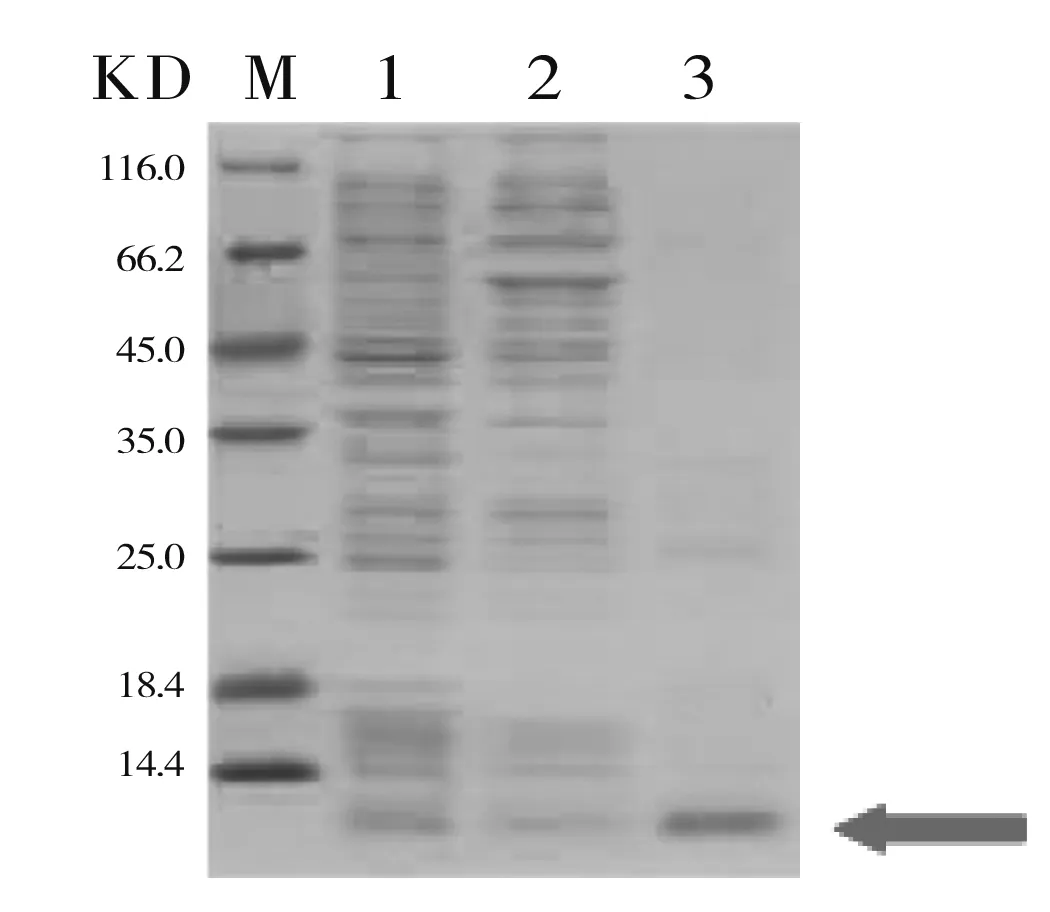
M:Maker;1:破碎后的全菌蛋白;2:流出液;3:洗脱液
图5目的蛋目TSP3的SDS-PAGE分析效果图
Figure5PurityidentificationofproteinsTSP3bySDS-PAGE
3.4 TSP3的纯化结果
本研究中,目的蛋白TSP3可以在大肠杆菌DE3中进行表达,且以可溶性蛋白的形式存在该原核表达系统中。后对纯化的目的蛋白TSP3行SDS-PAGE电泳,可见在11.29 KD处有一明显增粗的条带,其大小和TSP3理论值基本相符。本实验亦可证实,利用原核表达载体(大肠杆菌DE3)表达的TSP3经纯化后可达到电泳纯级别。
4 目的蛋白鉴定
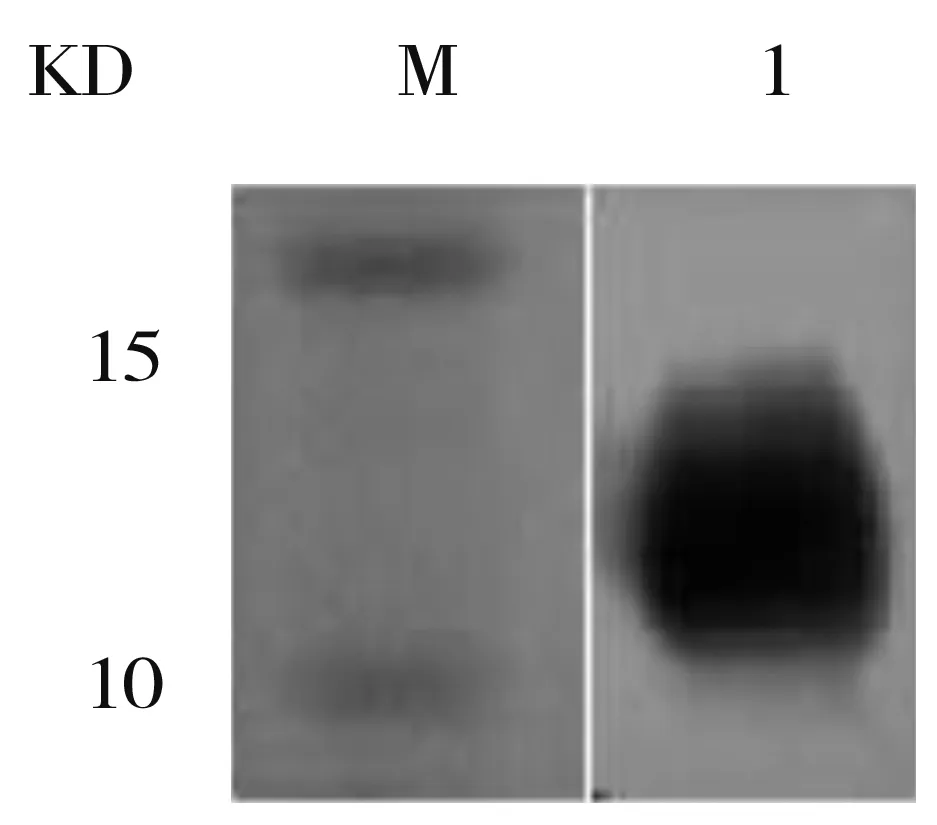
M:Maker;1:纯化后样品
图6蛋白WesternBlot鉴定分析图
Figure6WesternBlotanalysisoffusionproteinpurification
5 讨论
大肠杆菌作为经典的原核表达系统的代表,有着遗传背景明了、培养程序简单、目标蛋白转化效率高、工程菌生长繁殖快、易量产且成本低廉的优点[4-7]。生长激素是第一个被大肠杆菌作为工程菌表达出的目的蛋白[8],也标志着原核表达技术的成熟。因此,本课题选择大肠杆菌作为目的蛋白TSP3的原核表达工具,以实现TSP3蛋白的成功及高效表达。
目的蛋白在原核表达系统的工程菌中表达,由于工程菌种不同及培养的条件(温度、OD600值、IPTG浓度等)不同,其表达目的蛋白的部位也有差异,可分为三种形式,即胞外分泌表达、周质表达、胞质表达。其中周质表达即可溶性表达,其目的蛋白主要表达于周浆间隙中,其活性有无及大小主要受蛋白结构、工程菌培养条件等影响[9-11]。由于具有获取目的蛋白便捷,免除变性及复性等步骤的优点,目前有许多研究是以促进周质蛋白的表达获取目的蛋白[12-13]。包涵体蛋白相对于其他两种形式蛋白具有产量大的优点,但由于需要对目的蛋白进行变性后复性的处理,其操作过程相对复杂,但此技术也在不断改良,便于蛋白回收[14-15]。本实验中,经上述培养及诱导条件下表达出的目的蛋白TSP3主要以周质蛋白的形式予以表达,利于蛋白的分离及纯化。
不同蛋白的物理性及化学性存在差异,主要表现在蛋白大小、溶解度、疏水性和生物学活性等方面,可以据此将不同蛋白加以分离纯化[16-17]。本实验中,分离后的菌体蛋白经Ni-IDA-Sepharose CL-6B亲和层析柱进行纯化处理,也是利用了不同蛋白存在差异性的特点。
本研究在获取多房棘球蚴抗原TSP3基因序列的基础上,进行氨基酸序列的合成,经与质粒载体进行重组,构建适合原核表达的质粒载体,并经酶切、测序方法予以证实(重组成功)。后经蛋白表达、表达部位鉴定、纯化等方法,证实以pCzn1为载体的TSP3能在原核表达载体大肠杆菌DE3中表达,实验亦证实目的蛋白在原核表达系统中以周质蛋白的形式表达,且可获得电泳纯蛋白,用于TSP3蛋白生物学活性及免疫学的后续相关研究。
