重症患者纤维蛋白原缺乏症的现代诊疗观点
2018-09-25宋景春
宋景春
0 引 言
纤维蛋白原是纤维蛋白的可溶性前体,是人血液中含量最丰富的凝血因子,也是参与血块凝固、血小板聚集和纤溶活动的关键因子[1]。人纤维蛋白原是由人4号染色体上的基因簇FGB, FGA和FGG编码,在肝相应形成的三条同源性多肽链Bβ, Aα和γ[2]。单链先装配成Bβ-γ和Aα-γ,再装配成Aα-Bβ-γ,最后每两个多肽链的拷贝Aα-Bβ-γ通过二硫键形成340 kD的六聚体(AαBβγ)2[3],见图1。组装好的纤维蛋白原分子由两个外部D结构域和中央的E结构域构成,见图2。正常血浆的纤维蛋白原水平在2~4.5 g/L之间。纤维蛋白原的消除半衰期约为80 h。凝血过程中,凝血酶依次使Aα裂解出纤维蛋白肽A、Bβ裂解出纤维蛋白肽B,最终形成可溶性纤维蛋白单体(soluble fibrin monomer,sFM)。在凝血酶的作用下,ⅩⅢ因子活化生成ⅩⅢa,并通过共价键与sFM结合,促使sFM形成稳定的纤维蛋白多聚体,完成止血功能[4]。纤维蛋白原还能以原型形式与多个血小板膜的糖蛋白Ⅱb/Ⅲa受体结合促进血小板聚集。除此之外,纤维蛋白原和纤维蛋白还在多种生理过程中发挥重要作用,如纤溶、伤口修复、炎症、感染、细胞迁移与相互作用、血管新生、肿瘤生长与转移等[5-6]。

图1肝细胞内的纤维蛋白原合成
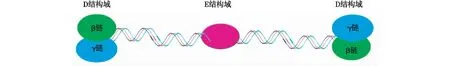
图2 纤维蛋白原的分子结构
1 纤维蛋白原缺乏症的分型
作为急性反应时相蛋白,纤维蛋白原在危重症患者中易出现水平增高或下降的变化。纤维蛋白原的缺乏可能是由遗传性因素或获得性因素引起。
遗传性纤维蛋白原缺乏一般指由纤维蛋白原基因缺陷造成的遗传性出血性疾病[7]。遗传性纤维蛋白原缺乏可表现为数量减少或质量下降。数量减少可表现为血浆中纤维蛋白原浓度明显减少甚至缺如,其中纤维蛋白原完全缺乏可称为无纤维蛋白原血症,纤维蛋白原水平低于1.5 g/L可称为低纤维蛋白原血症[8]。遗传性无纤维蛋白原血症患者主要表现为出血,据统计85%的患者可出现脐带出血,72%的患者可出现肌肉血肿、鼻衄、月经量多、牙龈出血,54%的患者可出现关节出血,还有10%的患者可出现中枢神经系统出血。遗传性低纤维蛋白原血症的患者通常没有症状,但在遭遇创伤时可表现出明显的出血倾向[9]。质量下降可表现为纤维蛋白原水平正常但是功能异常,一般称之为异常纤维蛋白原血症。遗传性异常纤维蛋白原血症患者一般无临床表现,约25%的患者可表现为出血,但约20%的患者可在青年时期即表现为血栓事件,如下肢深静脉血栓、血栓性静脉炎甚至肺栓塞[10]。异常纤维蛋白原血症的患者之所以出现血栓或出血的症状,是因为基因突变导致纤维蛋白原结构改变,使纤维蛋白原与凝血酶、凝血抑制因子和其他纤维蛋白原分子的结合力下降所致。
获得性纤维蛋白原缺乏也可分为获得性低纤维蛋白原血症和获得性异常纤维蛋白原血症。获得性低纤维蛋白原血症可见于创伤或手术大出血、血液稀释、脓毒症、肝疾病、肿瘤和溶栓术后,获得性异常纤维蛋白原血症则见于蛇咬伤、急性白血病、自身免疫疾病、肝疾病异常唾液酸化和药物作用等。获得性纤维蛋白原缺乏的具体发病机制通常由凝血因子生成减少、直接丢失、消耗增加或血液稀释引起,见表1。获得性纤维蛋白原缺乏的临床表现主要是难以控制的出血。目前文献报道尚缺乏危重患者低纤维蛋白原血症的流行病学资料,我科对2016-2017年本院重症医学科收治的744例重症患者的调查显示,低纤维蛋白血症的发病率为32.0%,纤维蛋白原正常的患者为43.2%。
表1获得性纤维蛋白原缺乏的分型

类型病因常见疾病临床表现获得性低纤维蛋白原血症合成减少肝疾病不同程度的出血消耗增加溶栓药物/脓毒症性DIC/肿瘤血栓前状态/出血/无症状血液稀释大出血不同程度的出血获得性纤维蛋白原异常血症检测干扰使用抗凝药物无症状或出血翻译后修饰肝疾病唾液酸化血栓前状态/大出血自身抗体形成单克隆免疫球蛋白病/骨髓瘤/自身免疫性疾病/药物影响无症状/出血血栓前状态(常见于系统性红斑狼疮)类肿瘤组织生成异常结构纤维蛋白原宫颈内皮细胞/肝癌细胞血栓/出血
2 低纤维蛋白原血症的诊断
传统凝血检测方法主要依靠凝血酶原时间(prothrombin time,PT)、部分活化凝血酶原时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、爬虫酶时间(reptilase time,RT)和纤维蛋白原测定来诊断纤维蛋白原血症[11]。爬虫酶是一种蛇毒酶,能使F纤维蛋白肽A从纤维蛋白原中裂解,而不影响纤维蛋白原B。RT是在枸橼酸抗凝浓度血浆中加入爬虫酶后检测纤维蛋白凝块的形成率。纤维蛋白原测定方法按照原理主要有功能检测法和抗原检测法两种。功能检测的原理主要是在患者血浆中加入凝血酶,促进血浆中的纤维蛋白原活化行成纤维蛋白,再通过血浆的光密度来反映纤维蛋白原的水平。现在临床上依据此原理的纤维蛋白原测定方法主要有Clauss法和PT衍生法。Clauss法结果异常提示纤维蛋白形成减少,但不能说明是因为患者血浆中的纤维蛋白原浓度低还是因为纤维蛋白原功能异常,所以又有了纤维蛋白原抗原检测。纤维蛋白原抗原检测是以纤维蛋白原作为抗原来直接检测纤维蛋白原的含量,主要方法是酶联免疫法(enzyme-linked immunosorbent assay, ELISA)、放射免疫法、沉淀法和凝血酶凝块法,其中ELISA法最常用。
无纤维蛋白原血症表现为PT、APTT、TT和爬虫酶时间RT均无限延长,纤维蛋白原测定无论是功能性Clauss法还是ELISA法均无法测出;低纤维蛋白原血症的PT、APTT、TT和RT可表现为一定程度的延长或不延长,纤维蛋白原的功能性测定与免疫抗原法测定成一定比例的减少,通常>0.7;异常纤维蛋白原血症的PT、APTT、TT和RT可无限延长、部分延长或不延长,功能性测定纤维蛋白原水平较低,抗原法检测水平正常或增高,导致纤维蛋白原的功能性测定与免疫抗原法测定比例降低,通常为0.5[12],见表2。
表2低纤维蛋白原血症的诊断

检验项目无纤维蛋白原血症低纤维蛋白原血症异常纤维蛋白原血症PT无限延长延长延长、无限延长或不延长APTT无限延长延长延长、无限延长或不延长TT无限延长延长延长、无限延长或不延长RT无限延长延长延长、无限延长或不延长Fib比值/ (ELISA)无法测出下降至0.7左右下降至0.5以下
全血功能检测设备用于纤维蛋白原功能监测也日益显现出较大的临床价值[13-15]。目前主流的全血功能监测设备有血栓弹力图仪(thromboelastography,TEG)、凝血和血小板功能分析仪(Sienco)和旋转式血栓弹力装置。TEG曲线是由置于血标本检测杯中的金属探针受到血块形成的切应力作用,在旋动过程中切割磁力线再经软件处理后形成的。TEG可用于纤维蛋白原功能评价的指标为K和α角。K是从R时终点到描记幅度达到20 mm所需的时间。K时间反映血凝块形成的速率,代表纤维蛋白聚合并与血小板交互反应形成血块的过程,正常值为1~4 min。α角是从血凝块形成点到描记图最大的曲线弧度处作切线与水平线的夹角,正常范围为47°~74°,α角度与K时间均可反应纤维蛋白原功能。
TEG还有专门的功能性纤维蛋白原杯。功能性纤维蛋白原杯的原理是通过组织因子激活外源性凝血通路,并使用血小板抑制剂抑制 GPⅡb/Ⅲa受体,阻止血小板聚集。在凝血块形成过程中,纤维蛋白原试剂盒抑制了血液中所有的血小板,因此检测的血块强度仅包含纤维蛋白原的贡献。功能性纤维蛋白原杯得到三个主要指标R时间、FFMA和FLEV。R时间是凝血蛋白反应时间,表明外源性凝血通路的各凝血因子的活性及使用抗凝剂的效果,正常值为1.3~2.5 min。FFMA值即最大振幅,直接反应纤维蛋白网的交联强度,代表纤维蛋白原在凝血过程中的贡献,正常值范围是10.1~25.3 mm。FLEV值为纤维蛋白原活性功能,由最大振幅MA值通过公式计算,反应血液中纤维蛋白原的含量,正常值是184.3~461.7 mg/dL。如图3所示,1例90岁老年女性患者急性脑梗死患者应用阿替普酶溶栓后,普通杯显示K时间延长,α角减小;功能性纤维蛋白原杯显示FFMA仅有2.5 mm,FLEV为96.6 mg/dL,两者均提示溶栓后纤维蛋白原功能显著下降。
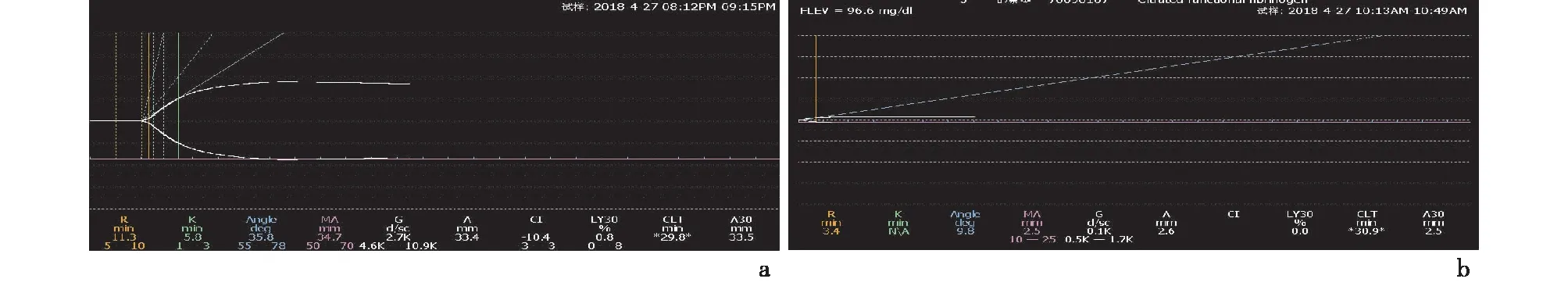
a:普通杯;b: 功能性纤维蛋白原杯图3 急性脑梗死阿替普酶溶栓术后的血栓弹力图结果
3 重症纤维蛋白原缺乏症的处理
危重患者纤维蛋白原缺乏症的处理应首先评估出血风险,并明确纤维蛋白原缺乏的具体原因。如果已出现出血,应根据出血的时间、部位和严重程度确定治疗方案。对于大出血或血液稀释导致的获得性低纤维蛋白原血症,如果患者未进入高纤溶状态并有出血或血液稀释造成的临床症状,首选措施均为紧急终止急性损害。如果已经形成出血,血容量丢失1~1.5倍时,纤维蛋白原水平会出现下降。如果要保持微血管不出血,纤维蛋白原水平至少要在1 g/dL以上[16]。如果患者是孕妇,纤维蛋白原水平至少要在2 g/dL以上。此时替代治疗是纤维蛋白原缺乏最重要的治疗手段,新鲜冰冻血浆(fresh frozen plasma,FFP)、冷沉淀(cryoprecipitate)和纤维蛋白原浓缩物(brinogen concentrates)均是替代治疗的选择[17]。
FFP含有几乎全部的凝血因子及血浆蛋白,其浓度和活性与采集后6~8 h内的全血相似。以200 mL规格的FFP为例,其中血浆蛋白浓度为60~80 g/L,纤维蛋白原浓度为2~4 g/L,其他凝血因子浓度为0.7~1.0 IU/mL。输注FFP的剂量一般为10~20 mL/kg体重时,多数凝血因子浓度能够上升25%~50%。
冷沉淀主要成分有因子Ⅷ、vWF、纤维蛋白原、纤维结合蛋白和因子ⅩⅢ。1个单位冷沉淀含有因子Ⅷ≥40 IU,含纤维蛋白原≥75 mg,含有的vWF约等于100 mL血浆中的含量。冷沉淀的常规剂量为2~3 U/10 kg体重,可提高患者血液中纤维蛋白原浓度为0.5~1.0 g/L。当大量输血时,纤维蛋白原被稀释至低于1.0 g/L,可输冷沉淀20 U,输注后需要对患者凝血状态进行评估,帮助决定后续的使用剂量。而对于纤维蛋白原缺乏的成人患者,剂量一般为16 U/次,每3天输注1次,每天检测纤维蛋白原浓度,使纤维蛋白原维持在1.0 g/L。
纤维蛋白原浓缩剂可分为血浆来源和基因重组来源两种。血浆来源的每瓶纤维蛋白原浓缩剂含有混合血浆来源的人纤维蛋白原900~1000 mg,人白蛋白400~700 mg,盐酸L-精氨酸375~660 mg,氯化钠200~350 mg,枸橼酸钠50~100 mg。当每千克体重用1 mg的纤维蛋白原浓缩剂时,纤维蛋白原缺乏患者的血浆中纤维蛋白原水平平均升高15 mg/L左右。输注后,纤维蛋白原与内源性纤维蛋白原一样被消除和降解。在先天性纤维蛋白原缺乏患者中,纤维蛋白原浓缩剂的平均血浆半衰期是2.7 d,重症患者可能存在纤维蛋白原的持续丢失和消耗,需要进行滴定式治疗。普通患者的常用初始剂量为30~60 mg/kg,严重出血的患者可依据公式计算剂量:
剂量(g)=0.07×需增加的纤维蛋白原浓度(g/L)×(l-血细胞比容)×体重(kg)
抗纤溶治疗可单独使用或与替代疗法联合治疗纤维蛋白原缺乏症,推荐剂量为氨甲环酸每6~8 h/次,使用剂量为25 mg/kg。纤维蛋白胶可能有助于局部止血。部分纤维蛋白原异常血症患者临床上表现为血栓或血栓前状态,需要进行抗凝治疗,建议在全血功能监测指导下进行抗凝治疗,以降低出血风险。药物选择建议使用出血风险小的低分子肝素,并使用抗Xa因子活性监测低分子肝素剂量。
4 结 语
重症患者发生纤维蛋白原缺乏症的比率并不低,但目前对纤维蛋白原缺乏症的认识还普遍不足,主要表现在国内外都缺乏重症患者低纤维蛋白原血症的流行病学调查数据,针对低纤维蛋白原血症的治疗也仅停留在对症补充的层面,缺乏对重症患者获得性低纤维蛋白原血症的机制和预防的深入研究,这留给我们很大的研究空间。今后,深入探讨部分纤维蛋白原缺乏症以血栓为主要表现的具体机制、应用全血功能监测设备等诊断纤维蛋白原缺乏症的具体标准,明确采用纤维蛋白原浓缩物治疗纤维蛋白原缺乏症的具体时机等都将是值得我们继续深入研究的方向。
