急性A型主动脉夹层术后重度急性肾损伤危险因素分析
2018-09-22曹亮王嵘金沐董秀华程卫平卢家凯
曹亮 王嵘 金沐 董秀华 程卫平 卢家凯
急性肾损伤(acute kidney injury,AKI)是急性Stanford A型主动脉夹层(acute Stanford type A aortic dissection,AAAD)手术后严重并发症之一,发生率20% ~67%[1-7],影响患者短期以及长期病死率[8]。术后AKI以轻度至中度较为常见,但其中高达8%的患者需行肾脏替代治疗(RRT)[9-11],而这类患者短期病死率高达64%[9-10,12]。 AKI患者的病死率与其分期密切相关,AKI3期患者的长期生存率显著降低[6]。术后发生重度AKI往往伴随灾难性预后,因此需格外重视。
近些年,很少研究报道术后发生重度AKI的危险因素。因此,本回顾性研究旨在探讨AAAD术后发生重度AKI的围术期独立危险因素,为预测重度AKI的发生以及提前干预治疗提供部分指导。
资料与方法
1.入选及排除标准 入选首都医科大学附属北京安贞医院心脏外科,2013年1月至2015年12月期间,确诊为AAAD并接受急诊手术治疗患者227例。入选标准:根据2010年ACC/AHA联合发布的胸主动脉疾病(TAD)诊断和治疗指南(Circulation,2010),发病到手术时间<14d,由CTA确诊为Stanford A型主动脉夹层患者。排除标准:①术前已有肾功能受损,②术前需要血液透析的患者,③术前已使用ECMO的患者,④围术期肌酐值缺失以及相关临床资料不完整的病例。如果患者在接受AAAD急诊手术修复后还接受了其他手术,评估第一次AAAD手术的数据(图1)。
2.AKI诊断标准 是根据2015年KDIGO制定的标准和分类(表1),AKI的定义是出现以下情况的任意一种:48h内 Scr升高≥26.5μmol/L;或已知或认定在过去7d内Scr升高≥基线值的1.5倍;或6h内尿量<0.5mL.min-1.kg-1。本研究将患者入院时血肌酐浓度作为基线值,术后7d内肌酐峰值为肌酐升高值,进行AKI分期。

图1 入排流程图
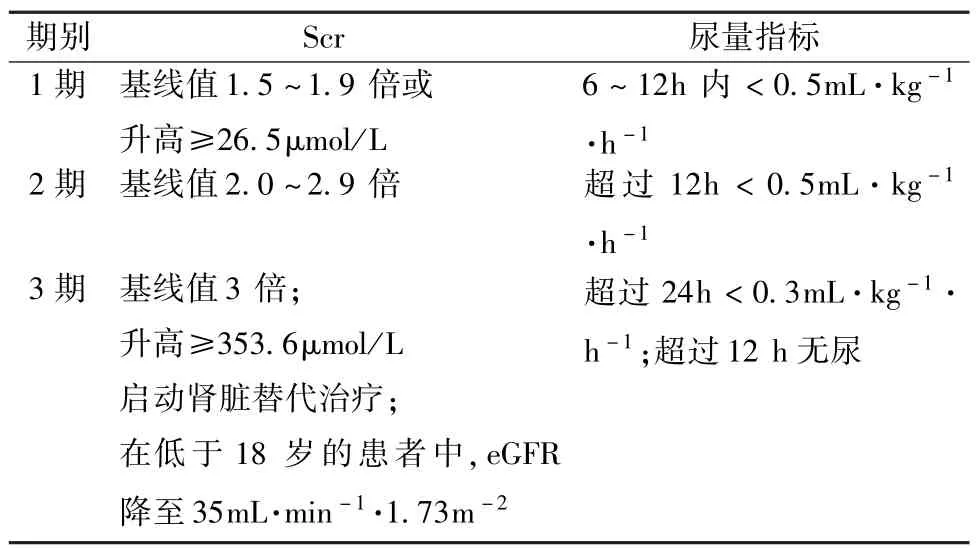
表1 KDIGO制定的急性肾损伤分期标准
3.统计学方法 数据分析采用SPSS 23.0统计软件进行。正态分布计量资料以均数±标准差表示,组间比较采用t检验;非正态分布的计量资料以中位数(四分位间距)表示;计数资料以例数(构成比)表示,组间比较采用非参数检验。将单因素分析中P<0.05的变量纳入多因素Logistic回归模型分析术后重度AKI的危险因素。采用ROC曲线下面积评价AAAD术后重度AKI模型的预测能力。以P<0.05为差异有统计学意义。
结 果
1.一般临床资料 纳入研究的227例患者平均年龄为47岁(14~73岁),其中52例(22.9%)为女性患者。术后7d内,共128例患者发生了AKI。根据KDIGO标准,AKI 1期67例(29.5%),AKI 2期20例(8.8%),AKI 3期41例(18.1%)。 其中16例(7%)需要进行肾脏替代治疗。
2.AAAD术后7d Scr动态变化趋势(图2)非重度AKI组虽然术前Scr升高,但经过积极保守治疗,Scr在术后第7d恢复到低于基线1.5倍水平,而重度AKI患者肌酐术后第7d仍维持在高危水平。
3.术后短期结局 ①ICU停留时间:重度AKI组ICU停留时间显著延长[(186.4±211.9)vs.(67.4±83.9)h,P=0.001];②院内病死率:重度AKI组中术后死亡7例(17.1%),非重度AKI组术后死亡6例(3.2%,P=0.028)。③术后并发症发生率重度AKI组明显高于非重度AKI组,包括:呼吸系统并发症(39.0%vs.零,P<0.001)、神经系统并发症(14.6%vs.3.8%,P<0.001)、消化系统并发症(6.8%vs.7.0%,P=0.007)、截瘫(12.2%vs.3.2%,P=0.016)。
4.单因素Logistic危险因素分析 显示性别、术前NEUT%、术前CRP、术前TNI、术前 FDP、手术时间、CPB时间、阻断时间、术中血浆输注、术中尿量、术中是否行冠状动脉旁路移植术、术后延迟拔管、术后红细胞输注、术后TNI、术后LVEF,差异有统计学意义(P<0.05,表2~4)。
5.重度AKI的多元Logistic回归分析结果术前NEUT%,术前TNI,CPB时间,术后延迟拔管和女性,是AAAD术后发生重度AKI的危险因素,而术后 LVEF为保护性因素(表5)。发生重度AKI的ROC曲线下面积为0.856,95%CI:0.786~0.925。
讨 论

图2 AAAD围术期血清肌酐动态变化曲线
急性主动脉夹层(AAAD)是心血管外科的急危重症之一,手术效果与多科室合作质量密切相关。尽管外科手术技术和理念不断更新,但AAAD患者手术病死率以与及术后并发症发生率仍居高不下[13],并且AKI的进展被认为是患者死亡的危险因素[8],与未发生 AKI患者比较,AKI 1 期、2 期、3 期患者长期生存率危险比分别为 1.38、1.82、3.79[6]。此外,术后ICU停留时间和医疗花费与AKI分期密切相关[14]。针对AKI目前缺乏特异性治疗,仍以对症支持治疗和肾脏替代治疗为主。许多研究表明,AKI早期即开始RRT治疗,肾功能大多可逆,从而改善预后[15-17]。因此,重度AKI的早期预测和提前干预具有重要临床价值。
表2 两组既往病史及术前临床资料比较[±s,n(%),M(QR)]

表2 两组既往病史及术前临床资料比较[±s,n(%),M(QR)]
项目 总计(n=227) 非重度AKI组(n=186) 重度AKI组(n=41) P值年龄/岁 47.3±10.6 47.0±11.8 50.0±11.0 0.114女性 52(22.9) 36(19.4) 16(39.0) 0.007 BMI/(kg/m2) 25.9 ±3.7 25.8 ±3.5 25.8 ±4.2 0.999发病到手术时间/d 2.0(1.0,4.0) 2.0(1.0,5.0) 1.0(1.0,3.0) 0.132术前LVEF/% 61.5±10.4 61.0±11.0 62.1±7.3 0.618术前LVDD/mm 50.1±10.4 50.4±11.0 50.3±7.1 0.887术前EuroSCORE评分 4.9±1.0 5.0±1.0 5.0±1.0 0.303胸腔积液 13(5.7) 11(6.1) 2(4.9) 0.797心包积液 155(68.3) 130(69.9) 25(61.0) 0.268术前生命体征心率/(次/分) 81.5±16.9 81.8±17.2 79.9±15.2 0.507术前上肢 SBP/(mmHg) 124.0±28.9 123.7±29.7 125.0±24.7 0.805术前上肢 DBP/(mmHg) 65.3±13.3 66.0±13.3 61.6±12.7 0.052术前下肢 SBP/(mmHg) 101.5±20.3 101.7±18.6 100.4±26.9 0.763术前下肢 DBP/(mmHg) 53.9±11.8 54.4±12.0 51.4±10.8 0.142术前化验指标术前 Cr/(μmol/L) 87.3 ±39.4 86.8 ±34.9 89.6 ±55.5 0.756术前 Hb/(g/L) 16.3±11.3 160.1±10.2 173.5±15.5 0.303术前 WBC/(109/L) 11.8±3.3 11.7±3.3 11.8±3.2 0.872术前NEUT/% 79.8±6.7 79.0±6.4 83.4±6.3 0.000术前 CRP/(mg/L) 30.5±16.0 31.5±16.9 25.8±9.3 0.039术前 TNI/(ng/mL) 0.0(0.0,0.1) 0.0(0.0,0.1) 0.0(0.0,0.2) 0.043术前凝血功能术前凝血酶原时间/s 12.2±1.2 12.2±1.1 12.4±1.4 0.193术前凝血酶原活动度/% 85.8±14.2 86.2±14.4 84.1±13.5 0.388术前活化部分凝血活酶时间/s 31.2±5.5 31.3±5.8 30.8±3.9 0.667术前纤维蛋白原定量/(g/L) 3.4(2.3,4.4) 3.6(2.5,4.5) 2.5(1.7,4.3) 0.068术前 D 二聚体定量/(μg/L) 1327.0(678.0,2665.0) 1085.0(615.3,2545.0) 2304.0(1252.0,4671.0) 0.106术前纤维蛋白原降解产物/(μg/L) 13.7(6.8,27.9) 11.1(6.5,23.9) 23.0(13.6,54.7) 0.043术前国际标准化比值 1.1±0.1 1.1±0.1 1.1±0.1 0.195既往病史吸烟94(41.4) 80(43.0) 14(34.1) 0.298高血压 162(71.4) 130(69.9) 32(78.0) 0.297糖尿病 6(2.6) 5(2.7) 1(2.4) 0.928脑血管病 2(0.9) 2(1.1) 0 0.506 COPD 1(0.4) 1(0.5) 0 0.639冠心病 5(2.2) 5(2.7) 0 0.289马方综合征 3(1.3) 2(1.1) 1(2.4) 0.490心脏手术史 2(0.9) 1(0.5) 1(2.4) 0.241
本研究结果发现了6个影响重度AKI的危险因素。其中,女性、术前NEUT%,和术前TNI可以帮助医生早期预测术后可能发生重度AKI的高危人群。可修正的影响因素包括CPB时间、术后带管时间以及LVEF,值得注意的是,这3个变量通过优化临床决策是可以纠正的。
流行病学数据提示体外循环是AKI第二大原因[19],AKI发生率随体外循环时间延长而增加[20-21]。由于AAAD患者具有病情危急和手术复杂等特性,这类患者体外循环时间远超于其他心脏手术,血液稀释、脏器组织低灌注、炎症反应、凝血功能紊乱、微栓沉积于肾脏血管壁、输注大量血制品和促凝药物以及缺血再灌注损伤都有可能导致术后AKI。随着外科手术和体外循环技术方法学的不断完善,有望降低AKI的发生。
表3 两组术中临床资料比较[±s,n(%),M(QR)]
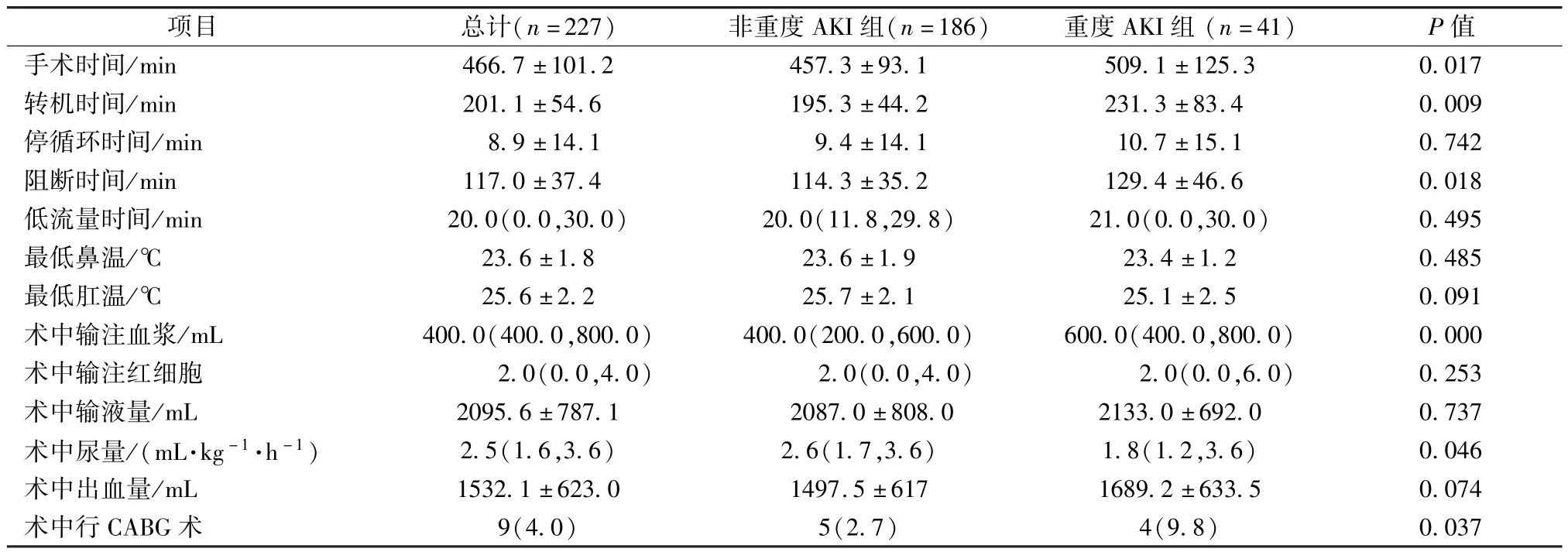
表3 两组术中临床资料比较[±s,n(%),M(QR)]
项目 总计(n=227) 非重度AKI组(n=186) 重度AKI组(n=41) P值手术时间/min 466.7±101.2 457.3±93.1 509.1±125.3 0.017转机时间/min 201.1±54.6 195.3±44.2 231.3±83.4 0.009停循环时间/min 8.9±14.1 9.4±14.1 10.7±15.1 0.742阻断时间/min 117.0±37.4 114.3±35.2 129.4±46.6 0.018低流量时间/min 20.0(0.0,30.0) 20.0(11.8,29.8) 21.0(0.0,30.0) 0.495最低鼻温/℃ 23.6±1.8 23.6±1.9 23.4±1.2 0.485最低肛温/℃ 25.6±2.2 25.7±2.1 25.1±2.5 0.091术中输注血浆/mL 400.0(400.0,800.0) 400.0(200.0,600.0) 600.0(400.0,800.0) 0.000术中输注红细胞 2.0(0.0,4.0) 2.0(0.0,4.0) 2.0(0.0,6.0) 0.253术中输液量/mL 2095.6±787.1 2087.0±808.0 2133.0±692.0 0.737术中尿量/(mL·kg-1·h-1) 2.5(1.6,3.6) 2.6(1.7,3.6) 1.8(1.2,3.6) 0.046术中出血量/mL 1532.1±623.0 1497.5±617 1689.2±633.5 0.074术中行CABG术 9(4.0) 5(2.7) 4(9.8) 0.037
表4 两组术后临床资料比较[±s,n(%),M(QR)]

表4 两组术后临床资料比较[±s,n(%),M(QR)]
注:延迟拔管:术后48h后未拔除气管插管视为拔管延迟;RRT:肾脏替代治疗
项目 总计(n=227) 非重度AKI组(n=186) 重度AKI组(n=41) P值术后化验指标术后 Hb/(g/L) 10.4±2.2 10.4±1.7 10.7±3.6 0.604术后 TNI/(μg/L) 0.8(0.3,3.8) 0.5(0.0-3.8) 5.0(3.3-7.8) 0.014术后24h输注血浆/mL 0.0(0.0,400.0) 0.0(0.0,400.0) 0.0(0.0,400.0) 0.840术后24h输注RBC 0.0(0.0,2.0) 0.0(0.0,2.0) 0.0(2.0,4.0) 0.008术后24h尿量/mL 2747.9±1083.0 2943.5±1033.7 1874.2±854.2 0.000术后24h输液量/mL 3340.7±1168.8 3378.6±1142.2 3172.4±1285.1 0.307术后LVEF/% 60.5±7.2 61.1±7.2 57.9±6.4 0.011术后清醒时间/h 5.0(3.0,12.0) 5.0(3.0,11.3) 5.5(0.8,87.0) 0.034术后气管插管时间/h 24.0(15.0,63.8) 18.00(14.0,41.5) 144.0(63.0,247.5) 0.001术后延迟拔管 67(29.5) 40(21.9) 27(65.9) 0.000 ICU 停留时间/h 46.5(20.0,113.5) 37.0(19.5,86.5) 186.6±211.9 0.001住院时间/d 13.0(9.5,17.5) 13.0(10.0,17.0) 14.0(9.0,20.5) 0.285二次手术 22(9.7) 15(8.1) 7(17.1) 0.080气管切开 13(5.7) 6(3.2) 7(17.1) 0.001术后RRT 16(7.0) 0 16(39.0) 0.000术后并发症呼吸系统并发症 34(15.0) 16(8.6) 18(43.9) 0.000神经系统并发症 24(10.6) 13(7.0) 11(26.8) 0.000消化系统并发症 13(5.7) 7(3.8) 6(14.6) 0.007截瘫 11(4.8) 6(3.2) 5(12.2) 0.016死亡 13(5.7) 6(3.2) 7(17.1) 0.001

表5 AAAD术后重度AKI危险因素Logistic多元回归分析
LVEF是反应左心功能的重要指标之一。肾脏灌注占心输出量的20% ~25%,因此,低LVEF应警惕肾脏缺血的可能。此时,肾素-血管紧张素-醛固酮和交感神经系统被激活,可对肾脏组织和功能产生显著作用。体外循环期间主动脉血流被阻断,有导致肾脏灌注进一步减低的风险。本研究中术前LVEF组间无差异,但术后发生重度AKI患者组LVEF较非重度AKI更低,考虑与心肌损伤有关,提示术中心肌保护与术后肾功能结局密切相关,需要临床医师格外关注。麻醉医生可以通过调控血流动力学和选用具有心肌保护作用的药物,实现术中心肌保护。近些年关注较多的七氟烷、异氟烷、新型麻醉气体—氙气、磷酸肌酸钠、乌司他丁和右美托咪定等,均具有一定的心肌保护作用。此外,体外循环灌注的停跳液类型选择,也对心肌保护具有一定程度影响。
术后气管插管拔除延迟的患者,往往是因肺功能受损出现低氧血症和呼吸衰竭,脱呼吸机困难所致。肾脏是氧高度敏感脏器[22],大血管手术术中出血量大,有效循环血容量减低,导致肾脏的的血供及氧供随之减少;加之氧化应激损伤以及肾小管需氧量的增加,容易导致肾功能的异常。既往研究发现术后早期发生严重低氧血症(PaO2/FiO2≤100)患者中AKI发生比例明显高于非低氧血症的患者[23]。因此应关注围术期肺功能维护。
本研究结果中女性术后发生重度AKI的风险是男性的4.2倍,女性患者术后清醒时间与ICU停留时间均较男性患者更长。提示女性患者是AAAD术后发生重度AKI的高危人群。近期报道的AKI诊断相关的新型标志物,包括cystatin-C、白细胞介素-18、KIM-1和 NGAL等,有助于 AKI的早期诊断[25-27],但是这些标志物检测费用高昂,临床上并未普及使用。而中性粒细胞百分比,不仅对炎症反应具有良好的代表性[28],并且是临床常规的检查之一。肾功能减低的患者TNI升高的机制并未明确,但相关研究数据表明,TNI升高与AKI风险有关,包括病死率的增加[28]。
由于本研究是对现有资料进行回顾性分析,不是随机对照研究,因而无法规避混杂因素干扰。但本研究关注术后AKI的动态变化,重在探讨重度AKI(3期)的危险因素,与既往研究相比,对临床的危重病人有更加明确的指导意义。
