低温反硝化细菌的筛选及初步应用
2018-09-20郑雅元肖海燕王祥河许勤虎
郑雅元肖海燕 王祥河 许勤虎 刘 然
(天津市工业微生物研究所有限公司,天津 300457)
从废水中去除氮是控制水污染、修复水质的最重要手段之一。随着我国城市化进程加快、生产生活迅速发展,生活污水和工业废水排放量日益增多,氮素的治理工作越来越受到重视。在废水脱氮的众多方法中,生物脱氮技术因其绿色环保、行之有效等特点受到广大研究者的关注。生物脱氮是以反硝化细菌为主,在兼性厌氧条件下,将硝酸盐及亚硝酸盐作为电子受体进而生成氮气的过程。
秋冬时节气温条件低,此时微生物生长活动受到抑制,导致生物脱氮效果不理想。有研究报道称,当温度条件在10℃以下时,硝化和反硝化进程会受到强烈抑制。目前国内外研究报道生物脱氮技术的温度一般在30℃左右,涉及到低温条件的研究比较少见。因此,从环境中分离筛选出能在较低温度下生长、具有高效反硝化细菌菌株成为强化生物脱氮技术的关键。
1 材料与方法
1.1 材料
污泥样品采自天津某污水处理厂;试验用污水取自天津某调味料厂豆制品加工车间。
富集培养基:CH3COONa,2 g;KH2PO4,0.4 g;MgSO4·7H2O,0.6 g;CaCl·2H2O,0.07 g;KNO3,1 g;Tris缓冲液12mL;微量元素2mL;蒸馏水,1000mL;pH 7.0~7.2;121℃,灭菌 20min。
初筛培养基(BTB选择性培养基):KNO3,1 g;KH2PO4,1 g;FeCl2·6H2O,0.5 g;CaCl2·7H2O,0.2 g;MgSO4·7H2O,1 g;琥珀酸钠,8.5 g;琼脂,20 g;BTB(质量分数1.5%溴百里酚蓝溶于无水乙醇),1mL;蒸馏水,1 000mL;pH 7.0;121℃,灭菌20min。
复筛培养基:乙酸钠,4.72 g;KNO3,0.075 g;KH2PO4, 1.5 g; Na2HPO4, 0.42 g; MgSO4·7H2O,0.1 g;蒸馏水,1 000mL;pH 7.2;121℃,灭菌20min。
需氧性及运动性测定培养基:蛋白胨,10 g;酵母膏,5 g;葡萄糖,1 g;琼脂,15 g;蒸馏水,1 000mL;pH自然;115℃,灭菌15min。
保藏培养基:可溶性淀粉,2 g;NH4Cl,0.5 g;NaCl,0.5 g;MgSO4·7H2O,0.01 g;FeSO4·7H2O,0.01 g;K2HPO4,0.2 g;蒸馏水,1 000 mL;pH 7.2;121℃,灭菌20min。
LB培养基:牛肉膏,3 g;蛋白胨,10 g;Na-Cl,5 g;蒸馏水,1 000mL;pH 7.2;琼脂,20 g;121℃,灭菌20min。
1.2 微低温反硝化细菌的富集培养
将污泥样品混合均匀,称取1 g置于500mL三角瓶中,加入400mL富集培养基,形成深层培养的缺氧环境,在22℃条件下慢速恒温振荡培养48 h,取培养液20mL至400mL新鲜富集培养基中,以2℃为梯度降低培养温度,如此反复3次。
1.3 微低温反硝化细菌的初筛、纯化
将多次富集培养后的菌液进行梯度稀释,涂布于初筛培养基(BTB选择性培养基) 上,置于16℃培养箱培养2 d~3 d,选择菌落周围出现蓝色晕环的单菌落,在新的BTB平板培养基上进行三区划线,重复3~5次,获得纯化的反硝化菌株,涂布于LB培养基上无杂菌生长,接种于保藏培养基斜面上,编号,16℃培养1 d,4℃冰箱保存备用。
1.4 微低温反硝化细菌生长曲线的测定
将保藏培养基斜面上的菌种用接种环挑取一环接入复筛液体培养基中,于20℃、120 r/min条件下振荡培养5 d,每隔12 h测定各培养液的OD600值,制作各细菌的生长曲线。
1.5 微低温反硝化细菌的复筛
分别将处于对数生长期的菌悬液转接到复筛培养基中,以不接菌为对照组,于20℃、120 r/min条件下振荡培养,每24 h分别测定实验组和对照组复筛培养基中总氧化氮、总氮、细菌OD600及离心除菌后培养液中的总氮含量。
用以下公式计算总氧化氮和总氮的去除率:
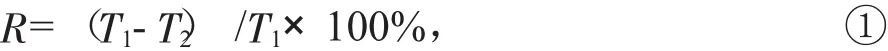
式中:R——复筛培养基中总氮(总氧化氮)的去除率;
T1——复筛培养基中总氮(总氧化氮) 的初始质量浓度,mg/L;
T2——复筛培养基中总氮(总氧化氮) 的最终质量浓度,mg/L。
生物量氮通过氮平衡计算获得,其公式为:

式中:T——生物量氮mg/L;
T2——反硝化培养基中总氮的终质量浓度,mg/L;
T3——通过离心去除菌体后培养液中总氮的终质量浓度,mg/L。
1.6 微低温反硝化细菌的耐冷试验
将处在对数生长期的mn-5菌株悬液转接到新的复筛培养基中,于16℃条件下慢速振荡培养3 d,检测总氮的去除率。
1.7 革兰氏染色
对mn-5菌株进行革兰氏染色,确定其是属于革兰氏阴性菌(G-),还是革兰氏阳性菌(G+)。
1.8 需氧性及运动性测定
将需氧性测定培养基分装入试管,灭菌后取出冷至凝固,将试管倒置,用接种针蘸取少量菌苔,自固体深层培养基表面的中心点垂直穿刺,直到接近培养基底部,然后轻轻退出,保持接种线整齐。于20℃培养1 d,观察细菌沿穿刺线的生长情况。
需氧性判定依据:专性好氧菌只生长在培养基表面;专性厌氧菌只生长在培养基底部;兼性厌氧菌生长在培养基表面及整个穿刺线;微好氧菌生长在培养基的中上部,约接近表面4mm处。运动能力判定依据:具有运动能力的细菌经穿刺培养后可沿着穿刺线向外运动生长,形成较粗的细菌生长线,且边缘不整齐;不能运动的细菌仅能沿穿刺线生长,形成细而整齐的生长线。
1.9 污水处理的初步应用
把筛选出的mn-5菌株按接种量0.5 g/100g接入含污泥的豆制品加工废水中,以不接种的废水为空白对照,在16℃条件下培养5 d,测定废水中的总氮含量。
1.10 试验指标检测方法
试验采用的检测方法见表1。

表1 试验主要指标检测方法一览表
2 结果与讨论
2.1 微低温反硝化细菌的初筛
采用先富集、后选择性培养的方法进行菌种的分离和纯化,试验中通过肉眼观察,共挑选出10株菌株,经过平板划线对比发现,菌株按其生长速度可大致分为三类。一类,1号、5号、7号、10号共4株菌,长势旺盛,培养2 d~3 d即能长出显著菌落,且易于转移至斜面培养基保存;二类,2号、3号、4号、8号共4株菌,长势较慢,培养5 d左右长出明显菌落,尽管不如一类菌株长势旺盛,但菌落特征显著;三类,6号、9号共2支菌株,长势较慢,培养7 d后尚见细微菌落出现。将各菌株分别编号为mn-1~mn-10,培养过程中观察并记录了各个菌株的形态特征,结果见表2。
2.2 微低温反硝化细菌的复筛
当细菌处于对数生长期时,其个体形态与生理特性都比较稳定,因此将纯化后的单菌落接于复筛培养基中,测定各菌株的OD600值,绘制生长曲线,以确定各菌株的对数生长期,结果如图1所示。将纯化后的10株菌株分别接种到复筛培养基中,以未接种的三角瓶为空白对照,进行筛选。通过测定滤液中硝态氮、亚硝态氮、总氮及离心去除菌体后的总氮浓度变化,从而确定各菌株的脱氮能力。培养3 d后各菌株对培养基中氮含量的降解情况如下页表3所示。

图1 10株反硝化菌株的生长曲线
表2 反硝化菌初筛菌株菌落形态表
由表3可以看出,培养3 d后,各组的硝态氮含量均出现了不同程度的降低,说明分离出的菌株普遍具有硝酸盐还原能力。测定结果显示硝态氮去除率大于50%的菌株有7株,其中mn-1和mn-5达到85%以上。然而随着硝酸盐的分解,亚硝酸盐开始积累。硝态氮的去除表明了菌株还原硝酸盐的能力,但亚硝态氮的累积,又说明某些菌株仅具有将NO3-初步还原为NO2-的能力,但无法进行或尚未进行进一步的还原反应,导致不能从反应体系中彻底脱氮。通过对比可以看出,菌株mn-1将硝态氮几乎全部还原,但是还原产物大部分以亚硝态氮的形式存在,该菌株对亚硝态氮还原能力的缺失导致其总氧化氮去除率仅为3.6%。脱氮能力甚微。而菌株mn-5不仅硝态氮的去除率高,亚硝态氮的含量也没有积累,表明对氮的去除比较完全,应具有完整的反硝化酶系,从而表现出了较强的脱氮能力。
通过氮平衡的方法计算出了菌体生长所合成的生物量氮含量,见表4。

表3 培养基中硝态氮和亚硝态氮的含量变化

表4 培养基中总氮的含量变化
由表4可以看出,培养3 d后,菌株mn-5的总氮去除率为48.5%,生物量氮合成量为3.25mg/L。
对筛选出的菌株mn-5进行镜检,菌体两端钝圆,确定为革兰氏阴性短杆菌见图2。
2.3 菌株mn-5的耐冷试验
mn-5菌株在16℃条件下,3 d内总氮去除率为42.3%,与该菌在20℃条件下除氮相比效果有所下降,生物量氮的合成量也有所降低(3.01mg/L),可能是低温使细菌生长速率减慢造成的。
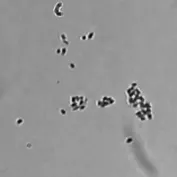
图2 菌株mn-5革兰氏染色照片
2.4 菌株mn-5处理污水的初步应用
把菌株mn-5接入含污泥的豆制品加工废水中,以不接种的废水为空白对照,在16℃条件下培养5 d,测得废水中的总氮含量变化结果见图3。

图3 菌株mn-5对污水中总氮的去除效果
由图3可以看出,空白对照组总氮去除率为10.1%,试验组的去除率为13.3%,提高了3%左右,与空白对照组相比其增长率为31.7%。在处理污水的实际应用中,菌种对总氮的去除率远远达不到筛选菌种时的40%以上,究其原因可能是由于筛选用培养基是以无机小分子成分为主,而豆类污水是以有机大分子为主,两者在物质组成上有很大的不同,菌种对污水环境中的大分子有机物不适应导致,有待于进一步深入研究。
