瓜尔豆胶酶解液改性蛋清蛋白凝胶性质的研究
2018-09-18段汝清苏宇杰王俊伟杨严俊
段汝清 , 苏宇杰 , 王俊伟 , 周 蓓 , 杨严俊 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏无锡 214122;3.江苏康德蛋业有限公司,江苏 南通 226600)
蛋清蛋白作为一种功能性食品原料,被广泛应用于食品加工领域[1]。凝胶性是蛋清蛋白一项重要的功能性质,多用于鱼糜制品和肉制品中[2]。国内外采用了多种方法对蛋清蛋白进行改性以提高蛋清蛋白的凝胶性,降低生产成本,其中糖基化被证实是一种安全可靠的方法[3]。Naotoshi[4]等人利用半乳甘露聚糖与蛋清蛋白粉进行接枝反应,发现接枝产物的凝胶性、持水性、热稳定性都得到了改善;于滨[5]等人利用麦芽糊精对蛋清蛋白粉进行改性,结果表明糖基化蛋白较未改性的蛋清蛋白在热稳定性、凝胶性、乳化性、起泡性方面都得到了显著提高。
虽然利用糖类与蛋清蛋白进行接枝,制备高凝胶性蛋白粉的研究已有很多。但过去研究中用于对蛋清蛋白进行糖基化改性的多糖通常价格较为昂贵,这势必限制了研究的应用范围。而瓜尔豆胶是一种来源稳定、价格低廉的中性多糖,用其来改善蛋清蛋白,对改性蛋清粉的工业化生产和产品的实际应用具有重要意义。作者利用瓜尔豆胶酶解液与蛋清蛋白接枝,对接枝产物的凝胶性能进行研究,以期为改性蛋清蛋白粉的广泛应用提供理论依据。
1 材料与方法
1.1 材料与试剂
蛋白粉:自制;瓜尔豆胶:阿拉丁试剂(上海)有限公司产品;β-甘露聚糖酶:江苏锐阳生物科技有限公司产品;其他化学试剂均为国产分析纯。
1.2 仪器与设备
Waters 1525高效液相色谱仪:美国Waters公司产品;TA-xTZi物性测试仪:英国 Stable Micro System公司产品;DYY-III2稳压稳流电泳仪:北京市六一仪器厂产品;日立台式扫描电子显微镜TM3030:日本日立公司产品。
1.3 实验方法
1.3.1 蛋白粉的制备 从新鲜鸡蛋中取出蛋清→搅拌均匀→弃去泡沫→利用柠檬酸调pH至6.8左右→酵母发酵脱糖处理→利用柠檬酸调pH 6.0左右→喷雾干燥 (进风温度 (170±10)℃,出风温度(70±2) ℃)。
1.3.2 瓜尔豆胶酶解液的制备 底物质量浓度为0.5 g/dL的瓜尔豆胶溶液在最佳酶解条件 (加酶量60 U/g,pH 5.0,45℃水浴酶解8 h)下进行酶解反应,反应完毕后,将所得酶解液煮沸10 min灭酶,4 000 r/min离心20 min,取上清液备用。1.3.3 瓜尔豆胶酶解液的组分分析
1)高效凝胶过滤色谱(HPGFC)分析 将备用瓜尔豆胶酶解液用0.45 μm微孔膜过滤,取滤液进样,采用HPGFC法测定瓜尔豆胶酶解液的相对分子质量分布。色谱条件:色谱柱:UltrahydrogelTMLinear 300 mm×7.8 mm; 流动相:0.1 mol/L 硝酸钠;流量:0.8 mL/min;柱温:30 ℃;进样量:10 μL。
2)高效液相色谱(HPLC)分析 将备用瓜尔豆胶酶解液用0.45 μm微孔膜过滤,取滤液进样,采用HPLC法测定瓜尔豆胶酶解液中单糖(甘露糖)及其他组分的含量。色谱条件:色谱柱Sugarpak1,6.5 mm×300 mm;流动相:纯水;检测器;Waters2410 示差折光检测器;柱温:85 ℃;流量:0.4 mL/min;进样量:10 μL。
1.3.4 蛋清蛋白-瓜尔豆胶酶解液接枝产物的制备在Naotoshi[4]等人的方法上稍加修改来制备接枝产物。将瓜尔豆胶酶解液与原蛋白粉(EWP)按一定的配比 (以酶解前的瓜尔豆胶与蛋白粉的质量比计算,配比范围为0.1%至2.5%)混合后溶解,配制成蛋白质浓度为10 g/dL的混合溶液,搅拌均匀后,调节溶液至一定的pH值(pH值范围为5.0~10.0),分装,冷冻干燥。冻干后,将冷冻干燥物平铺在玻璃培养皿中,并用刺孔的铝箔覆盖,放置于干燥器(底部含有饱和KBr溶液,相对湿度79%)中,于60℃烘箱中反应1~7 d,即制得不同反应时间的接枝产物(改性蛋白粉,M-EWP)。接枝产物置于密封的塑封袋中,于-18℃下保存。
1.3.5 凝胶性测定 根据参考文献[5]的方法测定。1.3.6 改性蛋白粉的凝胶强度随pH值的变化将样品溶于去离子水中,配制成质量浓度为10 g/dL的蛋白溶液,分别调节pH值至3.0~10.0,测定不同pH值条件下制得凝胶的凝胶强度。
1.3.7 游离氨基含量的测定 参考文献 [6]方法测定。
1.3.8 褐变程度的测定 参考文献[7]方法测定。
1.3.9 SDS-PAGE分析 参考文献[8]方法测定。
1.3.10 氨基酸分析 食品中氨基酸的测定方法(GB/T 5009.124—2003)进行分析。
1.3.11 凝胶扫描电镜分析 参考文献 [9]方法测定。
1.3.12 数据处理 采用 Origin8.6软件作图,SPSS 17.0软件进行实验数据的处理和分析。
2 结果与分析
2.1 瓜尔豆胶酶解液的组分分析
2.1.1 高效凝胶过滤色谱(HPGFC)分析 固定瓜尔豆胶质量浓度为0.5 g/dL,以酶解率为考察指标,依次对加酶量 (10~80 U/g)、酶解pH值 (pH 4.0~8.0)、酶解温度(40~60 ℃)、酶解时间(2~10 h)进行单因素实验,以确定瓜尔豆胶酶解的最佳条件。结果得出,瓜尔豆胶酶解的最佳条件为:加酶量60 U/g,pH 5.0,45℃水浴酶解8 h,在此条件下瓜尔豆胶的酶解率可达21.76%。为了研究瓜尔豆胶被β-甘露聚糖酶酶解后各种相对分子质量组分的相对含量,对瓜尔豆胶的酶解液进行高效凝胶过滤色谱分析,其相对分子质量分布结果如图1和表1所示。
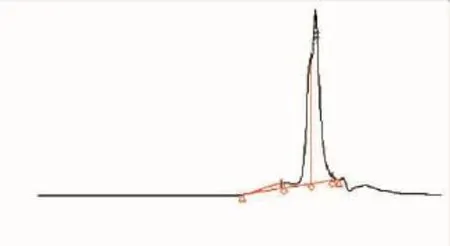
图1 瓜尔豆胶酶解液的凝胶过滤色谱图Fig.1 HPGFC of guar gum hydrolysate
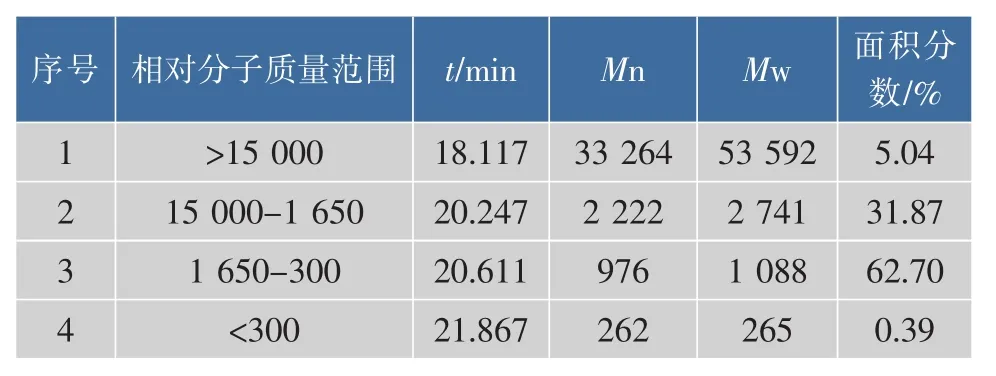
表1 瓜尔豆胶酶解液的相对分子质量分布Table 1 Molecular weight distribution of guar gum hydrolysate
单糖(甘露糖)的相对分子质量约为180,通过计算可知,二糖的理论相对分子质量约为342,十糖的理论相对分子质量约为1 638。由文献资料[10]可知,半乳甘露聚糖的主要相对分子质量约为15 000。在此基础上,可初步得出结论:相对分子质量小于300的的成分非常少,质量分数为0.39%,即瓜尔豆胶酶解液中几乎不含有单糖;相对分子质量在300至1 650之间的成分,为酶解液的主要成分,质量分数为62.70%,此部分主要成分为二糖到十糖(即甘露低聚糖);相对分子质量在1 650至15 000之间的成分,质量分数为31.87%,此部分为瓜尔豆胶酶解产生的各种十糖以上的多糖;相对分子质量大于15 000的成分,质量分数为5.04%,此部分主要为未被酶解的瓜尔豆胶。总的来说,瓜尔豆胶的酶解液中几乎不含有单糖,甘露低聚糖的成分居多,未被酶解的部分较少。
2.1.2 高效液相色谱(HPLC)分析 为了进一步确认瓜尔豆胶酶解液中的单糖(甘露糖)含量,取甘露糖标准溶液及瓜尔豆胶酶解液进行了高效液相色谱检测,结果如图2所示。
根据标准品的出峰时间,可知甘露糖标准溶液的保留时间为14.00。通过色谱面积归一化法定量,得出瓜尔豆胶酶解液中的甘露糖的含量为0.12%,说明酶解液中几乎不含有甘露糖,这与高效凝胶过滤色谱分析得到的结果相一致。
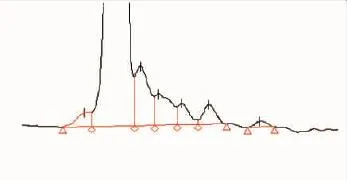
图2 瓜尔豆胶酶解液的高效液相色谱图Fig.2 HPLC of guar gum hydrolysate
2.2 接枝反应条件对接枝产物凝胶性质的影响
蛋白质与多糖的接枝反应受到多种因素的影响。作者确定瓜尔豆胶酶解液作为接枝物与蛋清蛋白共价结合,主要研究3个接枝反应条件:底物配比、反应pH值和反应时间对接枝产物凝胶性能(包括凝胶强度和持水性)的影响。
2.2.1 底物配比对接枝产物凝胶性质的影响 底物配比会直接影响到美拉德反应的反应速率和反应进程。质量浓度为0.5 g/dL的瓜尔豆胶溶液酶解后,酶解液中水分含量较多,糖组分含量较少,为了更直观地说明添加糖的比例,以及方便计算,取酶解前瓜尔豆胶的质量进行计算。作者选取了5个底物配比:质量分数 0.10%,0.25%,0.50%,1.00%,2.50%,(以酶解前的瓜尔豆胶与蛋白粉的质量比计算),固定反应pH值为7.0的条件下,反应3 d,研究接枝产物的凝胶强度和持水性,结果如图3所示。
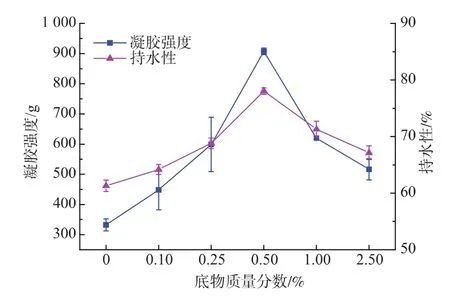
图3 底物质量分数对接枝产物凝胶性质的影响Fig.3 Effect of different weight ratio on gel?properties of the grafted product
Imperiali[11]等人的研究表明,蛋清蛋白的凝胶强度越高,其凝胶的持水性越高,凝胶强度和持水性之间有密切的联系,作者的研究结果与其结论相一致。由图3可知,接枝产物的凝胶强度和持水性有相同的变化趋势。当瓜尔豆胶酶解液和蛋清蛋白的质量比不断减少时,其对应的接枝产物的凝胶强度和持水性是先升高再降低的趋势。在底物质量分数为0.5%时,接枝产物的凝胶强度和持水性达到最大。当底物配比过大时,美拉德反应剧烈,改性蛋白粉的颜色较深,易结块且溶解性不好,接枝产物的凝胶强度和持水性较差。当底物配比过小时,糖对蛋白的作用较小,接枝产物的凝胶强度和持水性改善效果不明显。故选取适当的底物质量分数对于改善接枝产物的功能性质有着重要的意义。作者选取底物质量分数为0.5%进行后续的实验。
2.2.2 反应pH值对接枝产物凝胶性质的影响pH值影响蛋白质和多糖的结构和电荷,从而影响接枝产物的形成[12]。控制底物质量分数为0.5%,反应时间为3 d的条件下,改变pH值,研究其对接枝产物凝胶强度和持水性的影响,结果如图4所示。
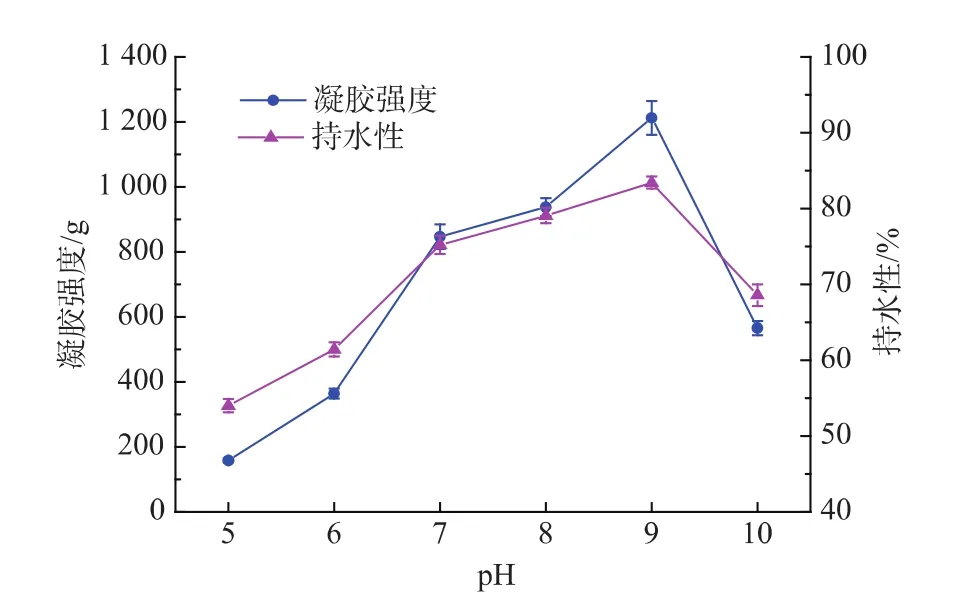
图4 反应pH值对接枝产物凝胶性质的影响Fig.4 Effect of different pH value on gel?properties of the grafted product
由图4可知,在pH值小于9.0时,随着pH值的增大,接枝产物的凝胶强度和持水性逐渐增大;当pH值等于9.0时,接枝产物的凝胶强度和持水性达到最大;当pH值大于9.0时,接枝产物的凝胶强度和持水性减小。一般认为,羰氨缩合是一个可逆的过程,在酸性溶液中,羰氨缩合产物很容易水解,不利于反应的进行,因此在这样的条件下,美拉德反应不显著[13]。随着反应体系pH值的逐渐增大,体系的碱性增强,有利于美拉德反应前体物质的生成,从而加快了美拉德反应的速度,有利于反应的进行。但当碱性过强时,可能会出现肽键断裂、脱羧和脱氨等情况,使蛋白质的一级结构遭到破坏,从而不利于接枝反应的进行。故本实验选取pH值为9.0进行后续实验。
2.2.3 反应时间对接枝产物凝胶性质的影响 反应时间也是美拉德反应的一个重要影响因素。反应时间不够,可能导致美拉德反应不完全,而反应时间过长,接枝产物的功能性质可能会受到不良影响。控制底物质量分数为0.5%,反应pH值9.0的条件下,改变反应时间,研究其对接枝产物凝胶强度和持水性的影响,结果如图5所示。

图5 反应时间对接枝产物凝胶性质的影响Fig.5 Effect of different reaction time on gel?property of the grafted product
由图5可知,在接枝反应的1~4 d内,改性蛋白粉的凝胶强度和持水性显著提高,加热4 d后达到最大值,分别由332.348 g和61.29%提高到1 527.257 g和86.06%,比改性之前分别提高了359.54%和40.41%,但加热5 d后,改性蛋白粉的凝胶强度和持水性开始下降。这可能是因为反应初期瓜尔豆胶酶解液中的糖组分与蛋清蛋白逐步结合使得蛋白质结构部分展开,从而提高了接枝产物的凝胶强度和持水性;随着反应时间的延长,过度结合使得接枝产物的溶解性有所降低,从而使得接枝产物的凝胶强度和持水性下降。实验选取改性4 d的蛋白进行后续氨基酸分析和凝胶微观结构分析。综上由单因素实验可得,接枝反应条件为底物质量分数为0.5%,反应pH值为9.0,反应时间为4 d时,制备的接枝产物具有最佳的凝胶强度和持水性。
2.3 改性蛋白粉的凝胶强度随pH值的变化
蛋白质发生美拉德反应之后其结构会发生一定的变化,凝胶强度随pH的变化也会有所不同。本实验研究了改性蛋白粉和原蛋白粉在不同pH值下凝胶强度的变化,结果如图6所示。
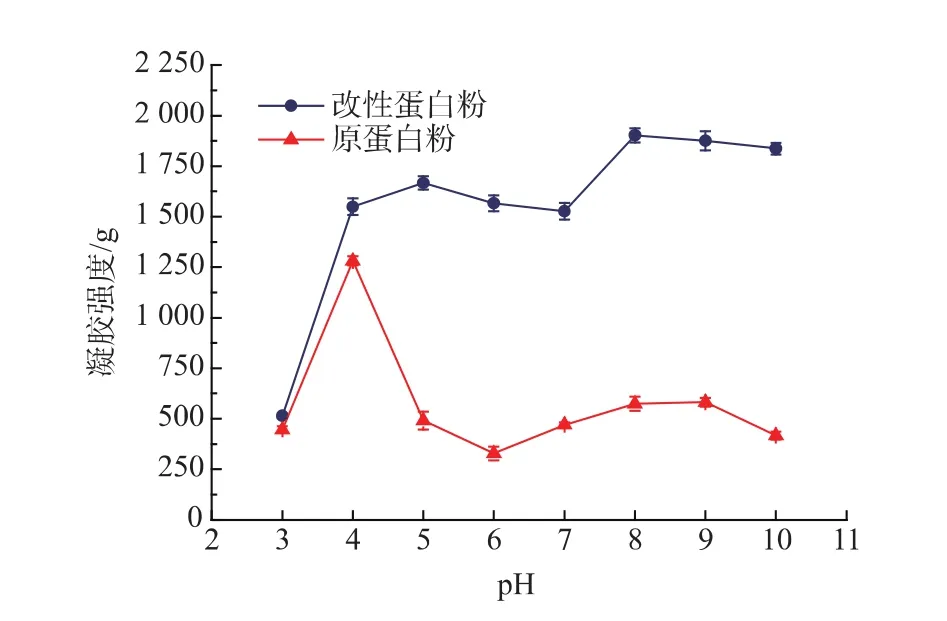
图6 改性蛋白粉和原蛋白粉凝胶强度随pH值的变化Fig.6 Effect of pH value on gel?strength of EWP and M-EWP
由图6可知,原蛋白粉在pH值为4.0时,凝胶强度达到最大值,pH值为6.0时,凝胶强度最小。而改性后的蛋白粉在pH值为3.0时,与原蛋白粉的凝胶强度几乎一样,但在pH值为4.0~10.0的范围内时,改性后的蛋白粉的凝胶强度远远大于原蛋白,且都能保持在大于1 500 g,这一点对于改性蛋白粉作为食品添加剂在工业上的应用是十分有利的。
2.4 改性蛋白粉的凝胶强度随储藏时间的变化
Hammershoj[14]等人和 Hidalgo[15]等人的研究表明,卵白蛋白的凝胶性随贮藏期的延长明显降低。目前,关于糖基化改性后,蛋清蛋白粉的凝胶性随储藏时间的变化规律还不明确。因此,选择在底物质量分数为0.5%,反应pH值9.0的条件下分别反应2,4,6 d的接枝产物进行研究,将这3种接枝产物置于4℃条件下储存,每隔7 d时间取样测定凝胶强度,结果如图7所示。
由图7可知,改性2 d的蛋白粉的凝胶强度随着储藏时间的延长先增大后趋于平缓,虽然其凝胶强度是有增大的趋势,但即便是凝胶强度有所提高后,也比不上改性4 d的蛋白粉;改性4 d的蛋白粉的凝胶强度在35 d内变化的相对较小,4℃条件下储藏35 d时,改性蛋白粉的凝胶强度较储藏初期仅下降了1.44%,且该改性蛋白粉的凝胶强度可以达到一个较高的水平;改性6 d的蛋白粉的凝胶强度随着储藏时间的延长而不断下降,非常不利于储藏。
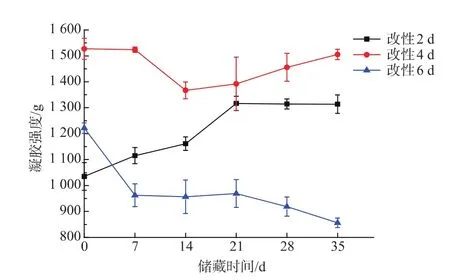
图7 改性蛋白粉的凝胶强度随储藏时间的变化Fig.7 Change of gel strength of M-EWP with storage time
不同的改性时间,改性产物在储藏期间的凝胶稳定性各不相同,这可能是由于改性时间不同,糖基化程度不同,接枝产物的结构变化有所区别,也导致产物的溶解性不同。以上结果表明,改性4 d的蛋白粉不仅在凝胶性能上有较好的改善效果,而且具有较好的储藏稳定性,这一改性条件对于改性蛋白粉的实际生产具有非常重要的意义。
2.5 接枝产物游离氨基质量分数的变化
糖基化反应的进程可以由游离氨基质量分数来表示,反应进行越彻底,消耗的游离氨基越多[16]。在控制底物质量分数为0.5%,反应pH值9.0的条件下,研究改性蛋白粉中游离氨基质量分数随反应时间的变化。以原蛋白粉中游离氨基的质量分数为100%计,计算改性蛋白粉中游离氨基质量分数,变化趋势如图8所示。
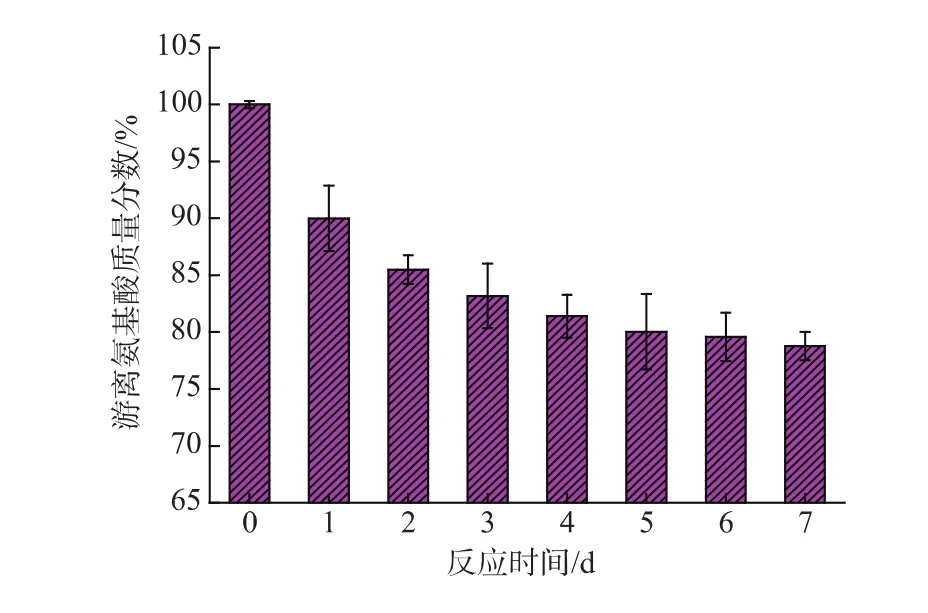
图8 改性蛋白粉游离氨基质量分数随反应时间的变化Fig.8 Change of free amino contents of M-EWP with reaction time
从图8可以看出,改性蛋白粉中游离氨基质量分数随着反应时间的延长而明显减少,且前4 d内减少迅速,在5~7 d内减少缓慢。虽然原蛋白在干热过程中体系中的游离氨基含量也会有所降低,但损失率较少,这说明瓜尔豆胶酶解液中的糖组分与蛋白粉之间确实发生了美拉德反应,从而造成游离氨基质量分数下降。
2.6 接枝产物的褐变程度分析
除了游离氨基外,美拉德反应的进行程度也可以用褐变指数来反映。作者在控制底物质量分数为0.5%,反应pH值9.0的条件下,研究改性蛋白粉的褐变指数随反应时间的变化,结果如图9所示。结果表明,随着反应时间的延长,改性蛋白粉的褐变程度逐渐增加,但总体来说,增加较为缓慢,反应7 d后褐变指数仍然较小,仅为0.228,这说明瓜尔豆胶酶解液与蛋清蛋白之间的美拉德反应仅为起始阶段或中间阶段。
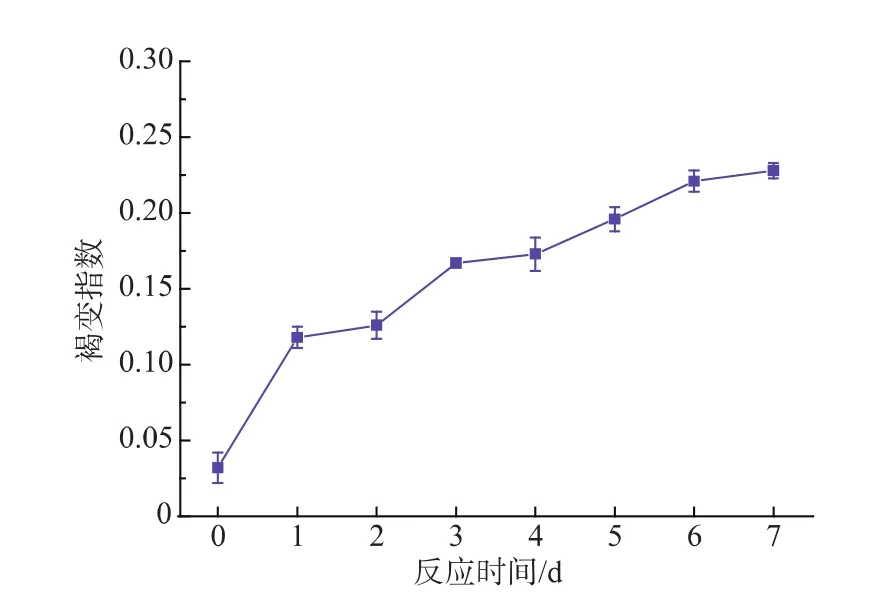
图9 改性蛋白粉的褐变指数随反应时间的变化Fig.9 Change of degree of browning of M-EWP with reaction time
2.7 接枝反应前后蛋白质氨基酸质量分数分析
在蛋白质与糖类接枝的过程中,氨基酸的含量会发生变化,通过测定接枝产物中氨基酸的组成可以初步判定美拉德反应的程度。此外,这对研究接枝反应前后蛋白粉的凝胶强度和持水性的变化也十分重要。实验对接枝反应前后的蛋白粉进行氨基酸含量的测定,结果以各种氨基酸占总氨基酸的质量分数表示,如表2所示。
通过氨基酸与糖的接枝反应,能够使蛋清蛋白质获得大量的羟基,从而增强蛋白质之间的氢键作用,吸附更多水分子,以强化蛋白的凝胶强度和持水性。接枝反应前后,蛋白粉中各种氨基酸均有不同程度的损失。由表2可知,丝氨酸、色氨酸、甲硫氨酸、赖氨酸和精氨酸发生明显减少。Guan[17]等人的研究表明,赖氨酸和精氨酸的侧链上存在自由氨基,可直接参与蛋白质与糖的接枝反应,故其相对含量减少。丝氨酸、色氨酸和甲硫氨酸的减少,原因尚不明确。但从实验结果来看,接枝反应后,赖氨酸并未出现大量损失,从而推测瓜尔豆胶酶解液中的糖组分与蛋白粉之间的美拉德反应处于一个有利的阶段,既能够有效改善蛋白粉的凝胶强度和持水性,又在很大程度上降低了接枝反应带来的营养损失,具有可观的实际应用价值。
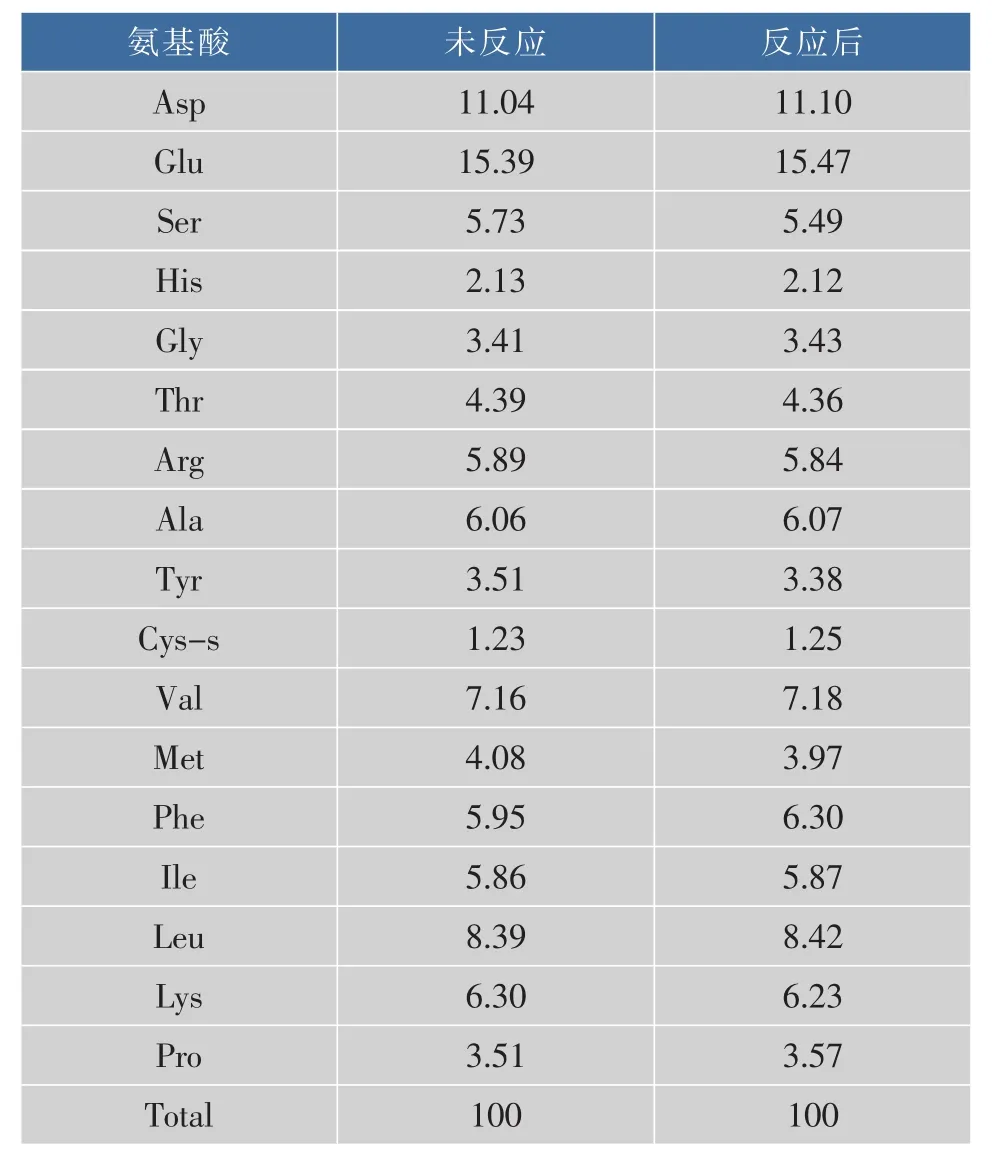
表2 接枝反应前后氨基酸质量分数分析Table 2 Content of different amino acid of EWP and MEWP %
2.8 SDS-PAGE分析
电泳图谱常被用来分析蛋白质的组成成分,通常用考马斯亮蓝染色来分析接枝产物中大分子糖链的接入[18]。实验利用SDS-PAGE对原蛋白粉和改性0、2、4、6 d的蛋白粉进行分析,结果如图10所示。
由图10可知,随着改性时间的延长,卵白蛋白和卵转铁蛋白的特征谱带的颜色在变浅,4、5、6条泳道在高相对分子质量区出现了连续谱带,且随着改性时间的延长而增多富集。这说明瓜尔豆胶酶解液中的糖组分在与蛋清蛋白接枝的过程中,随着反应的进行,逐渐生成了以共价键结合的相对分子质量较大的复合物,这也证实了美拉德反应的发生。
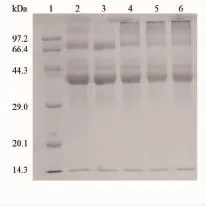
图10 原蛋白粉和改性蛋白粉的SDS-PAGE图谱Fig.10SDS-PAGE of EWP and M-EWP
2.9 凝胶扫描电镜分析
为了从微观结构上分析改性后蛋白粉凝胶强度增强的机理,实验对原蛋白粉和改性蛋白粉制备的凝胶进行了SEM分析,结果如图11所示。

图11 原蛋白粉和改性蛋白粉凝胶的微观结构图Fig.11 Scanning electron micrographs of EWP and MEWP
由图11可知,原蛋白粉所形成的凝胶网络结构松散,间隙较大,而改性蛋白粉所形成的凝胶结构较为均匀致密,且间隙较小。由此可以确定,糖基化反应有利于形成结构均匀致密的凝胶。研究表明,蛋白分子与糖共价结合后,疏水基团能增加分子间斥力,从而改变凝胶的网络结构。凝胶的持水性,弹性与其网络结构的致密程度及均一性呈正相关,凝胶网络结构越均匀致密,其凝胶性越好。基于此,可以有力证明瓜尔豆胶酶解液和蛋清蛋白之间的接枝反应能明显地改善蛋清蛋白的凝胶性能。
3 结语
利用瓜尔豆胶酶解液改性蛋清蛋白,在底物配比0.5%,pH值9.0,反应时间为4 d时,制备出的接枝产物的凝胶强度和持水性最大,比改性之前分别提高了359.54%和40.41%。改性4 d的蛋白粉在pH 4~10的范围内,都能保持较好的凝胶强度,且具有较好的储藏稳定性。在接枝反应过程中,体系中的游离氨基质量分数减少,各种不同氨基酸的质量分数减少,证实了美拉德反应的发生。SDS-PAGE分析得出,在接枝反应中生成了以共价键结合的相对分子质量较大的复合物。SEM也说明,蛋清蛋白结构的变化,能使之形成网络结构更均匀致密的凝胶。总之,利用瓜尔豆胶酶解液能有效地改善蛋清蛋白的凝胶性质,这一结论对于改性蛋白粉的加工和生产应用具有一定的指导意义。
致谢:本研究获得江苏省“食品安全与质量控制协同创新中心”产业发展项目资助,特此致谢!
