不同紫花苜蓿品种在均匀与不均匀 盐胁迫下的耐盐性评价
2018-09-18熊雪桂维阳刘沫含陈继辉张英俊
熊雪,桂维阳,刘沫含,陈继辉,张英俊,3,4*
(1.南京农业大学草业学院,江苏 南京 210095;2.河北民族师范学院,河北 承德 067000;3.中国农业大学 动物科技学院,北京 100193;4.农业部草地管理与合理利用重点实验室,北京 100193)
土壤盐分已经成为限制全球农业生产力的主要环境因素之一[1-2]。在全球的干旱和半干旱地区,约有50%的灌溉土地受到盐碱化的影响,区域内的非灌溉土地同样也会发生盐碱化[3]。在自然界中,由于降雨、灌溉、土壤淋溶、蒸发等多种因素的相互作用,导致土壤中的盐分分布存在空间和时间上的异质性[4-6],同一株植物的根系可能会处于不同的盐分浓度下[7]。目前关于植物品种耐盐性的研究都是在均匀的盐胁迫条件下进行的,而对于不均匀盐胁迫下品种耐盐性的比较研究未见报道。研究不均匀盐胁迫下不同品种的耐盐性是对植物耐盐性研究的一个重要补充,也为耐盐性品种的选育提供重要的参考依据。
紫花苜蓿(Medicagosativa)作为全球广泛种植的栽培牧草,素有“牧草之王”的美称[8],具有相对较强的耐盐性和改良土壤盐碱性的作用[9-10]。但不同的紫花苜蓿品种耐盐性相差较大,且不同盐碱条件下的同一品种耐盐性也存在差异[11-14]。在盐胁迫下各种耐盐机制在不同的品种中分别被激活,并产生相应的抗性反应。所以综合考虑盐胁迫下植物的光合作用效率、水分吸收、膜质过氧化程度等生理指标,可以作为品种耐盐性评估的重要参考依据[2]。本试验选取6个紫花苜蓿品种作为研究对象,分别在均匀盐胁迫和不均匀盐胁迫下测定其植株生长速率、地上生物量、地下生物量、水分吸收、电导率、丙二醛、叶绿素等指标,并通过隶属函数法对不同盐分处理下紫花苜蓿品种的耐盐性进行综合评价,以期为紫花苜蓿耐盐性评价及新品种选育提供科学的理论依据。
1 材料与方法
1.1 试验材料
试验所用6个紫花苜蓿品种分别为:中苜一号、阿尔冈金、WL353LH、WL298HQ、WL343HQ和WL354HQ,中苜一号由中国农业科学院畜牧研究所提供,其余品种购自北京正道生态科技有限公司。
1.2 材料培养与胁迫处理
选取均匀一致的紫花苜蓿种子用70%的乙醇清洗30 s,再用5%的次氯酸钠消毒15 min,后用蒸馏水反复冲洗4~5次,将整齐的种子播种于灭菌的湿砂中。7 d后待紫花苜蓿全部出苗,主根长度为3~5 cm时,选取整齐一致的幼苗,剪去根尖(5 mm)以促进其侧根生长,便于后面的分根试验。然后将幼苗置于营养液中进行水培(营养液浓度逐渐增大,至第10天为全浓度营养液)。每隔一天更换一次营养液,进一步培养4 d后取长势良好的幼苗移到分根装置中。营养液组成及浓度为:2.5 mmol·L-1Ca(NO3)2、2.5 mmol·L-1KNO3、1 mmol·L-1MgSO4、0.5 mmol·L-1NH4H2PO4、0.1 mmol·L-1EDTA-FeNa、0.2 μmol·L-1CuSO4、1 μmol·L-1ZnSO4、20 μmol·L-1H3BO3、0.005 μmol·L-1(NH4)6Mo27O4和1 μmol·L-1MnSO4。分根装置由两个0.35 L的塑料杯和一块中间带有圆孔的泡沫板组成,植物根系穿过圆孔固定于泡沫板上,将植物的根系分为均匀的两部分分别置于两个塑料杯中,以便使植物根系同时处于不同的盐分浓度处理下。
分根装置中培养5 d后,对各植物幼苗进行不同的盐浓度处理。试验共分为4个处理,包括对照0/0 mmol·L-1NaCl处理,不均匀盐胁迫0/200 mmol·L-1NaCl处理以及均匀盐胁迫100/100、200/200 mmol·L-1NaCl处理(“/”两边代表左右两端根系),每个处理8个重复。为避免盐分振荡,所有幼苗的盐分浓度均每隔24 h逐渐增加,直到4 d后达到最终浓度。试验于2017年6-8月在人工气候室中进行,光/暗周期为14 h/10 h,温度为白天25 ℃/夜晚20 ℃,空气相对湿度为白天55%/夜晚90%。
1.3 测定指标
1.3.1植物生长指标的测定 植物最终胁迫15 d后进行取样,分别取植物地上部分、左右两侧根系于105 ℃杀青30 min,在65 ℃烘箱中烘干48 h至恒重,分别测定其地上部分及两侧根系的干重。测量胁迫前及胁迫15 d后紫花苜蓿的主茎高度计算其生长速率,每个处理6次重复。
1.3.2水分吸收的测定 所有分根装置中的营养液体积均为350 mL,每次更换营养液及胁迫15 d后用量筒测量装置中的剩余营养液体积,并设置无植物培养的装置计算营养液蒸发量,最终计算得出植物水分吸收量,每个处理7次重复。
1.3.3生理指标的测定 采用Arnond[15]的丙酮提取法测定叶绿素(chlorophyll, Chl)含量;采用硫代巴比妥酸法测定丙二醛(malondialdehyde, MDA)含量[16];采用酸性茚三酮比色法测定脯氨酸(proline, Pro)含量[17]。采用电导率法测定细胞膜透性[16]。每个处理3次重复。
1.4 数据分析
采用SPSS 19.0对各指标的测定值进行方差分析。试验中采用相对值进行品种间的耐盐性比较,即各指标的测定值与对照的比值。利用隶属函数法[18]对各指标的相对值进行综合评价并对其耐盐性进行排序。
隶属函数分析方法如下:
Yij=(Xij-Xjmin)/(Xjmax-Xjmin)
(1)
Yij=1-(Xij-Xjmin)/(Xjmax-Xjmin)
(2)
式中:Yij为i品种j指标的隶属函数值;Xij为i品种j指标的均值;Xjmax为各品种j指标均值的最大值;Xjmin为各品种j指标均值的最小值。若j指标与抗盐性呈正相关,用公式(1);若j指标与抗盐性呈负相关,用公式(2)。
2 结果与分析
2.1 紫花苜蓿生长速率的变化
盐胁迫下,植株生长受到抑制。紫花苜蓿的植株生长速率不论在哪种盐胁迫处理下均呈下降趋势。不同品种同一浓度盐胁迫下植株生长速率表现不同,同一品种低盐胁迫和不均匀盐胁迫下与高盐胁迫下的植株生长速率表现也不同(表1)。用植株生长速率的相对值反映植物耐盐性的高低,植株的相对生长速率值越大则该品种越耐盐,相对生长速率值越小则越不耐盐。在3种浓度处理下中苜一号的相对生长速率均最高,表现出较强的耐盐性。在浓度为100/100和0/200 mmol·L-1NaCl处理下,WL353LH相对生长速率值最低,200/200 mmol·L-1NaCl处理下WL298HQ相对生长速率值最低,表现出较弱的耐盐性(表1)。
2.2 紫花苜蓿生物量的变化
盐胁迫下,植物地上生物量均呈下降趋势,盐胁迫对紫花苜蓿地上部分生物量的影响要大于对根系的影响。在浓度为100/100 mmol·L-1NaCl 处理下,品种WL353LH、WL298HQ和WL354HQ的地上生物量显著低于对照(P<0.05),而中苜一号、阿尔冈金和WL343HQ的地上生物量与对照无显著差异。当浓度达到200/200 mmol·L-1NaCl 时各品种的地上生物量均显著降低(P<0.05),其中对中苜一号的地上生物量影响最小,对WL298HQ的地上生物量影响最大。而在不均匀盐胁迫(0/200 mmol·L-1NaCl)下,中苜一号和WL354HQ的地上生物量与对照相比差异不显著,不均匀盐胁迫对阿尔冈金的地上生物量影响最大,表现出较低的耐盐性(表2)。

表1 不同盐胁迫下6个紫花苜蓿品种生长速率Table 1 The plant growth rates of six alfalfa varieties under different salt stress
注:同行不同小写字母表示各处理间差异显著(P<0.05)。下同。
Note: The different lowercase letters in the same line indicate significant differences between salt treatments(P<0.05). The same below.
相比地上部分,盐胁迫对地下生物量的影响较小。当盐胁迫浓度为100/100 mmol·L-1NaCl处理时,只有阿尔冈金和WL298HQ的地下生物量显著低于对照(P<0.05)。当盐浓度增加到200/200 mmol·L-1NaCl时,阿尔冈金、WL353LH、WL298HQ的地下生物量显著低于对照(P<0.05)。当紫花苜蓿各品种处于不均匀盐胁迫(0/200 mmol·L-1NaCl)处理时,只有阿尔冈金的地下生物量显著降低(P<0.05)(表2)。
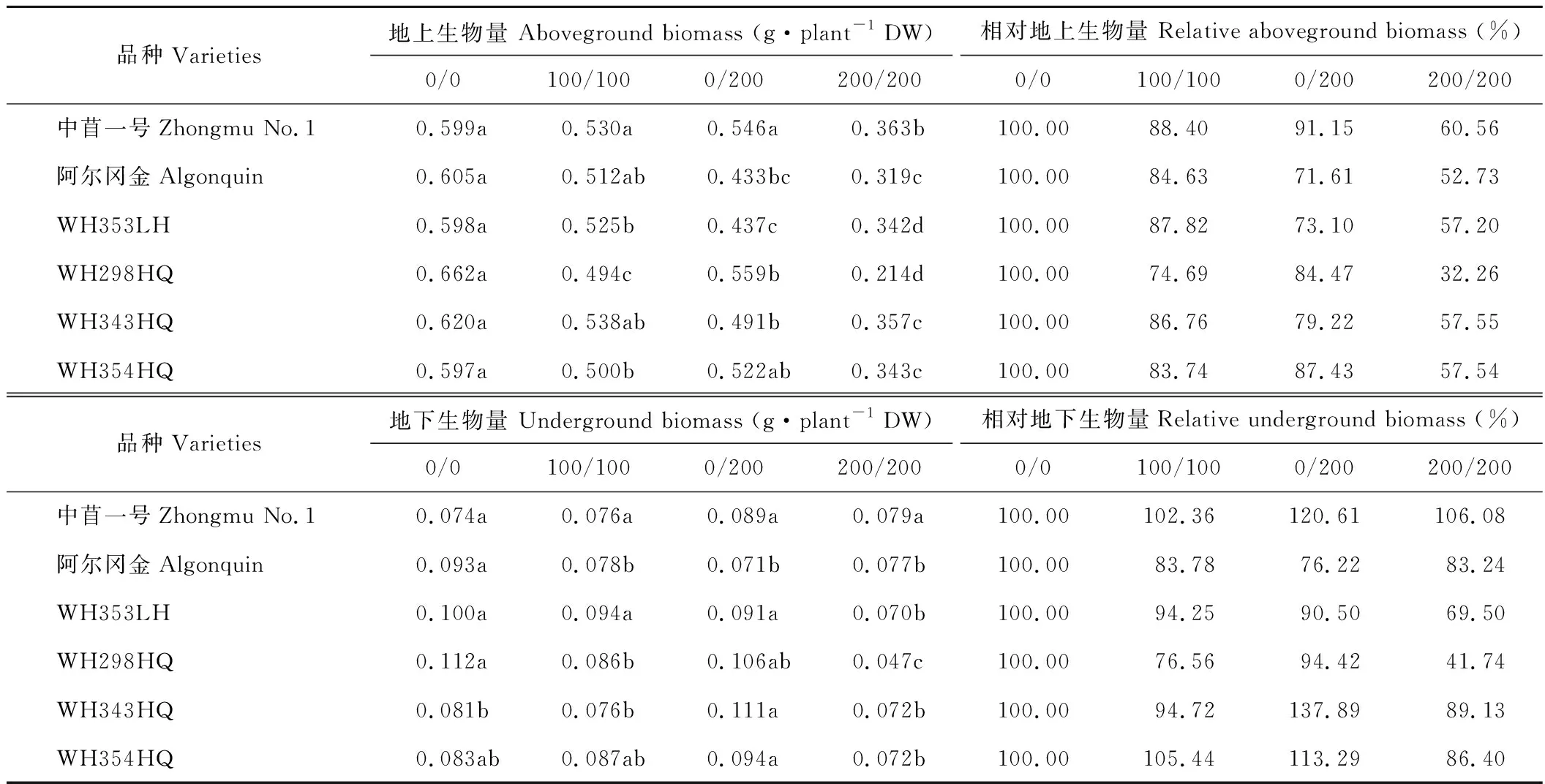
表2 不同盐胁迫下6个紫花苜蓿品种地上生物量和地下生物量Table 2 The aboveground biomass and underground biomass of six alfalfa cultivars under different salt stress
2.3 紫花苜蓿水分吸收的变化
本研究中,6个紫花苜蓿品种的水分吸收在均匀和不均匀的盐胁迫下均受到不同程度的抑制。在均匀的(100/100 mmol·L-1NaCl)处理下,除中苜一号外,其余5个品种的水分吸收量都显著降低(P<0.05)(表3)。根据其水分吸收的相对值变化可以得出,WL298HQ的水分吸收相对值最低,耐盐性较弱。而在200/200 mmol·L-1NaCl处理下,WL343HQ的水分吸收下降最大,表现出较弱的耐盐性。在不均匀盐胁迫(0/200 mmol·L-1NaCl)处理下,中苜一号和WL354HQ的水分吸收量与对照差异不显著,耐盐性较强,阿尔冈金的水分吸收相对值最小,耐盐性较弱(表3)。此外,在不均匀盐胁迫下紫花苜蓿各品种83%~91%的水分吸收来自无盐胁迫处理一端,且显著高于0/0处理一端的水分吸收量。

表3 不同盐胁迫下6个紫花苜蓿品种水分吸收Table 3 The water uptake of six alfalfa cultivars under different salt stress
2.4 紫花苜蓿细胞膜透性的变化
紫花苜蓿在均匀和不均匀的盐胁迫下,细胞膜均受到一定程度的伤害。与对照相比,各品种在几种盐分浓度下电导率均显著增加(P<0.05),细胞膜透性增大(表4)。在盐胁迫下,电导率的相对值增加越大,证明细胞膜受到的伤害越严重,植物的耐盐性越差。相比之下,在100/100 mmol·L-1NaCl处理下,中苜一号和WL354HQ的耐盐性稍强,WL298HQ和WL353LH的耐盐性较弱。当盐分浓度达到200/200 mmol·L-1NaCl时,WL354HQ和WL343HQ的耐盐性稍强,阿尔冈金的耐盐性较弱。而在不均匀盐胁迫(0/200 mmol·L-1NaCl)处理下,中苜一号和WL354HQ的耐盐性稍强,阿尔冈金和WL353LH的耐盐性较弱(表4)。

表4 不同盐胁迫下6个紫花苜蓿品种细胞膜透性Table 4 The cell membrane permeability of six alfalfa cultivars under different salt stress
2.5 紫花苜蓿膜质过氧化的变化
MDA是细胞膜质过氧化的产物,可以反映植物受到逆境胁迫伤害的程度。在均匀和不均匀盐胁迫下,6个紫花苜蓿品种的MDA含量均显著增加(P<0.05)。其中中苜一号在3种盐浓度处理下MDA含量的变化相对较小,表现出较强的耐盐性。在均匀盐胁迫(100/100和200/200 mmol·L-1NaCl)处理下,WL298HQ的MDA含量增加相对较大,耐盐性较差。而在不均匀盐胁迫(0/200 mmol·L-1NaCl)处理下,阿尔冈金的细胞膜质过氧化程度最大,表现出较低的耐盐性(表5)。
2.6 紫花苜蓿叶绿素含量的变化
盐胁迫下植物的光合作用受到抑制,叶绿素含量随着盐胁迫浓度的增加而降低。在均匀盐胁迫(100/100 mmol·L-1NaCl)处理下,与对照相比,中苜一号和WL353LH的叶绿素含量变化不显著,其余品种叶绿素含量均显著降低(P<0.05)。中苜一号和WL353LH的叶绿素含量相对值较高,表现出较强的耐盐性,WL343HQ的耐盐性相对较弱。当盐胁迫浓度增加为200/200 mmol·L-1NaCl时,6个紫花苜蓿品种的叶绿素含量均显著降低(P<0.05)。其中阿尔冈金的叶绿素含量下降最大,说明其在该浓度下光合作用受到严重抑制,耐盐性较弱。在不均匀盐胁迫(0/200 mmol·L-1NaCl)处理下,WL298HQ的耐盐性相对较强,阿尔冈金的耐盐性较弱(表6)。

表5 不同盐胁迫下6个紫花苜蓿品种丙二醛含量Table 5 The MDA contents of six alfalfa cultivars under different salt stress
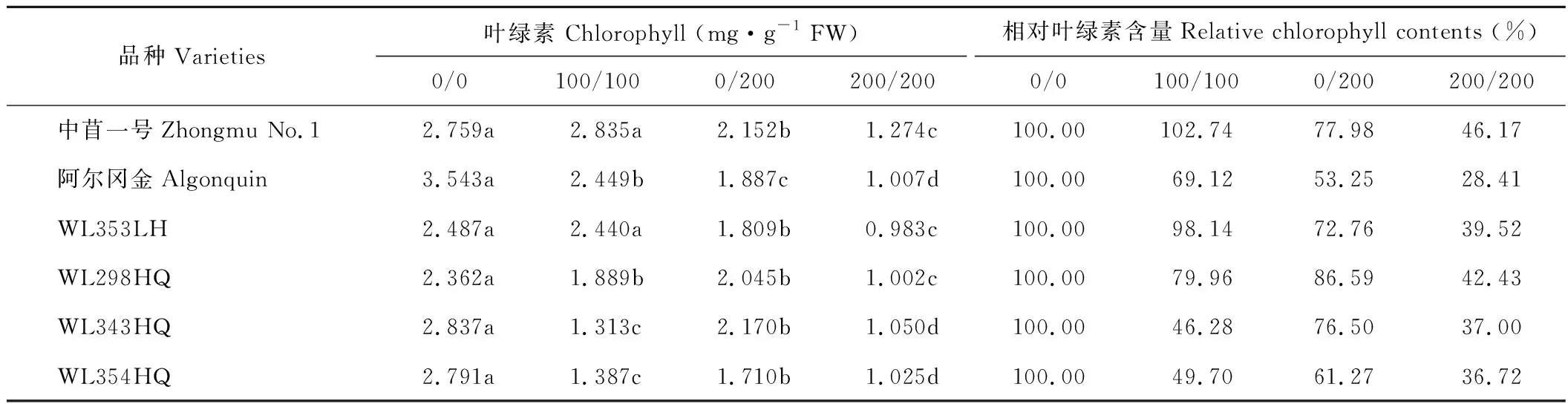
表6 不同盐胁迫下6个紫花苜蓿品种叶绿素含量Table 6 The chlorophyll contents of six alfalfa cultivars under different salt stress
2.7 紫花苜蓿脯氨酸含量的变化
Pro作为渗透调节剂参与盐胁迫下植物的渗透调节。但是目前关于Pro含量与植物耐盐性的关系一直存在争议[18-20]。本研究中盐胁迫对6个紫花苜蓿品种的Pro含量影响均较大,在受到盐胁迫后各品种均显著增加(P<0.05)。但各品种的Pro含量与耐盐性表现存在一定的不一致性,并不是Pro的含量越高,品种在盐胁迫下的生长越好(表7)。所以不能明确Pro含量与植物抗盐性的关系。
2.8 紫花苜蓿各品种耐盐性综合评价
因为Pro含量与植物耐盐性的关系存在不一致性, 不计算其隶属函数值。 本研究选取各盐分浓度下植株生长速率、地上和地下生物量、水分吸收、电导率、MDA和叶绿素含量变化的相对值作为耐盐性综合评价的指标。经相关性分析得出各指标与植物耐盐性的正负相关关系,各性状的相关性均达到了显著或极显著水平(表8)。通过隶属函数法分别计算均匀盐胁迫(100/100、200/200 mmol·L-1NaCl)和不均匀盐胁迫(0/200 mmol·L-1NaCl)下的隶属度平均值,并进行排序。结果得出在100/100 mmol·L-1NaCl处理下,6个紫花苜蓿品种的耐盐性为中苜一号>WL354HQ>WL343HQ >WL353LH>阿尔冈金>WL298HQ(表9)。0/200 mmol·L-1NaCl处理下耐盐性为中苜一号>WL354HQ>WL298HQ>WL343HQ>WL353LH>阿尔冈金(表10)。200/200 mmol·L-1NaCl处理下耐盐性为中苜一号>WL354HQ>WL343HQ>WL353LH>阿尔冈金>WL298HQ(表11)。
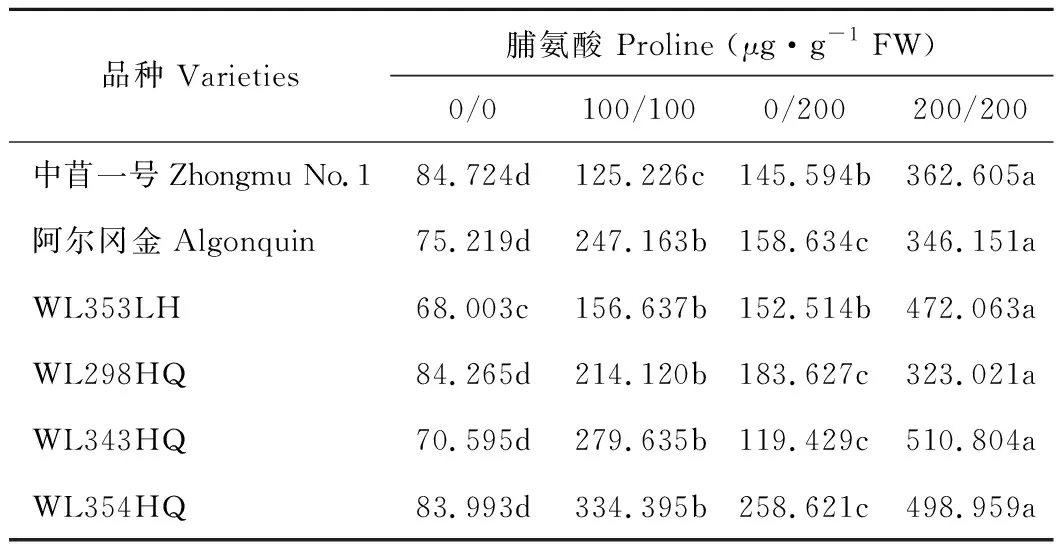
表7 不同盐胁迫下6个紫花苜蓿品种脯氨酸含量Table 7 The proline contents of six alfalfa cultivars under different salt stress
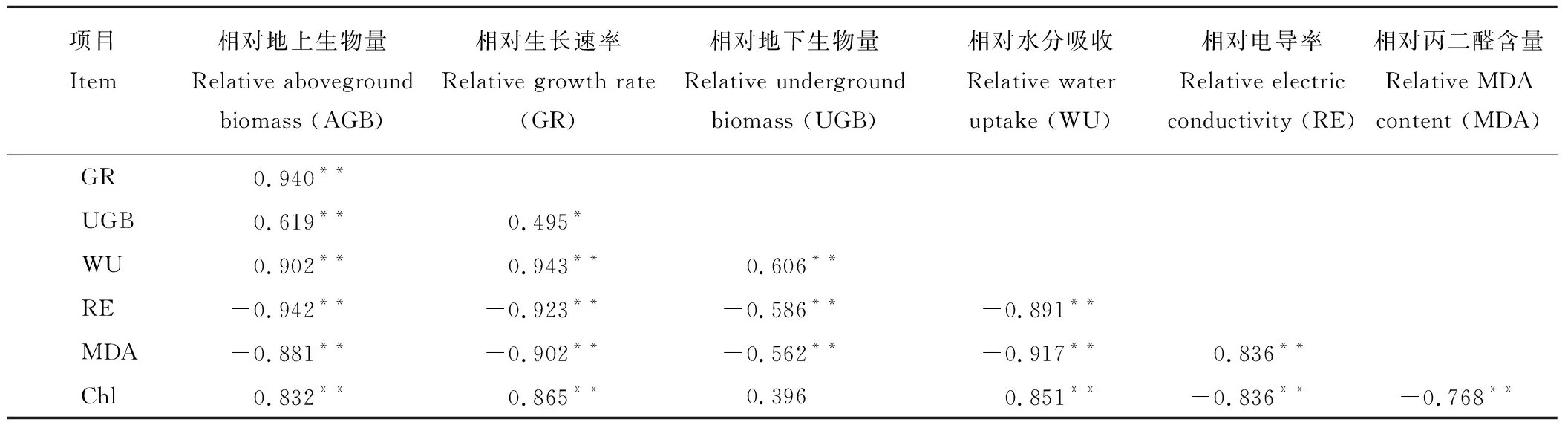
表8 相对值相关性分析Table 8 Correlation analysis of relative values
注:*表示各相对值的显著性关系:*P<0.05,**P<0.01,***P≤0.001。Chl: 相对叶绿素含量。
Note:Correlations are significant at *P<0.05, **P<0.01, ***P≤0.001. Chl: Relative chlorophyll contents.

表9 不同紫花苜蓿品种在100/100 mmol·L-1盐胁迫下耐盐性综合评价Table 9 Comprehensive evaluation of salt tolerance of alfalfa varieties under 100/100 mmol·L-1 salt stress

表10 不同紫花苜蓿品种在0/200 mmol·L-1 盐胁迫下耐盐性综合评价Table 10 Comprehensive evaluation of salt tolerance of alfalfa varieties under 0/200 mmol·L-1 salt stress
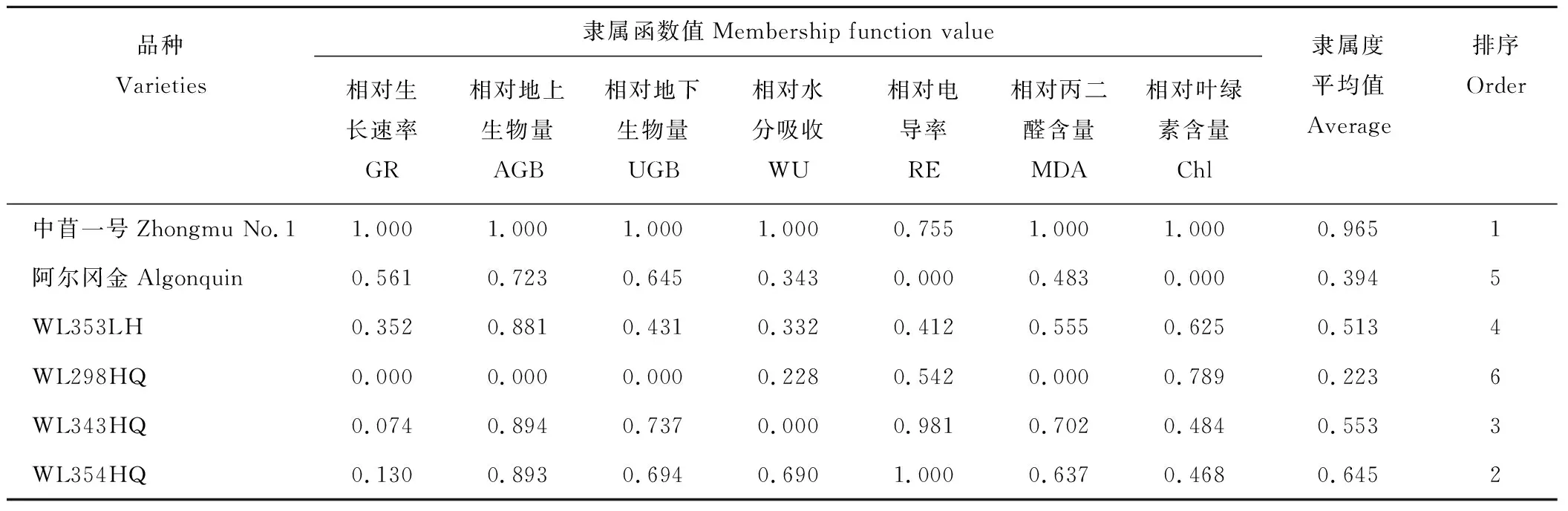
表11 不同紫花苜蓿品种在200/200 mmol·L-1 盐胁迫下耐盐性综合评价Table 11 Comprehensive evaluation of salt tolerance of alfalfa varieties under 200/200 mmol·L-1 salt stress
3 讨论
评价植物的耐盐性通常包括直接测定和间接测定两种方法。直接指标的测定包括植株生长速率、生物量、存活率等,本研究中紫花苜蓿在盐胁迫(均匀、不均匀)处理下植株生长速率、生物量等均呈降低趋势,这些指标的相对变化情况可以直接反映出植物对盐胁迫的抗性强弱[21]。这也是其他品种比较试验中常用的耐盐性评价指标[11-13]。
间接测定一般利用一些生理生化指标作为耐盐性的鉴定指标,如水分吸收、电导率、MDA、叶绿素、抗氧化物质等[22-23]。当盐分存在于植物根际时会降低土壤渗透势,导致植物吸水困难,形成生理干旱,进而抑制生长[24]。已有的研究发现,当植物处于不均匀的盐胁迫下,低盐或无盐一端的补偿吸水作用对于促进植物不均匀盐胁迫下的生长具有重要作用[7,25]。因此将水分吸收情况作为评价植物耐盐性,特别是在不均匀盐胁迫下耐盐性的重要指标。植物细胞膜对维持细胞的微环境和正常代谢起着重要作用。相对电导率可以反映植物细胞膜受到伤害的程度,相对电导率越大,细胞膜透性增强,说明植物细胞受到的伤害越大。而膜透性增大的程度也取决于植物抗逆性的强弱[26]。王运琦等[27]研究表明细胞质膜透性可以作为紫花苜蓿耐盐性评价的指标之一。另外,MDA作为细胞膜质过氧化产物同样可以反映植物细胞膜受伤害程度,作为植物耐盐性强弱的指标之一[21,28]。叶绿素作为植物体内重要的光合物质反映植物光合作用的强弱,盐胁迫会降低植物叶片中的叶绿素含量进而影响植物的生长发育[29-30]。在盐胁迫下维持植物叶片较高的叶绿素含量可以增强耐盐能力[31]。刘晶等[18]对两个紫花苜蓿品种耐盐性的比较研究也得出植物的MDA和叶绿素含量与盐害的结果相对应。本研究中,紫花苜蓿各品种的水分吸收、电导率、MDA和叶绿素含量与耐盐性存在显著的相关性,可以作为耐盐性的评价指标。Pro作为逆境胁迫下的渗透调节物质在盐胁迫下研究得较多,但是关于Pro是否可以作为耐盐性判定的指标存在不同的意见。王玉祥等[32]对苜蓿的研究发现,在盐胁迫下Pro积累的含量越多,说明植物体耐盐性越强,可以将Pro作为植物抗盐性的评价指标之一。而本研究发现,随着盐胁迫浓度的增加,Pro含量显著上升,但是各品种的Pro含量与耐盐性表现存在不一致性,刘晶等[18]的研究也得出了相同的结论。还有学者认为Pro积累的快慢可以体现植物对盐胁迫反应的敏感程度,但其含量的高低不能反映植物的耐盐程度[33]。因此Pro含量与植物耐盐性的关系还需要进一步的验证。
植物在受到盐胁迫后会产生一系列的复杂机制来抵抗盐害,不同测定指标下6个紫花苜蓿品种的耐盐性存在一定的差异,因此利用多种指标进行综合评价,能更好地反映植物耐盐性的强弱。研究发现,中苜一号无论在哪种盐胁迫处理下均表现出较强的耐盐性,而阿尔冈金的耐盐性较弱,特别是在不均匀盐胁迫下,其水分吸收、光合作用受到抑制,细胞膜透性增加,进而引起生物量降低,属于盐分敏感品种。此外,品种WL298HQ在均匀和不均匀盐胁迫下的耐盐性差异较大,在均匀盐胁迫下细胞膜受到氧化损伤,植株生长速率和生物量降低,表现出较低的耐盐性。而在不均匀盐胁迫下,WL298HQ耐盐性中等,可能由于不均匀盐胁迫下该品种的某一耐性机制保护了植物细胞膜免受损伤,提高了生长速率和生物量。值得注意的是,在0/200 mmol·L-1NaCl处理下,WL298HQ具有相对较高的水分吸收含量和地下生物量,根据前人关于不均匀盐胁迫对植物影响的研究[7],认为无盐一端根的补偿性生长和补偿吸水作用可能在其不均匀盐胁迫下提高耐盐性中发挥重要作用。可以推断WL298HQ在均匀和不均匀盐胁迫下的耐盐机制不同,在今后的研究中值得深入探讨。
4 结论
不论在哪种盐胁迫(均匀、不均匀)处理下,各紫花苜蓿品种均表现为生长速率下降,地上、地下生物量降低,水分吸收和叶绿素含量减少,膜透性、MDA和Pro含量增加,盐胁迫抑制了植物生长,且各指标存在品种差异。通过对各个指标进行综合评价得出,均匀和不均匀盐胁迫下各品种的耐盐性不同,在均匀盐胁迫(100 mmol·L-1和200 mmol·L-1NaCl)处理下各品种的耐盐性为中苜一号>WL354HQ>WL343HQ>WL353LH>阿尔冈金>WL298HQ,而在不均匀盐胁迫(0/200 mmol·L-1NaCl)处理下则为中苜一号>WL354HQ>WL298HQ>WL343HQ>WL353LH>阿尔冈金。中苜一号在不同盐胁迫处理下均表现出较高的耐盐性,而阿尔冈金耐盐性较差,WL298HQ在均匀与不均匀盐胁迫下的耐盐性差异较大,其他品种的耐盐性居中。
