骨骼肌血管合成蛋白VEGF的调控通路研究综述
2018-09-18杨小月陈建明刘小龙林家仕
杨小月,陈建明,刘小龙,张 娟,林家仕
(集美大学体育学院,福建 厦门361021)
运动作为一种生理刺激,会导致骨骼肌内部物质发生适应性改变,如线粒体生物合成和血管增生等。大量的研究表明过氧化物酶体增殖物受体γ共激活因子1a(Peroxisome proliferators-activated reptorγ coactivator-1a,PGC-1a)是调控线粒体生物合成的核心因子,对其上下游调控因子的研究也比较成熟。上游主要调控因子为腺苷酸活化蛋白激酶(AMPK)[1]、p38丝裂原活化蛋白激酶(p38MAPK)[2]、钙调蛋白激酶II(CaMKII)[3]等;下游主要调控因子为核呼吸因子1(NRF1)、核呼吸因子2(NRF2)等[4]。线粒体生物合成依赖血管为其提供氧气和能源物质,但是目前对骨骼肌血管合成的研究相对较少,尤其是与VEGF相关的具体通路方面。近年来,大量流行病学调查和干预性研究表明,心肺耐力 (cardiorespiratory fitness,CRF)是预测心血管和代谢性疾病风险(血压、血脂、 血糖、肥胖)的独立因素,CRF水平越高越有利于降低疾病风险[6]。由于骨骼肌血管合成对CRF的提高具有重要作用,因此,研究运动诱导骨骼肌血管合成适应将有可能成为揭示高水平的CRF改善代谢性疾病风险因素这一重要理论的关键突破口。大量文献普遍认为VEGF是促进骨骼肌血管合成的核心的因子,但却未见其相关的调控通路研究的文献综述。为此,本文对四条主要通过VEGF调控骨骼肌血管合成的通路的研究成果进行综述,旨在为后来研究者提供理论依据和研究思路。
1 VEGF与骨骼肌血管合成
参与骨骼肌血管合成因子很多,如成纤维细胞生长因子2(FGF-2),它是一种强烈的分裂素,作用于内皮细胞、平滑肌细胞和纤维母细胞,可以上调VEGF和一氧化氮(NO)产物[7,8,9]。其他参与血管合成的细胞因子包括血小板源性生长因子和转化生长因子、基质金属蛋白酶类、血纤维蛋白溶酶原、尿激酶、组织纤溶酶原激活物等。这些因子无故溶解将导致结构完整性消失,微血管功能也将丧失,最终将影响骨骼肌血管合成[10]。
血管合成被多条促血管新生因子所调控,同时也被调节毛细血管生成和复原的因子所调控[11,12]。在骨骼肌中,维持血管生成和毛细血管生长的最重要因子是VEGF[13,14,15],被认为是调控骨骼肌血管合成的核心因子。目前我们知道VEGF和其他促血管生长因子过程最初来源于鉴定抽芽式血管合成实验,而且主要是在骨骼肌中进行[16]。肌肉收缩时,储存于囊泡中的VEGF被分泌至小间隙[17],作用于血管内皮细胞的VEGF受体,通过与其受体VEGFR2结合促进骨骼肌血管合成[18]。也有研究表明,当VEGF浓度较低时,骨骼肌中毛细血管与纤维比率将下降[19,20]。所以VEGF与其受体对骨骼肌血管合成作用突出。
2 不同运动方式与VEGF表达
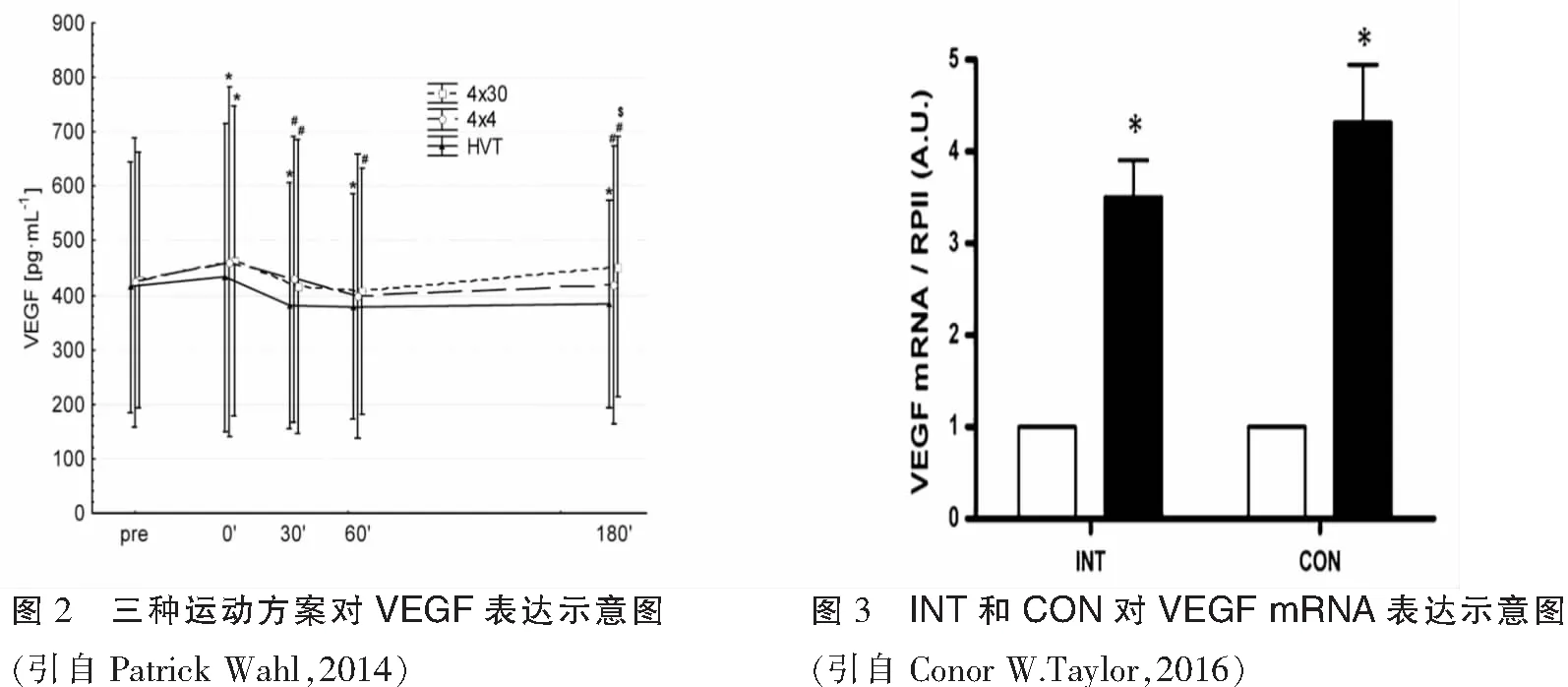
不同运动方式可上调骨骼肌中的VEGFmRNA和蛋白表达。运动方式可分为一次急性运动和长期运动。一次急性运动包括间歇训练(HIT)[21]、持续性训练(CONT)[22]以及抗阻训练(RE)[23]等;长期运动干预包括到日常体力活动[24]和有氧训练[25]等。1996年,Breen EC等对老鼠肌肉刺激模拟肌肉运动即刻后,VEGF mRNA上调了2~4倍,在随后的4 h也有所增加,8 h后恢复到安静状态下水平,同时VEGF蛋白增加和其mRNA增加一致[26]。2008年,Riikka Kivelä等对48只老鼠进行一次性跑台运动实验,运动后6小时,VEGF-A及其受体VEGFR-2mRNA分别增加了25 %和29 %,VEGF-B增加了15%(P=0.05)(如图1),表明一次性运动可有效促进老鼠骨骼肌VEGF mRNA表达[27]。2014年,Patrick Wahl等对12名受试者进行三种运动方案,试验分别是130 min 55 %最大输出功率(PPO)、4x4min95%PPO和4x30s 全力(all-out),发现三种运动后VEGF mRNA明显上升,在运动后30分期间逐渐减少至运动前水平,表明运动均可上调VEGF(如图2),但是该实验并没有控制运动时间变量[28]。2016年,Conor W.Taylor等控制运动时间对8名运动员进行HIT(4x30s最大冲刺,间歇4min)和CON(120 s最大冲刺)实验,运动3小时后发现VEGF mRNA显著升高,分别提高了3.5倍和4.3倍(P=0.02)(如图3),表明运动方式对VEGF mRNA表达影响甚大[29]。

图1 一次性运动对VEGF mRNA和其受体表达示意图(引自Kivelä R,2008)
上述对运动方式的分析中,发现不同运动方式、运动强度、运动时间、受试对象等的差异,造成运动后VEGF提高的幅度不一样。目前,大多研究表明HIIT比CON运动方式对人体的生理刺激更大,运动后VEGF提高的幅度应该更大,然而Conor W.Taylor等的研究出现相反的结果:CON(120s最大冲刺)比HIIT(4x30s最大冲刺,间歇4min)提高VEGF mRNA的幅度更大(~4.3 VS ~3.5倍,P = 0.02)。经过比较两种运动方案分析得出,可能是HIIT的间歇时间过长,虽然控制了运动的时间,但整个运动方案总时间不相等,后者明显比前者时间更长,这可能是造成HIIT提高VEGF的幅度不如CON的主要原因。另外,骨骼肌能量摄取速率具有强度依赖性,尤其在以有氧代谢为主的运动中,强度对加速骨骼肌血管合成速度起至关重要的作用[30]。因此,不同运动强度下,信号传导通路中关键节点酶的活性必然会随强度变化而变化,从而造成VEGF提高的幅度差异。人体实验和动物实验的受试对象也存在较大差异,人体实验受试者的心理和生活条件控制相对较难,而动物大多生活在统一饲养的动物房,生活条件容易把控。不同的运动方式均可上调VEGF mRNA和蛋白,但是其中的调节通路尚不清楚,因此研究运动对骨骼肌血管合成蛋白VEGF的调控通路意义重大。
3 运动对骨骼肌血管合成蛋白VEGF的调控通路
运动对骨骼肌血管合成蛋白VEGF的调控通路主要分两大组,即促进组和抑制组。促进组包含运动通过PGC-1家族( PGC-1s)和低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)调控通路;抑制组包含运动通过凝血酶敏感蛋白-1(thrombospondin-1,TSP-1)和金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)调控通路。
3.1 运动通过PGC-1s调控骨骼肌血管合成
PGC-1s调控不同组织的代谢功能[31],其家族由PGC-1a、PGC-1β和PRC组成。这三个转录调控者自身没有调控活性,但是可以结合DNA转录因子促进线粒体生物合成、脂肪酸氧化、控制糖异生、血管生成等[32]。
PGC-1s在调控运动促进骨骼肌血管合成中发挥重要作用。2008年,Zoltan Arany等提出PGC-1a诱导雌激素相关受体a(ERRa)促进VEGF表达,从而增强老鼠骨骼肌的血管合成,并且指出该通路与低氧诱导HIF-1通路独立。文中引出了原本控制线粒体生物合成的因子PGC-1a和ERRa也参与血管合成的表达,但是并没有通过实验完全证明两者与VEGF绝对相关[33]。直到2009年,Chinsomboon J等通过实验证明了PGC-1a和ERRa与VEGF具有正相关性,并且首次较为完整地提出了运动促进骨骼肌血管合成的通路,即β肾上腺素-PGC-1a-ERRa-VEGF轴。通过分别给老鼠注入生理盐水(10mg/kg)和propranolol (10mg/kg,一种肾上腺素受体抑制剂),16小时自由运动后发现注入生理盐水组的老鼠股四头肌的PGC-1a和VEGF表达被强烈诱导,相反注入propranolol老鼠组被明显抑制,证明了β肾上腺素调节运动诱导的PGC-1a和VEGF(如图4)。为了继续观察PGC-1a是否调节肾上腺素对VEGF的诱导,给PGC-1a敲除的和野生型老鼠注入clenbuterol(一种肾上腺素受体激动剂),6h后取股四头肌发现clenbuterol使野生型老鼠的VEGF表达增加了~2.5倍(p<0.05),而敲除PGC-1a组的VEGF没有被诱导,证明了β肾上腺素调节运动诱导VEGF表达需通过PGC-1a(如图5)。通过敲除ERRα实验证明了PGC-1a调控VEGF需通过ERRa(如图6)[34]。此后2011年,Rowe GC等提出PGC-1β(PGC-1β被确定为PGC-1a的同源体[35],N端激活区域的40%和C端RNA结合区域的48%,许多功能与PGC-1a相似,包括线粒体程序的激活[36]),通过诱导VEGF表达以促进骨骼肌血管合成,这个过程中需要ERRa的参与,并且独立于HIF-1调控途径。在联合实验中,骨骼肌细胞PGC-1β过表达依赖VEGF,可增加邻近内皮细胞的迁移和骨骼肌血管密度,丰富了PGC-1s调控骨骼肌血管合成的体系,同时从侧面证明了PGC-1s对骨骼肌血管合成的关系非常密切。
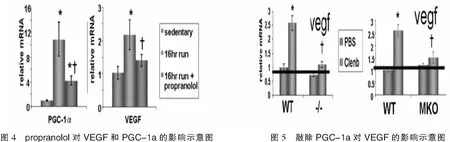

图6 敲除ERRa后运动对VEGF的影响示意图
值得一提的是,PGC-1a亚基可精确调控运动对骨骼肌血管合成的途径。2014年,Thom R等对PGC-1a的两个特殊亚基进行研究指出:编码PGC-1a的特殊结构为NT-PGC-1a和PGC-1a4,前者强烈地诱导VEGF表达,促进内皮细胞迁移和肌管形成,从而使骨骼肌血管增加,然而对线粒体基因没有影响;后者转基因表达也可诱导骨骼肌血管合成。并且通过敲除NT-PGC-1a和PGC-1a4以及HIF-1a后,VEGF对低氧没有反应,表明以上两个亚基参与了PGC-1a调控的骨骼肌低氧反应[36]。但是并没有说明运动也是通过NT-PGC-1a和PGC-1a4两个亚基发挥调控作用,因为PGC-1a亚基包括PGC-1a-a、PGC-1a-b、PGC-1a-c、NT-PGC-1a、PGC-1a4。运动到底通过以上亚基的两种或几种促进血管合成,我们尚不清楚;此外,哪种强度对骨骼肌血管合成影响最大,是强度越大合成速率就越大的正相关性关系?还是中等强度越大,随后逐渐减少?我们不得而知,还有待今后进一步研究。
3.2 运动通过HIF-1调控骨骼肌血管合成
HIF-1有两种亚基其中HIF-1a被认为是分子氧气感应器。当氧气充足时,持续合成的蛋白会被降解,但是当氧气不足时,HIF-1a就会被堆积。此外,HIF-1的另一种亚基是HIF-1β,可结合HIF-1a形成HIF-1,具有消炎、血管合成、脂肪合成、细胞内外基质重塑等功能[37]。
目前缺血和缺氧均可激活PGC-1a和HIF-1表达,从而促进骨骼肌血管合成。运动通过PGC-1a可促进血管合成,但是运动是否通过HIF-1也有如此作用?2004年,Mason SD等通过敲除HIF-1a后,发现老鼠的运动时间相比野生型低,从糖酵解供能到有氧供能时间延长,而且重复运动使敲除老鼠组肌肉损害[38]。这种现象在人体中也观察到,表明HIF-1在肌肉供能的代谢控制中具有重要作用。2008年Zoltan Arany等研究报道缺氧激活了HIF-1a和HIF-2a以促进VEGF表达,从而促进血管合成[33]。而且通过敲除PGC-1a或敲除HIF-1亚基实验证明了该途径不经过PGC-1a。从缺氧状态下表明,PGC-1a和HIF-1a为两条不同促进骨骼肌血管合成的通路,但是在运动状态下是否通过HIF-1a调控骨骼肌血管合成?2014年,Paula Rodriguez-Miguelez等通过对24只老鼠进行离心运动实验,发现离心运动促进没经过训练的骨骼肌HIF-1a和VEGF表达增加,但是长期运动后此表达程度减缓[39]。证明了HIF-1a确实参与运动促进骨骼肌血管合成中,还指出VEGF通过激活内皮型一氧化氮合酶(eNOS)产生NO,而NO又促进HIF-1a表达,最终增强VEGF表达,形成一个正反馈调控环。从文中可以总结出短暂的运动可以促进HIF-1a和VEGF等促血管合成因子的表达,而且提出NO参与调控过程的看法,但是没有证明其通路的顺序,是运动激活eNOS产生NO,调控HIF-1a和VEGF,最终促进骨骼肌血管合成?还是运动先促进HIF-1a和VEGF表达,VEGF激活eNOS产生NO,从而再回头促进前者基因表达从而增强骨骼肌血管合成?其中的通路我们尚不清楚。
3.3 运动通过TSP-1和TIMP-1抑制VEGF表达
TSP-1是一种基质细胞糖蛋白,首次在激活的血小板中发现,是TSP家族中研究最多的蛋白。TSP家族有五种蛋白:TSP-1、TSP-2、TSP-3、TSP-4、TSP-5,其中TSP-1和TSP-2结构相似。很多正常细胞分泌TSP-1,如内皮细胞、纤维母细胞、脂肪细胞、平滑肌细胞、单核细胞、巨噬细胞和转化细胞(恶心胶质瘤细胞)。研究表明,TSP-1对于毛细血管生成调节很重要,被认为可抑制血管生成[40]。敲除TSP-1的老鼠,血管生成相比野生型老鼠更高,表明TSP-1抑制血管生成。而TIMP-1,一种血管生成复合物,对骨骼肌的毛细血管合成调节也相当重要,其发生机制可能是通过矩形金属蛋白(MMPs)以促进细胞外基质的退化,进而间接限制毛细血管生长。也有研究显示,TIMP-1表达对肌肉活动很敏感,短暂的运动将增加TIMP-1mRNA浓度,从而抑制VEGF表达[41]。
4 小结
综上所述,运动主要通过四条通路调控骨骼肌血管合成:PGC-1a-VEGF通路、HIF-1a-VEGF通路、TSP-1-VEGF通路和TIMP-1-VEGF通路。其中PGC-1a-VEGF通路尤为重要,可能影响其他三条通路的调控作用。若需解决上述关于是否存在起主导作用的信号通路的问题,则需要从较高层次或全新的视角提出几点假说:1)VEGF表达虽是上述四条信号转导通路共同作用的结果,但仍存在着起主导作用的信号转导通路;2) 从动态的剂量(效应理论角度分析运动促进骨骼肌血管合成中重要的调控因子之间的相互作用也许大有裨益;3)运动对信号通路网络的激活应该是全面的,VEGF一定存在着对变量(运动强度和时间)大小的最佳范围。
