毛竹根际2株溶磷解钾促生细菌的筛选鉴定
2018-09-14郭春兰陈伏生吴小芹桂许维严无暇
张 扬,郭春兰,陈伏生,吴小芹,桂许维,严无暇
(1.南京林业大学 南方现代林业协同创新中心/林学院,江苏 南京 210037;2.江西农业大学 江西特色林木资源培育与利用2011协同创新中心,江西 南昌 330045)
毛竹(Phyllostachysedulis)为禾本科竹亚科的高大乔木,已成为农林产业结构调整、林业增效、林农增收的主要经济林种[1]。目前毛竹林经营大都以粗放型为主,长期的不合理经营导致毛竹林地土壤贫瘠,磷钾等营养元素缺乏[2],而磷、钾作为植物必需的营养元素,是其生长发育的物质基础,然而在我国南方土壤中磷主要以难溶性磷酸盐的形式存在,钾主要以矿物形态存在于钾长石中,不能被直接吸收和利用[3]。因此如何将土壤中难溶性磷、钾转化为供毛竹直接吸收的可溶性磷、钾目前倍受关注[4]。随着国家对生态环境的重视和人们对无公害食品的需求加剧,化学肥料带来污染竹林生态环境、土壤板结等一系列问题日益突出,应用微生物制剂来替代部分化肥逐渐成为研究热点。
根际促生细菌(plant growth promoting rhizobacteria,PGPR)作为生长在植物根际土壤的微生物,具有促进植物生长、提高植物抗性等功能[5-6]。研究表明,PGPR在对提高小麦、大豆及玉米等农作物的促生方面有着良好效果[7],在林业上的应用研究也渐为热点。魏伟等[8]从马尾松根际筛选出2株优良PGPR菌株,能显著的促进马尾松苗生长,尤其对根系质量促生效果显著。Zeng等[9]对杨树实生苗施用PGPR菌剂JW-SD2,显著的促进了杨树的生长。然而目前关于毛竹PGPR菌株方面的研究还较少,仅有韩烁从毛竹根际土壤中筛选解磷细菌并对其多样性进行了初步分析[10]。因此,本研究从毛竹根际土壤中筛选具有溶磷解钾及产生IAA的根际促生菌,并通过盆栽试验验证其促生效应;通过拮抗试验验证其对毛竹枯梢病病原菌竹喙球菌(Ceratosphaeriaphyllostachydis)有无拮抗作用。对促进毛竹健康生长及提高竹林生产力提高具有重要意义,更为开发毛竹生长相关生物制剂提供菌株资源。
1 材料与方法
1.1 供试材料
1.1.1 样品采集 分别在江西省井冈山大井林场、宜春市官山林场和大港林场毛竹标准样地中选取长势良好的3度竹,铲去表土,将黏附在毛竹根系上的根际土壤装入无菌袋中,标明采集点、日期、土样号,及时置于4 ℃冰箱保存,备用,每个样地采集4份,共12份土壤样品。3个采样地土壤基本理化性质如表1所示。
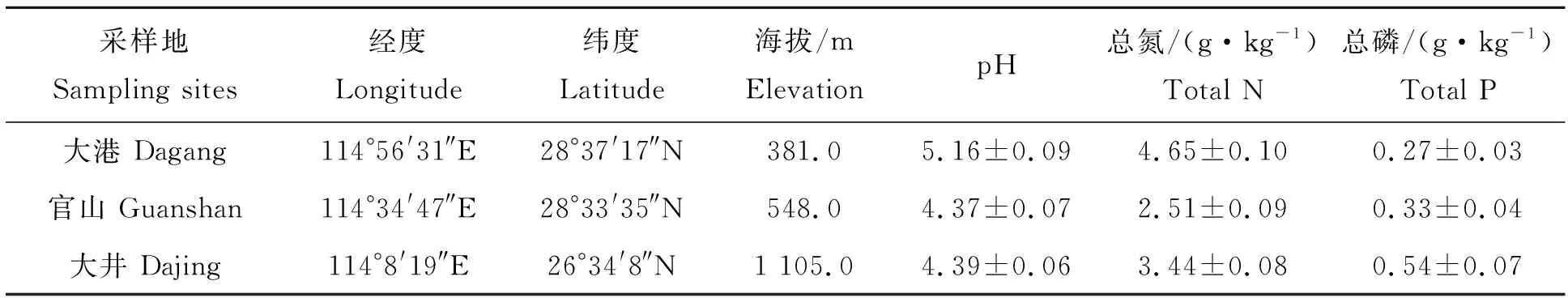
表1 3个采样地的基本土壤理化性质
数据是平均值±标准误,n=5
Data are means±SE,SE is standard error,n=5
1.1.2 培养基 牛肉膏蛋白胨固体培养基(NA),马铃薯葡萄糖琼脂培养基(PDA),解磷培养基(NBRIP)[11],解钾培养基[12],金氏培养基B(King培养基)[13]。
1.1.3 供试菌株 毛竹枯稍病病原菌竹喙球菌(C.phyllostachydis)保存于江西农业大学林学院森林保护教研室,由中国林业微生物菌种保藏中心赠送。
1.2 方法
1.2.1 毛竹根际溶磷细菌筛选 各样品称取10.0 g毛竹根际土壤,放入装有90 mL无菌水的250 mL摇瓶(加1滴吐温80),室温下180 r/min振荡60 min。采用稀释平板法[14],挑取单菌落转至NA斜面,28 ℃培养2~3 d,于4 ℃冰箱保存,备用。
1.2.2 毛竹根际溶磷细菌溶磷能力测定 按照Mehta[15]的方法进行操作,将筛选出来的细菌接种于NBRIP平板培养基上,30 ℃ 培养4~6 d,观察有无溶磷圈产生,并采用游标卡尺分别测量溶磷圈直径(D)和菌落直径(d),计算溶磷圈与菌落直径比(D/d)。比值越大,表示溶磷能力越强;将细菌接种于装有50 mL NBRIP培养液的100 mL三角瓶中,设置相同体积空白种子液的NBRIP培养液为对照。各接种处理3个重复,30 ℃,180 r/min下振荡培养8 d,将发酵液离心10 min(4 ℃,10 000 r/min),采用钼锑抗比色法测定上清液中可溶性磷的含量[16]。
1.2.3 毛竹根际细菌株解钾能力测定 将筛选的细菌接入装有50 mL解钾培养基的100 mL三角瓶中,28 ℃、180 r/min条件下振荡培养7 d,将发酵液先在500 r/min,10 min条件下除去发酵液中的不溶性物质,然后在10 000 r/min,10 min条件下离心收集上清液,采用火焰分光光度计法测定上清液中有效钾的含量[17]。
1.2.4 毛竹根际细菌株分泌IAA特性 采用Salkowski 比色法测定产IAA能力[18]。取IAA标品,配置成0,0.5,2.5,5.0,7.5,10,12.5,15.0,17.5,25.0,50.0 mg/L的浓度梯度,取2 mL各浓度IAA 加入等量的氯化铁比色液(PC比色液),30 ℃中暗保温30 min,波长530 nm下利用分光光度计测定吸光度,绘制标准曲线,得方程y=31.868x(R2=0.994 7)。将筛选的已纯化细菌接种至King 培养基摇床培养15 d,按标准曲线制作方法测定发酵液中IAA含量。
1.2.5 毛竹根际细菌菌株的温室施用试验 将JGSB02和JGSB06菌株活化后,用接种环挑取少量菌体接种于牛肉膏蛋白胨液体培养基中28 ℃,180 r/min振荡下培养48 h。发酵液(4 ℃,5 000×g)离心5 min,无菌生理盐水润洗菌体3次并调节菌悬液(108cfu/mL)制成菌剂。接种毛竹实生苗(苗龄90 d),培养基质按照土壤∶砂子∶蛭石=2∶1∶1的配比,灭菌后备用。接种试验分为3种处理,分别为接种JGSB02、JGSB06、对照处理CK(接种无菌生理盐水),每种处理20株毛竹苗,各施入10 mL菌剂。定期对各处理浇水,及时除去杂草。栽培120 d后测定苗高、地径。
1.2.6 根际促生菌株对毛竹枯梢病病原菌拮抗作用 (1)平板对峙试验。用打孔器(直径=5 mm)在培养5 d的毛竹枯梢病原菌竹喙球菌菌落边缘打取菌饼,接于PDA平板中央,将用NA 斜面活化的优良菌株划线接种于PDA平板两侧,以只接病原菌为对照CK,每个处理3个重复。28 ℃培养4 d观察有无抑菌带,并测量抑菌带宽度。
(2)细菌发酵液对病原菌生长的影响。将优良菌株接种于NB培养基中,28 ℃(200 r/min)下培养2 d。发酵液经10 000 r/m离心20 min后,取上清液用0.22 μm微孔滤膜过滤即得无菌滤液。取无菌滤液5 mL与20 mL冷却到40 ℃的PDA培养基混合倒平板;以无菌水代替无菌滤液为对照。再将病原菌菌块点接于平板中间。每个处理3个重复,28 ℃培养6 d,测定滤液对毛竹枯稍病病原菌竹喙球菌(C.phyllostachydis)的生长抑菌率。计算公式如下:
生长抑菌率=(对照平板菌落直径-带滤液平板菌落直径)/(对照平板菌落直径-菌块直径)×100%
1.2.7 毛竹根际细菌的鉴定 按照《常见细菌系统鉴定手册》进行菌株形态与生理生化分析[19]。并利用Biolog进行鉴定(鉴定步骤参照说明书)。
1.2.8 数据处理 运用Microsoft Excel 2013整理数据,利用SPSS18.0 软件做统计分析,数据以mean±SD 表示。采用CTAB法提取总DNA[20],引物采用27f和1 495r,PCR 产物送生工生物工程(上海)股份有限公司测序。将测序获得的16S rDNA序列在NCBI上进行BLAST比对,将这些序列采用Bioedit软件的Multiple Sequence Alignment程序进行多序列同源性分析,并利用软件MEGA6.0构建系统发育树(Bootstrap=1 000)[21]。
2 结果与分析
2.1 毛竹根际溶磷菌株筛选及其溶磷能力
从毛竹根际土壤中共分离纯化68株细菌,其中17株细菌具有溶磷功能,能在NBRIP无机磷培养基上产生清晰的溶磷圈。其中,6株来自大港林场土样,7株来自井冈山大井林场及4株来自官山林场。JGSB02和JGSB06菌株产生的溶磷圈最大(图1),D/d比值分别为1.92,1.65 cm(表2),表明这2株细菌具有较强的溶磷能力。
图1 毛竹根际2株高效溶磷菌株 Fig.1 Phosphorus solubilizing capability of two bacteria from bamboo rhizosphere

菌株StrainD/d可溶性磷含量/(mg·L-1)The content of soluble phosphorus采样地Sampling siteDGD061.3±0.0273.90±4.36d大港林场DGD071.2±0.0426.35±4.70c大港林场DGD081.1±0.069.92±1.30ab大港林场DGD091.1±0.048.56±2.36ab大港林场DGD101.2±0.0215.76±0.80b大港林场DGD151.5±0.08123.47±6.53f大港林场JGSB021.92±0.07165.42±6.00kl大井林场JGSB041.6±0.05156.33±4.04ij大井林场JGSB 061.65±0.05160.29±2.57jk大井林场JGSB081.4±0.03119.74±1.89f大井林场JGSB102.0±0.06149.87±3.65hi大井林场JGSB121.4±0.05146.44±5.76jk大井林场JGSB252.1±0.08146.47±6.47h大井林场GS011.7±0.05119.24±4.12f官山林场GS41.2±0.0397.36±2.76e官山林场GS081.4±0.04117.40±4.91f官山林场GS0121.9±0.06142.60±5.49l官山林场CK-3.29±1.00a-
数据为平均值±标准误,同列数据后不同小写字母表示差异显著(P<0.05),下同
Each value in the table represents mean± standard error,within the same column followed by different small letters indicate significant difference (P<0.05),the same below
将产生溶磷圈的菌株分别接种于NBRIP-BPB液体培养基中振荡培养5 d后,测定各菌株对磷酸三钙的溶解能力,结果显示,这3个样地中分离的PGPR菌株溶磷能力差异显著,从大井林场土样中分离的PGPR菌株溶磷能力最强。其中JGSB02和JGSB06发酵液中可溶性磷含量明显高于其他菌株和CK,溶磷量分别为165.42,160.29 mg/L(表2)。
2.2 毛竹根际细菌的解钾能力

不同小写字母表示差异显著(P<0.05)Different small letters indicate significant difference (P<0.05)图2 毛竹根际JGSB02和JGSB06菌株解钾能力Fig.2 Potassium releasing ability of JGSB02 and JGSB06 from bamboo rhizosphere
培养7 d后发酵液中钾的含量,结果如图2显示。从图中可以看出,在接种菌株JGSB02和JGSB06的培养瓶中,可溶性钾的含量显著高于对照,表明菌株JGSB02和JGSB06均能将钾长石中难溶性钾溶出。JGSB02解钾量为3.83 mg/L;JGSB06解钾量为3.13 mg/L,表明菌株JGSB02和JGSB06对钾长石中难溶性钾具有较好的解钾作用。
2.3 毛竹根际细菌产IAA能力
采用Salkowski 比色法对JGSB02和JGSB06菌株定量测定,结果显示菌株JGSB02和JGSB06具有较好的产IAA能力,其IAA 分泌量分别为4.38,10.27 mg/L,且菌株JGSB06分泌IAA能力要强于JGSB02(表3)。

表3 毛竹根际JGSB02和JGSB06菌株分泌IAA 能力
数据为平均值±标准误
Each value in the table represents mean± standard error
2.4 根际优良菌株对毛竹实生苗的促生长作用
在温室条件下,将JGSB02和JGSB06菌剂分别施用于毛竹实生苗根部,施用120 d后测定苗高和地径,结果如表4显示,施菌处理竹苗的苗高和地径均显著高于未施菌处理,JGSB02和JGSB06菌株处理的苗高增长率分别为30.95%和52.17%,地径增长率分别为28.57%和51.79%。上述结果说明JGSB02和JGSB06菌株对毛竹实生苗有显著的促生作用(图3,表4)。

图3 JGSB02和JGSB06菌株的液体菌剂对毛竹促生长效果Fig.3 Promoting effect on seedling growth of bamboo after inoculate JGSB02 and JGSB06

处理Treatment苗高/mmSeedling height增长率/%Growth rate地径/mmGround diameter增长率/%Growth rateJGSB0234.74±2.11b30.952.16±0.67ab28.57JGSB0640.37±1.25c52.172.55±0.45b51.79CK26.53±1.86a-1.68±0.52a-
2.5 优良根际促生菌对毛竹枯梢病病原菌竹喙球菌拮抗作用
2.5.1 平板抑菌作用 平板对峙试验显示JGSB02和JGSB06菌株对竹喙球菌有较好的抑菌作用(图4),抑菌圈直径分别达至2.37,2.92 cm(表5)。

图4 2株优良细菌对病原菌平板对抗 Fig.4 The inbibition zone of three strains to pathogenic fungi

菌株 Strain抑菌圈直径/cm Diameter of inhibition zoneJGSB022.37±0.05aJGSB062.92±0.11a
2.5.2 优良菌株发酵液对病原菌生长的影响 2株优良促生细菌JGSB02和JGSB06的发酵液对病原菌均有较强的抑菌活性,且效果显著,其中JGSB06抑菌效果较好,达至66.99%(表6)。

表6 2株促生细菌发酵液对病原菌的抑菌活性
2.6 毛竹根际优良促生菌株的鉴定
2.6.1 菌株的形态、生理生化特性 JGSB02和JGSB06菌株在NA培养基上培养48 h,菌落呈圆形,稍微隆起,颜色为淡乳白色,不透明(图5)。细胞呈杆状,革兰氏染色阴性。生理生化特性鉴定结果如表7。
2.6.2 16S rDNA 序列分析 JGSB02和JGSB06菌株的16S rDNA序列已提交至GenBank,登录号分别为MF285776 和MF285777。由图6的系统发育树可知,JGSB02、JGSB06菌株与Burkholderiacepacia同处于一个分支,说明它们的序列相似性很高,即亲缘关系很接近,结合菌落、菌体特征、生理生化等指标,将JGSB02和JGSB06菌株鉴定为Burkholderiacepacia。
图5 JGSB02和JGSB06菌株菌落形态Fig.5 The colony morphology of JGSB02 and JGSB06 bacteria
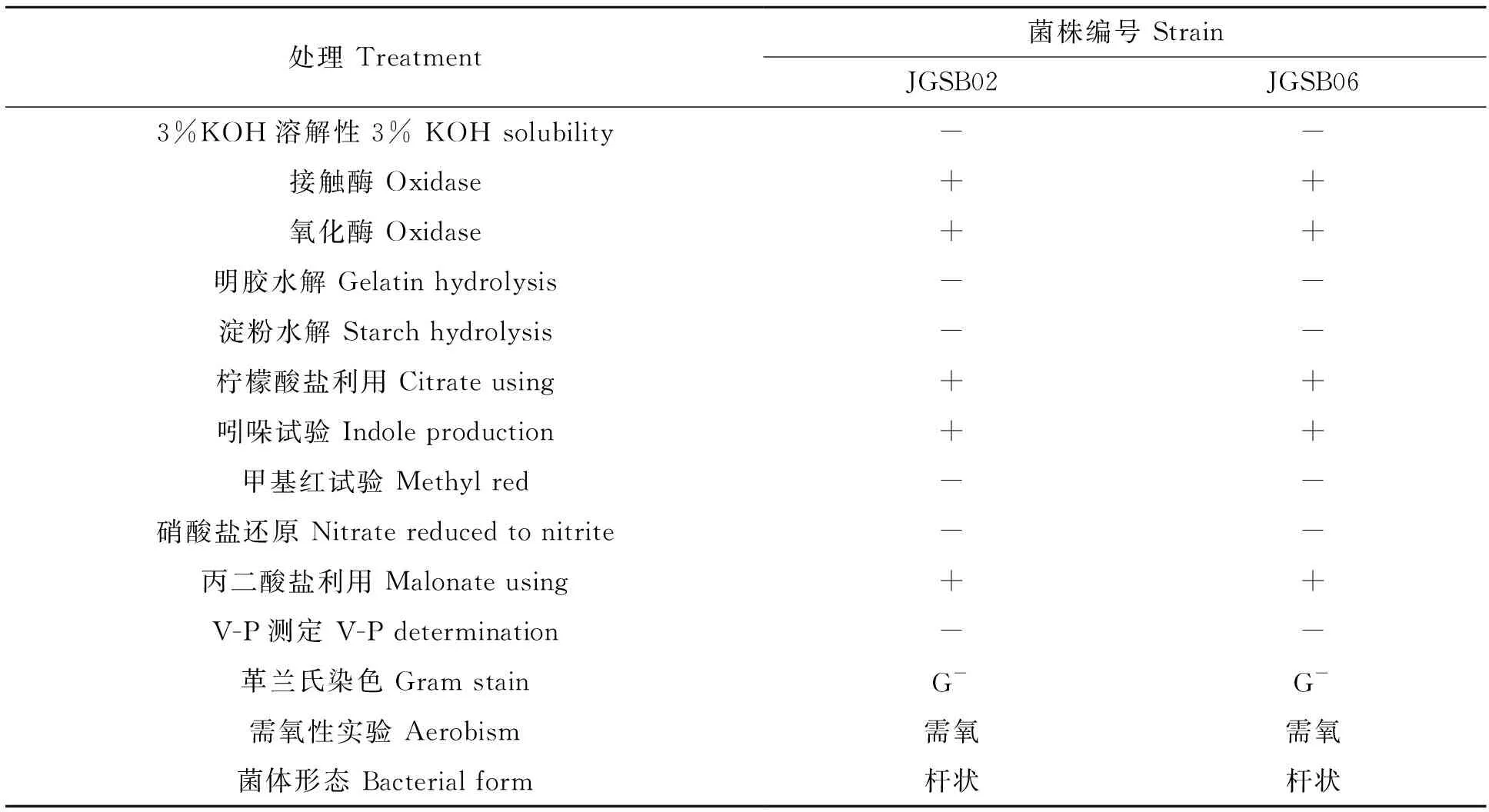
处理 Treatment菌株编号 StrainJGSB02JGSB063%KOH溶解性 3% KOH solubility --接触酶 Oxidase++氧化酶 Oxidase++明胶水解 Gelatin hydrolysis--淀粉水解 Starch hydrolysis --柠檬酸盐利用 Citrate using++吲哚试验 Indole production++甲基红试验 Methyl red--硝酸盐还原 Nitrate reduced to nitrite--丙二酸盐利用 Malonate using++V-P测定 V-P determination--革兰氏染色 Gram stainG-G-需氧性实验 Aerobism需氧需氧菌体形态 Bacterial form杆状杆状
“-”表示反应阴性;“+”表示反应阳性
“-” show negative reaction;“+” show positive reaction

图6 JGSB02和JGSB06菌株的系统进化树Fig.6 Phylogenetic tree based on the 16S rDNA sequence of JGSB02 and JGSB06
2.6.3 优良菌株的Biolog 鉴定 JGSB02和JGSB06菌株在Biolog鉴定板上培养18~24 h时的读数相似值(SIM)均大于0.5,符合Biolog系统关于理想结果的要求,确定菌株为Burkholderiacepacia。此结果与形态、生理生化特征和分子鉴定结果一致。
3 讨 论
毛竹林主要分布于长江流域以南缺P的丘陵红壤区,江西为毛竹主产区,林地地力衰弱、养分供应不足是毛竹资源培育中面临的主要问题之一,土壤养分缺乏导致竹材、竹笋产量逐年呈下降趋势,严重威胁着毛竹林的持续经营利用。最新研究表明磷素已成为限制毛竹生产力的首要因子,钾素也严重缺乏[22],而土壤微生物作为土壤生态系统物质循环和生化过程的主要参与者与调节者,在驱动土壤中的物质循环和营养元素转化、调节生态系统功能等方面起着十分重要的作用。植物根际促生菌(PGPR)能促进植物对磷、钾元素的吸收与利用,可产生代谢产物有利于植物的生长发育,促进植物生长[23]。Beheraa等[24]在印度红树林土壤中筛选出PGPR菌株Serratiasp.能较好的提高植物对磷素的吸收和利用。尚学丽等[25]利用解钾细菌研究其对土壤矿物的解钾效应,发现解钾细菌对钾长石和伊利石有显著的解钾效应,并能影响诸如Si、Fe等元素的迁移。本试验从毛竹根际筛选具有溶磷解钾能力的菌株,发现不同地区根际土壤解磷细菌分布及解磷能力存在差异,这可能与土壤类型及土壤有机质等理化性质有关。研究表明,溶磷解钾细菌在生长代谢过程中可产生有机酸和植物激素类物质,如赤霉素、IAA的等激素[26-27],进而促进植物的生长发育。本试验证实了2株溶磷解钾效果较好的细菌JGSB02和JGSB06均能具有产生IAA能力。目前在毛竹PGPR菌株的应用方面仅有韩烁等[10]从毛竹根际土壤和根系中筛选了具有解磷功能的细菌,并发现Bacillussp.和Burkholderiasp.是分布在毛竹根际土壤中的解磷细菌优势属。本文筛选的2株优良的毛竹根际促生细菌具有较好的溶磷、解钾及产IAA能力,丰富了PGPR微生物的种质资源,并具有应用于毛竹微生物肥料开发研制的潜力。
通过生理生化和分子鉴定表明这2株细菌隶属于洋葱伯克霍尔德氏菌群(Burkholderiacepaciacomplex,简称BCC),BCC是一组表型相近但基因型相异的复合物,而不是具体的一个种,目前发现由17个基因型构成[28]。本研究中这2株菌株和Burkholderiacepacia亲缘关系最近,后期还需要采用recA特异性PCR技术及recA基因序列系统发育分析对其进行基因型鉴定,进而做出更准确的鉴定。BCC菌株在林业方面应用报道相对于农业方面还是比较少[28],已有研究报道Burkholderiasp.菌株具有解磷、固氮、产ACCA脱氨酶活性及拮抗土传病害等功能,能显著促进作物的生长[29]。任嘉红等[30]从杨树体内分离到Burkholderiapyrrocinia菌株,对杨树有着显著促生作用,而且对杨树溃疡病有着较好的生防作用,田间防治效果可40.5%。Ghosh等[31]发现菌株Burkholderiasp.具有较好的溶磷能力,溶磷量达至517.12 mg/L,能定殖在石松属植物根系并显著促进其生长。本文将JGSB02和JGSB06菌株对毛竹实生苗进行接种试验,结果表明,这两株细菌能显著的促进毛竹生长。同时,对毛竹枯梢病病原菌具有较好的拮抗效果,具有作为生防菌株的较大潜力。另外相比于其他生防菌株,BCC菌株大量的分布于禾本科植物根围根际土壤中[32],具有较好的应用前景。因此,本研究的筛选的2株溶磷解钾细菌可作为促进毛竹生长和生防的潜在PGPR菌株。
目前普遍认为BCC的生防机制与其产生的代谢物有关,比如硝吡咯菌素、洋葱菌素吩嗪、木假丝菌素、赛派素等具有抗菌作用的物质,国际上也认同利用BCC产生的代谢产物进行植物病害生物防治[28]。关于本文中2株促生菌对病原菌拮抗作用机制尚需更深入的研究,弄清生防和促生机理,使其在毛竹病害防治和促生长过程中发挥最大潜力。
