P16INK4A蛋白与HPV L1壳蛋白在诊断子宫颈病变中的应用
2018-09-14王勉勉严育宏张爱慕蒋义
王勉勉,严育宏,张爱慕,蒋义
宫颈上皮内瘤样病变(CIN)是与宫颈浸润癌密切相关的一组癌前病变[1]。对子宫颈癌前病变人群进行病变等级的判断及风险预后,指导临床医生管理与治疗,将是一个重大的课题。有研究显示,从人乳头瘤病毒(HPV)感染到最终发展为宫颈癌的较长时期内,肿瘤抑制基因P16INK4A蛋白及HPV感染细胞的靶位点人乳头瘤病毒L1壳蛋白(HP VL1),两者的表达与转归密切相关[2]。本研究采用免疫组织化学的方法检测P16INK4A蛋白及HPVL1在宫颈不同病变组织中的表达情况,分析二者的相关性,探讨这两项检测作为子宫颈病变早期诊断及进展风险评估指标的应用价值。现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2015年1―12月
在浙江省温州市中心医院就诊,行宫颈液基细胞学检查(TCT)排除正常或炎症者,且HPV基因检测示高危型HPV阳性患者140例,年龄21~70岁,平均(39±9)岁。剔除近期妊娠、有免疫系统抑制性疾病者。所有患者行P16INK4A蛋白与HPV L1壳蛋白检查及阴道镜下宫颈活检。采用组织学病理诊断为“金标准”。
1.2 方法
1.2.1 宫颈细胞学检查 采用美国新柏氏液2000全自动制片机将标本进行程序化处理制片,由两位病理科医师阅片。结果判断按照 TBS分类:正常或炎症(NILM)、不明确意义的非典型鳞状上皮细胞(ASCUS)、非典型鳞状细胞-不除外高度鳞状上皮内病变(ASC-H)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)及鳞状上皮浸润癌(SCC)。
1.2.2 HPV DNA分型检测 采用凯普公司提供的试剂盒,使用PCR-反向杂交基因芯片技术,检测21种HPV亚型的基因分型,其中13种 HPV高危亚型(16、18、31、33、35、39、45、51、52、56、58、59 及 68)。
1.2.3 P16INK4A 蛋白检测 采用SABC法免疫组织化学染色,严格按照SABC试剂盒说明书进行操作。以细胞浆和/或细胞核黄色或棕黄色染色为阳性,表达强度参照Kleas等[3]的半定量标准,观察10个代表性视野,计数500个细胞中的阳性细胞数,取平均值。阴性:阳性细胞百分率<10%或染色强度与背景颜色无明显差异;弱阳性(+):阳性细胞百分率10%~30%,染色强度较弱;中度阳性(2+):阳性细胞百分率31%~60%;强阳性(3+):阳性细胞百分率>60%。
1.2.4 HPV L1壳蛋白检测 采用免疫组织化学方法和分子杂交技术双重检测,将液基薄层细胞标本再次制片,按照“CytoReact赛泰”细胞/组织HPV-L1壳蛋白染色试剂盒(美国爱迪旺斯公司产)说明书进行操作。HPV L1壳蛋白阳性判断标准:≥1个细胞染色阳性。
1.2.5 阴道镜下宫颈活检和组织病理检查 通过阴道镜观察和判断,对醋酸白斑区、碘试验不染色区、异常血管区等宫颈部位采集标本,并用4%的甲醛溶液进行固定,进行病理检查。
1.3 统计方法 采用SPSS19.0软件进行统计学分析,计数资料比较采用 2检验或者 Fisher确切概率检验法。 P<0.05为差异有统计学意义。
2 结果
2.1 组织学诊断结果 组织学诊断标准参考《WHO分类女性生殖器官肿瘤》(第4版)[4],诊断结果包括慢性炎症、LSIL(相当于 CINI)、HSIL(相当于 CIN II~III)及子宫颈癌(SCC)。细胞学结果及组织学结果见表1。
2.2 P16INK4A在不同宫颈组织中的表达 从宫颈慢性炎症、LSIL、HSIL到宫颈癌,P16INK4A的阳性率呈逐渐增高,宫颈慢性炎症组织和 LSIL组织中P16INK4A阳性表达率,以及LSIL组织和HSIL组织中P16INK4A阳性表达率差异差异有统计学意义( 2=9.588、25.187,均<0.05),而HSIL组织和宫颈癌组织中P16INK4A阳性表达率差异无统计学意义(P=1.000)。LISL组、HSIL组及宫颈癌组的P16INK4A阳性率与慢性宫颈炎组织差异均有统计学意义(均P<0.05)。慢性炎症症组+LSIL组和HSIL组+宫颈癌组宫颈组织的P16INK4A阳性率差异无统计学意义( 2=61.405,P<0.05)。见表2。
2.3 HPVL1壳蛋白在不同宫颈组织中的表达 从宫颈慢性炎症、LSIL、HSIL到宫颈癌,HPVL1壳蛋白的阳性率呈逐渐降低,宫颈慢性炎症组织、LSIL组织中HPVL1壳蛋白的阳性表达率差异无统计学意义( 2=0.148,P> 0.05),HSIL组织和宫颈癌组织中HPVL1壳蛋白的阳性表达率差异无统计学意义(P=1.000);LSIL组织和HSIL组织中HPVL1壳蛋白的阳性表达率差异有统计学意义( 2=21.059,P<0.05)。以慢性宫颈炎组的HPVL1壳蛋白的阳性率作为对照标准,HSIL组及宫颈癌组的HPVL1壳蛋白的阳性率与慢性宫颈炎组织比较差异均有统计学意义(均P<0.05)。慢性炎症组合并LSIL组,HSIL组合并宫颈癌组,两组宫颈组织的HPVL1壳蛋白的阳性率差异有统计学意义(P<0.05)。见表 3。
2.4 P16INK4A与HPVL1壳蛋白联合表达情况 选择P16INK4A-或HPVL1+,和P16INK4A+或HPVL1-进行分组,其在不同宫颈中的分布见表4。以组织病理学结果为“金标准”,单独宫颈TCT预测高危型 HPV阳性患者≥HSIL的敏感性、特异性、阳性预测值和阴性预测值分别为42.86%、93.41%、77.78%、75.22%,P16INK4A及HPVL1壳蛋白联合的预测高危型HPV阳性患者≥HSIL的敏感性、特异性、阳性预测值和阴性预测值分别为91.48%、92.31%、86.54%、95.45%。见表5。
3 讨论
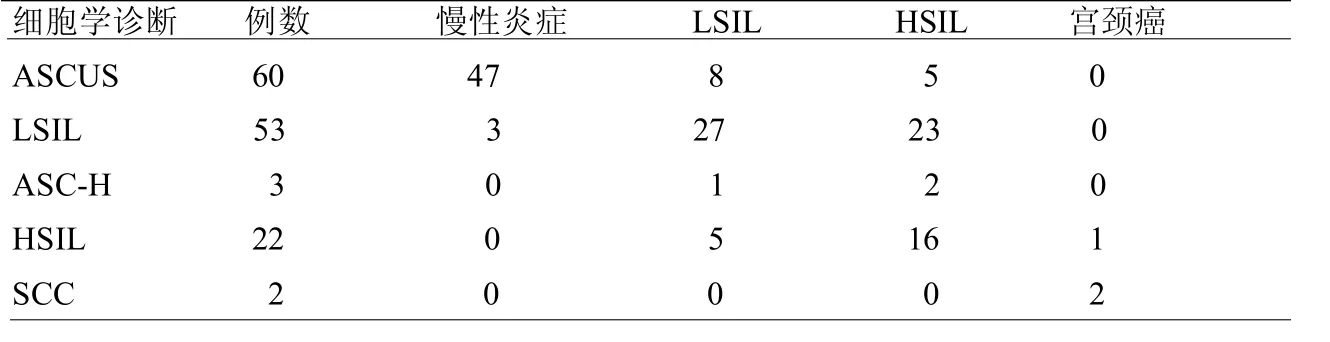
表1 140例宫颈细胞组织学诊断结果与细胞学诊断的对照 例
TCT是目前宫颈细胞学检查的主要手段,但其准确性受取材、标本制作的影响,不可避免的存在一定的漏诊率[5]。尤其是细胞学TBS诊断标准中的ASCUS,可能为炎症,亦可能为宫颈上皮内瘤变。本文TCT且HPV阳性共140例,TCT的灵敏度仅42.86%,但TCT的特异度有93.41%,此结果可能与本实验采用门诊普查人群有关。提示在对≤LSIL的判断中,TCT存在较大的缺陷,而在对≥HSIL的判断中仍是准确率非常高的。故在诊治与随访过程中选择更可靠的生物学指标,并弥补TCT在对正常和低度上皮内瘤变上的判断缺陷将有重要的意义。
3.1 P16INK4A蛋白的表达与子宫颈病变的关系 在许多恶性肿瘤中P16INK4A基因表达缺失,但国内外对宫颈癌P16INK4A的研究结果多报道为过表达[6]。还有研究指出 P16INK4A在HSIL及以上病变中显著高表达,具有高度敏感性,可作为HSIL及以上病变诊断、鉴别诊断的敏感指标[7-8]。王荣敏等[9]在对CINⅠ患者随访中得出,P16INK4A阳性表达者病变进展率是阴性表达者的3.87倍;故可将P16INK4A作为宫颈上皮内瘤变低、高分级的可靠指标,并预测CIN的转归。本实验结果也可能因本研究宫颈癌病例偏少而造成的偏差。
3.2 HPVL1蛋白的表达与子宫颈病变的关系 HPVL1壳蛋白阴性可能提示HPV处于结合状态且细胞免疫应答降低,发生CIN或宫颈癌的概率较高[10]。Mehlhorn等[11]在一项前瞻性国际多中心研究中发现,无论在 LSIL还是在HSIL中,L1表达阳性患者的临床转归与L1表达阴性患者差异有统计学意义;阳性患者病变消退的概率为阴性患者的5.4倍(63% 12%),阴性患者病变进展为HSIL或癌的概率是阳性患者的3.8倍(59% 16%)。本实验结果亦证实可以将HPVL1壳蛋白作为预测区分宫颈病变低度和高度的有效指标。
3.3 P16INK4A蛋白与HPVL1蛋白联合在子宫颈病变中意义 有研究表明P16INK4A和HPVL1衣壳蛋白免疫染色联合结果是非常有用的预后指标[2,12]。笔者基于 P16INK4A-HPVL1组合归纳为4个不同的类别。(1)P16INK4A+/HPVL1-:HPV DNA与宿主细胞基因组整合使细胞周期改变,从而抑制了RB蛋白通路,使其没有生殖性和生命力。它可能被定义为高风险的模式,通常在宫颈高级别病变里发现。本文 3例(100%)的宫颈癌,29例(63.04%)的高级别病变和7例(17.07%)的低级别病变表 达 这 种 模 式。(2)P16INK4A+/HPVL1+:这种模式虽然RB蛋白通路已经存在抑制(P16INK4A+),但L1蛋白仍然有效,表明病变在病毒产生阶段,有立即发生进展风险。本文8例(19.51%)低级别病变和9例(19.56%)高级别病变组织表达这种模式,但无宫颈炎组织表达这种模式。(3)P16INK4A-/HPVL1-:这种模式既没有抑制 RB蛋白通路(P16INK4A-),又没有有效的L1蛋白产生。P16INK4A的丢失是因为突变或甲基化,这可能就是P16INK4A阴性肿瘤的假设原因。本文9例(18.00%)宫颈炎,6例(14.63%)低级别病变,4例(8.70%)高级别病变表达这种模式。(4)P16INK4A-/HPVL1+:此时RB蛋白通路处于工作状态且L1蛋白有效,意味着病毒DNA虽存在但不改变细胞周期,发展成高级别CIN的风险低。本文37例(74.00%)宫颈炎,20例(48.78%)低级别病变,4例(8.70%)高级别病变显示这种模式。
P16INK4A蛋白和HPVL1壳蛋白的联合表达在宫颈病变中随着病理级别增高而增加的趋势为P16INK4A-/HPVL1+、P16INK4A-/HPVL1-、P16INK4A+/HPVL1+、和 P16INK4A+/HPVL1-。低级别病变往往与HPV病毒短暂性感染有关,会自发的消退而不需要治疗。在这些情况下,P16INK4A/L1表达状态可能有助于识别处于危险中的个体。临床上P16INK4A+/HPVL1-和 P16INK4A+/HPVL1+的个体需要严格的后续行动,P16INK4A-/HPVL1-的个体归类为低风险,低级别病变为此模式者需短时间内进行跟踪,P16INK4A-/HPVL1+的个体被视为没有明显发育不良的模式。笔者发现P16INK4A及HPVL1在灵敏度方面较TCT检查有明显优势,但特异度和阳性预测值较TCT欠缺;P16INK4A联合HPVL1壳蛋白后,4个指标均较单独TCT检查有优势。TCT在特异度方面已较精准,而P16INK4A联合HPVL1可以在灵敏度上对 TCT有一个明显的提高。
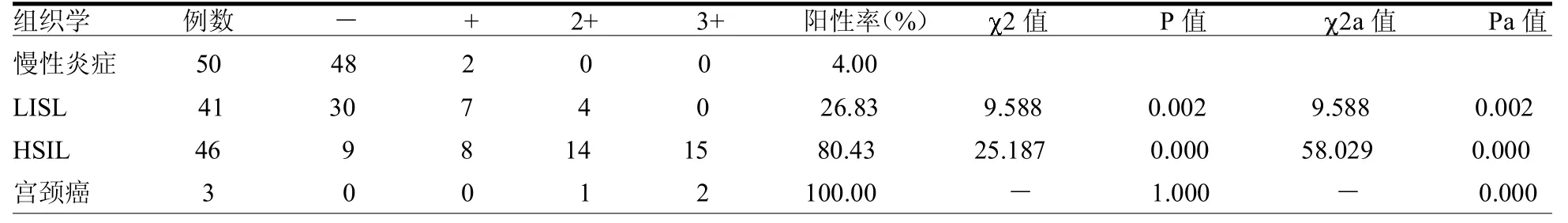
表2 P16INK4A在正常和异常宫颈组织中的表达情况 例
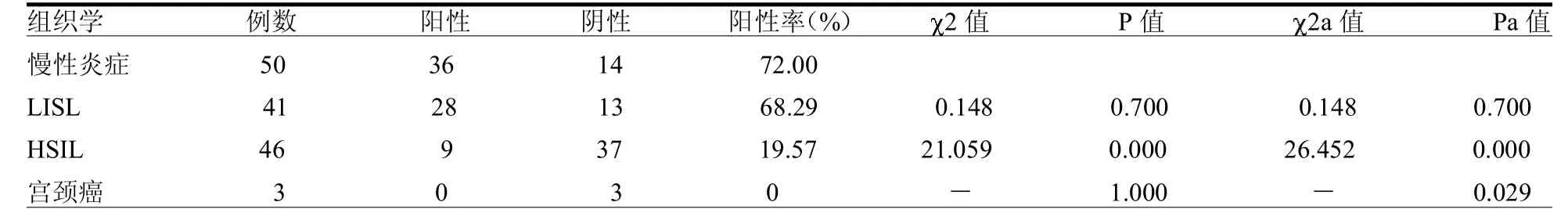
表3 HPVL1壳蛋白在正常和异常宫颈组织中的表达情况 例
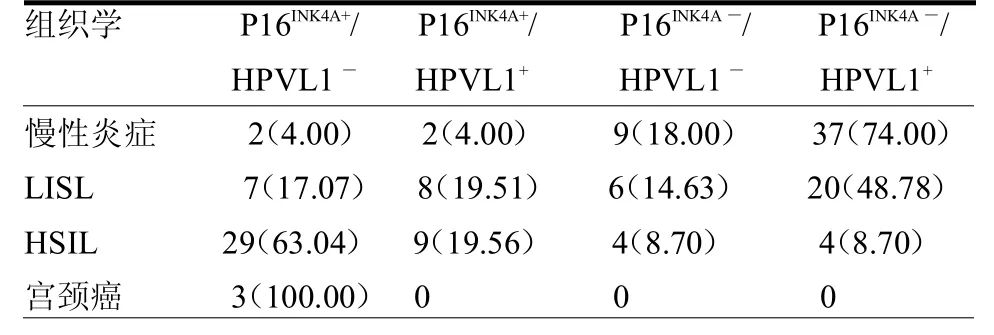
表4 P16INK4A和HPVL1壳蛋白联合表达结果 例(%)
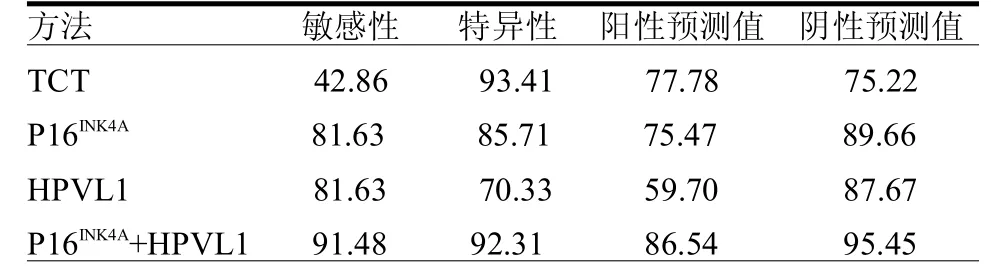
表5 各种检测方法对宫颈病变检测的敏感性、特异性、阳性预测值和阴性预测值 %
综上所述,P16INK4A蛋白和HPVL1壳蛋白均可作为宫颈癌癌前病变的可靠判断指标,两者联合检测可补充 TCT检测对低级别上皮内瘤变和高级别上皮内瘤变的区分,可能有助于发现具有恶性潜能的CIN,可成为CIN的诊断、分级及判断其转归的有效指标。本实验还可进一步完善除宫颈癌的各级别宫颈病变的转归,随访其1年、2年、5年的消退、维持和进展情况。
