融合魏斯氏菌和异常威克汉姆酵母混菌发酵荞麦酸面团馒头的香气物质特征
2018-09-13吴玉新汤晓娟陈佳芳黄卫宁FilipArnaut
蒋 慧,吴玉新,庄 靓,汤晓娟,陈佳芳,徐 岩,黄卫宁,*,李 宁,Filip Arnaut
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.广州焙乐道食品有限公司,广东广州 511400;3.焙乐道食品集团,比利时布鲁塞尔 B1702)
荞麦富含矿物质营养素、氨基酸、维生素和植物纤维素等[1-3],近年来其在烘焙行业的应用研究备受关注[4-6]。但是由于荞麦粉风味不佳和无面筋结构的粉质特性[7],单纯使用荞麦粉代替小麦粉的烘焙产品,消费者接受度低[8]。利用酸面团技术[9]能明显改善荞麦烘焙产品的口感、风味和质构等烘焙特征[10-11]。
传统的酸面团来源于我国传统“老酵头”或“老面”,它是一个复杂的生物体系[12-14],难于控制。现代酸面团技术是在传统酸面团技术基础上的延伸,更利于工业化生产。本课题组前期对传统酸面团中的微生物菌群结构进行深入的研究,程晓燕和孙银凤从传统酸面团中分别筛选出优势菌株并应用到烘焙产品中,发现利用现代酸面团发酵技术能明显提升产品的风味和质构特性[15-16]。钱超等[17]从酒曲中筛选出高产β-葡萄糖苷酶的乳酸菌,并将其应用到葡萄酸面团面包中,使其风味得到明显改善。
本实验中采用的融合魏斯氏菌(Weissellaconfusa,J28)是本课题组从酒鬼酒曲中筛选的一株高产胞外多糖的乳酸菌,前期用于荞麦面包品质的改善[18-19]。(Wickerhamomycesanomalus,M-4)是王益姝从梅兰香酒醅中分离出的优势生香酵母,将其制作酸面团后得到特征香气物质乙酸乙酯,赋予面包怡人的果香和酒香[20]。融合魏斯氏菌和异常威克汉姆酵母在酸面团发酵中各具特色,但是将这两株菌引入到荞麦酸面团馒头体系中,利用现代酸面团发酵技术进行混菌发酵的研究还鲜有报道。因此,本研究应用J28和M-4混菌发酵荞麦酸面团,通过对比单菌发酵结果,探索混菌发酵荞麦酸面团馒头的香气特征,以期为工业化开发具有天然生物发酵香气特征的烘焙新产品提供理论支持和技术指导。
1 材料与方法
1.1 材料与仪器
荞麦粉 内蒙古乡野田食品有限公司;即发性活性干酵母 广东梅山马利酵母有限公司;蔗糖 市售;MRS肉汤培养基、YPD培养基 杭州百思生物技术有限公司;琼脂粉 国药集团化学试剂有限公司;融合魏斯氏菌 分离自汤沟酒曲;异常威克汉姆酵母 分离自梅兰春酒醅。
HZL-F160全温振荡培养箱 太仓市强乐实验设备有限公司;APX-150C型恒温恒湿培养箱 上海博讯实业集团有限公司;LPZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-2F洁净工作台 苏净集团苏州安泰空气技术有限公司;TSQ Quantum XLS三重四级杆气质联用仪 美国赛默飞世尔科技公司;超快速气相色谱电子鼻Heracles Ⅱ Alpha MOS公司;SM-25搅拌机、SM-520E酥皮机、SPC-40SP醒发箱 新麦机械(无锡)有限公司;MZ-SYH26-2CB美的中式电蒸锅 广东美的生活电器制造有限公司。
1.2 实验方法
1.2.1 荞麦酸面团制作
1.2.1.1 乳酸菌单菌发酵荞麦酸面团(WCF)的制备 将J28接入到MRS肉汤培养基中,活化2代后(37 ℃培养24 h为活化一代),6000 r/min离心5 min,用无菌生理盐水洗涤2次后得到菌泥。按DY360作100 g酸面团,接种菌泥7.5 log CFU/g,蔗糖9.6 g,混合均匀,于振荡培养箱22 ℃,160 r/min培养24 h。DY值指制作酸面团时的粉水比,其计算公式如下:
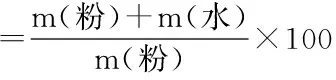
式(1)
1.2.1.2 酵母菌单菌发酵荞麦酸面团(WAF)的制备 将M-4接入到YPD培养基中,活化2代后(30 ℃培养24 h为活化一代),后续步骤同1.2.1.1。
1.2.1.3 混菌发酵荞麦酸面团(MBF)的制备 将活化好的J28和M-4以1∶50(培养基体积比)、接种量7.5 log CFU/g、DY360、蔗糖添加量9.6%接种制作酸面团,发酵方式同1.2.1.1。
1.2.2 荞麦酸面团菌落数 菌落总数的测定:每隔2 h取10 g荞麦酸面团样品,于90 mL无菌生理盐水中混合均匀,进行10倍梯度稀释至适当浓度,取100 μL分别在MRS和YPD固体培养基上涂布,分别在37 ℃和30 ℃培养箱中培养48 h并计数,为了保证实验数据的可信度,每个样品重复三次,并进行误差分析。
1.2.3 超快速气相色谱电子鼻Heracles Ⅱ分析不同荞麦酸面团风味差异 准确称取酸面团样品3.50 g,置于20 mL顶空瓶中,载气(H2),流量160 mL/min;顶空时间600 s,顶空温度60 ℃;进样量500 μL,进样速度500 μL/s,进样口温度200 ℃;捕集肼温度45 ℃,解析温度250 ℃;柱温50 ℃,1 ℃/s升至80 ℃,2 ℃/s升至250 ℃,保持60 s;氢火焰离子化检测器温度260 ℃;采集时间100 s[21]。
数据分析用正构烷烃标准溶液(C6~C16)进行校准,将保留时间转化为保留指数,将测试结果与Aro Chem Base数据库中的化合物进行对比,对化合物进行定性分析。依据5组重复实验的电子鼻数据输出雷达指纹图谱和PCA分析图。
1.2.4 馒头的制备 普通荞麦馒头(KBS)、J28发酵荞麦酸面团馒头(记作WCS)、M-4发酵荞麦酸面团馒头(记作WAS)和混菌发酵荞麦酸面团馒头(记作MBS)的制作配方见表1。制作工艺为:表1中的配料加入搅拌缸中低速(60 r/min)搅拌10 min左右至粉水混合均匀后,高速搅拌3.5 min左右直至面团表面光滑、缸体表面光滑。在操作台静置松弛5 min后,用酥皮机压片20次。分割面团为70 g/个,整形搓圆后放入蒸锅中,在38 ℃,85%湿度下醒发30 min后,沸水蒸制20 min,关火静置5 min后,取出。盖上纱布在室温下冷却1 h后进行参数测试。

表1 不同荞麦馒头的制作配方
1.2.5 SPME-GC-MS测定荞麦馒头中挥发性风味物质条件
1.2.5.1 SPME-GC-MS分析条件 顶空固相微萃取:称取绞碎后的馒头样品3.50 g于20 mL样品瓶中,插入75 μm Car/PDMS萃取头,60 ℃顶空萃取40 min,进行GC-MS分析。色谱条件[17]:DB-5MS毛细管色谱柱(60 m×0.32 mm,1 μm),载气He,10 mL/min恒流1 min后分流,分流比10∶1。程序升温为40 ℃保持2 min,6 ℃/min升温至160 ℃保持2 min,10 ℃/min升温至230 ℃保持7 min。质谱条件:电离方式:EI,放射电流50 μA,电子能量70 eV,离子源温度230 ℃。全扫描采集数据,扫描范围为质荷比33~350 m/z。
1.2.5.2 定性与定量 结果利用GC-MS数据分析软件处理,化合物经计算机检索,并与NSIT和RTLPEST谱库相匹配,仅报道匹配度大于800的结果。并采用峰面积归一化法定量计算各挥发性风味物质的相对含量。
1.2.5.3 挥发性风味物质的风味贡献 采用相对气味活度值(ROAV)描述各挥发性风味物质的风味贡献。定义风味贡献最大的化合物:ROAVstan=100,其他挥发性风味物质的风味贡献计算公式如下:
式(2)
式中:Cri、Ti-各挥发性风味物质的相对含量和风味阈值;Cstan、Tstan-参考组分的相对含量和风味阈值。
1.3 数据处理
采用Origin 8.5和SPSS对数据进行计算和主成分分析(PCA)。
2 结果与分析
2.1 荞麦酸面团发酵过程中酵母菌和乳酸菌的生长情况
面团发酵过程中乳酸菌(J28)和酵母菌(M-4)的生长曲线如图1所示,在WCF组中J28稳定期菌落数达到9.27 lg CFU/g,在MBF组中J28稳定期菌落数达到9.38 lg CFU/g,这可能是由于酵母菌代谢过程中,产生氨基酸、维生素等营养物质促进了乳酸菌的生长[22]。但是在发酵24 h后,MBF组中的J28进入衰亡期,菌落数急剧下降,这可能会引起酸面团发酵体系中碳氮失衡,影响风味化合物的积累,这也是酸面团发酵时间选择24 h的原因[23]。在WAF组中M-4稳定期菌落数为8.82 lg CFU/g,在MBF组中M-4稳定期的菌落数降为8.51 lg CFU/g,这可能是由于MBF组中乳酸菌发酵的低pH环境或乳酸菌与酵母菌共同竞争碳源,致使酵母菌生长受到一定的抑制[24];相比MBF组,WAF组的M-4在32 h时进入衰亡区,这可能是由于乳酸菌发酵产生的乳酸和乙酸能够引导某种特殊物质的合成,保护酵母菌菌体[25],使其较晚进入衰亡期。

图1 荞麦酸面团发酵过程中J28和M-4的生长曲线
2.2 Heracles Ⅱ快速气相电子鼻香气成分特征分析
图2和图3分别为电子鼻Heracles Ⅱ依据5组重复实验数据输出的雷达指纹图谱和PCA分析图。图2外围表示两种检测器下特征香气成分的出峰时间,其香气随着信号强度的增大而增强。由检测器1检测出来的差异性特征香气成分主要有3种,分别为乙醇(16.39-1-A)、乙酸(21.76-1-A)和乙酸乙酯(35.14-1-A),其中乙酸仅在WCF组中被检测出,乙酸乙酯仅在WAF和MBF组中被检测出。由检测器2检测出来的差异性特征香气成分主要有3种,分别为乙醇(20.05-2-A)、乙偶姻(33.34-2-A)和异戊醇(57.73-2-A)。综合两种检测器数据分析得到,样品间的特征香气成分为乙醇、乙酸、乙酸乙酯、乙偶姻和异戊醇。

图2 荞麦酸面团样品的Heracles Ⅱ雷达图
在图3中,四组样品之间的区分指数为86,说明不同样品之间存在明显差异。一般来说,总体贡献率超过85%,说明方法可信度较高。图3中PC1的风味贡献率为80.5%,PC2的风味贡献率为16.24%,总体贡献率达到96.74%,代表了样品的绝大多数信息,这说明该PCA分析方法能够准确描述样品之间的差异。
从图3中可以看出,产香酵母的引入是风味差异的主要原因,其主要差距在PC1上;乳酸菌的引入对风味的改善主要在PC2上。因此,不同酸面团发酵形式下,荞麦酸面团风味存在明显差异,混菌发酵组香气明显高于单菌发酵组,并且在后续研究中将其应用到馒头制作体系中,进一步探讨其对馒头香气特征的影响。
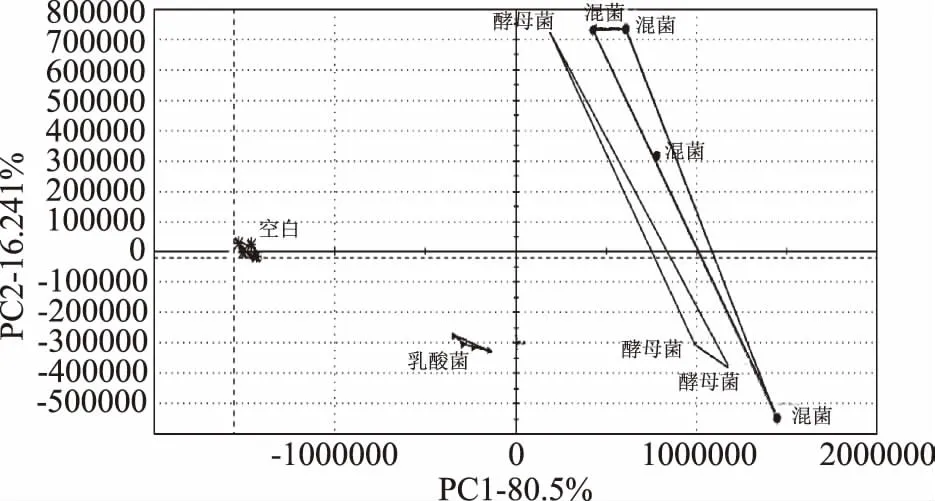
图3 荞麦酸面团样品的Heracles Ⅱ PCA图
2.3 不同荞麦馒头样品的挥发性风味物质分析
不同荞麦馒头样品之间挥发性风味物质的差异如表2所示。从表2中可知,KBS组、WCS组、WAS组和MBS组样品分别检测出55、51、53和56种风味物质,检测出的风味物质主要由醇类、酯类、酸类、杂环芳香类、烷烃类、萜烯类、羰基化合物类等组成。其中,KBS组挥发性成分中相对含量较高的为乙醇(40.55%)、异戊醇(21.60%)、β-苯乙醇(5.88%)、正己醇(2.77%)、蘑菇醇(2.23%)。WCS组挥发性成分中相对含量较高的为乙醇(29.51%)、异戊醇(20.21%)、乙酸(12.48%)、苯甲醛(3.81%)、β-苯乙醇(3.42%)、正己醇(3.07%)、乙偶姻(3.06%)、蘑菇醇(1.42%)。WAS组挥发性风味物质中相对含量较高的为乙醇(42.16%)、异戊醇(17.00%)、β-苯乙醇(10.49%)、乙酸(3.83%)、异丁醇(2.39%)、苯甲醇(2.29%)、邻苯二甲酸二异丁酯(2.25%)、苯甲醛(1.20%)、乙酸乙酯(0.64%)。MBS组挥发性风味物质相对含量较高的为乙醇(35.16%)、异戊醇(14.71%)、乙酸(12.99%)、β-苯乙醇(8.74%)、邻苯二甲酸二异丁酯(3.71%)、苯甲醛(2.71%)、乙偶姻(1.88%)、乙酸乙酯(1.71%)等化合物。从中可以看出,在各风味物质中酸类、醇类和酯类物质是差距最大的三类物质。在酸类物质中,WCS和MBS组酸类物质的总含量明显高于KBS和WAS,其中乙酸是引起差异的主要原因,这与J28的酸化作用有关。M-4是发酵的主力菌,所以在WAS和MBS组中检测出大量的醇类物质,除了乙醇外,异戊醇和苯乙醇也是引起差异的主要风味化合物,这与产香酵母M-4生长代谢中的Ehrlich途径有关。相比于其他物质,酯类物质阈值低,在相同含量下具有更浓郁的酒香、果香和花香。M-4的存在时引起酯类物质差异的主要原因,尤其是MBS组,更是利用M-4和J28的协同作用,将酯类物质总量从WAS组的5.27%提高到9.53%。其中,KBS中约10种相对含量较少的烷烃和羰基类风味化合物在发酵过程中消失或转化合成风味更强的酸、醇和酯类风味化合物,尤其在MBS中新合成了7种酯类物质,有最浓郁的果香、花香和酒香。

表2 不同荞麦馒头样品中挥发性风味物质分析
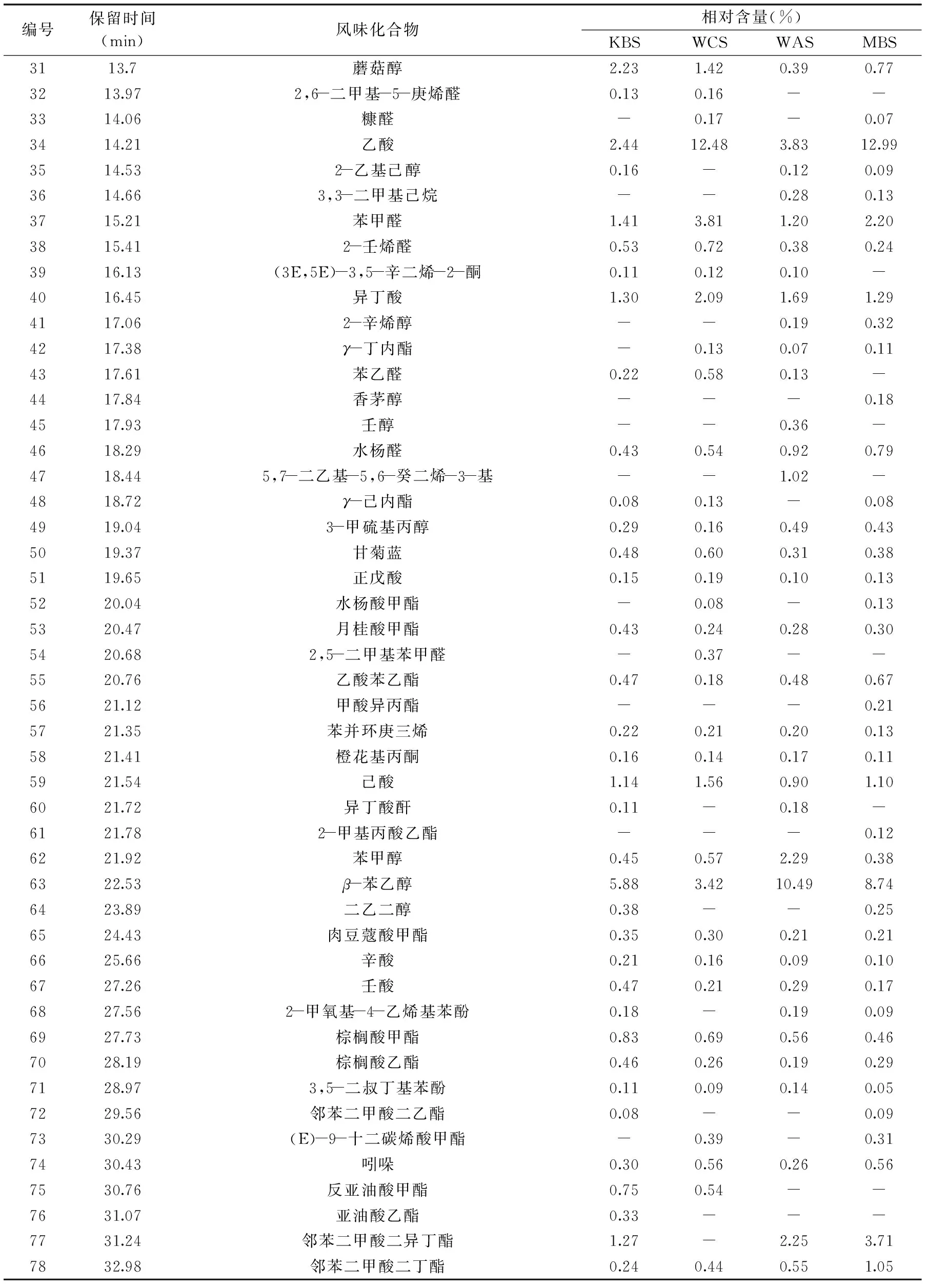
续表
图4是不同荞麦馒头风味物质按类别分析的柱状图,从图中可以看出各风味物质在种类及其相对含量的差别。就酸面团挥发性风味物质的总峰面积而言,WAS组的峰面积最高,其中醇类物质占79.65%,主要有乙醇、异戊醇、β-苯乙醇和蘑菇醇,除蘑菇醇具有蘑菇、薰衣草、玫瑰和干草香气[27]且风味阈值较低外,其他醇类物质的风味阈值较高,风味贡献较小。由图4中可知,MBS组挥发性风味物质中酯类物质种类明显高于其他组,由于酯类物质阈值相对较低,因此,即使有些酯类物质含量低,但其风味贡献不可忽略。MBS组乙酸乙酯的相对含量为1.71%,而WAS组为0.64%,其他发酵方式中未检出。乙酸乙酯具有果香和酒香,且阈值较低,风味贡献大[26]。KBS中也含有少量的酯类物质,主要为月桂酸甲酯、肉豆蔻酸甲酯、邻苯二甲酸二异丁甲酯和乙酸苯乙酯。其中,乙酸苯乙酯和月桂酸甲酯具有酒香及花香[28]、肉豆蔻酸甲酯具有蜂蜜和鸢尾样的香气[29]、邻苯二甲酸二甲酯稍有芳香味[30]。经过单乳酸菌发酵后,在WCS组中酯类物质明显减少,酸类物质和羰基类物质明显增加,尤其是酸类物质,峰面积由99.69×107增加到281.46×107,这主要归因于乳酸菌在酸面团发酵代谢期间产生大量乳酸和乙酸等有机酸。经过酵母菌发酵后,整体风味得到大幅度提升,尤其是酯类、醇类和酸类物质,如在MBF中酯类物质含量由KBF的5.7%提高到9.53%。在酯类物质中,主要为乙酸乙酯、乙酸苯乙酯和邻苯二甲酸二甲酯。乙酸乙酯具有明显的酒香和果香,乙酸苯乙酯具有玫瑰香和果香,还带有可可威士忌样的香韵[28],棕榈酸乙酯具有果香和奶油香[31]。经过混菌发酵后,酸面团的风味明显提升,酯类物质相对含量由单酵母菌发酵的5.27%提高到9.53%,此外,还产生乳酸乙酯等新的酯类化合物,给馒头产品带来柔和的果香味[32]。

图4 不同荞麦馒头样品中挥发性风味物质类别统计
图5是依据GC-MS挥发性风味物质进行的PCA分析,样品之间距离远近表示样品之间风味的相似度。从图5中可以看出,MBS组与KBS WCS和WAS的风味相差较大,且主要差距在PC1上,PC1代表了55.97%的风味贡献率。WAS和WCS的主要差距在PC2上,PC2代表了24.12%的风味贡献率。此结果与各个样品的GC-MS数据一致。

图5 荞麦馒头挥发性风味物质的PCA分析
挥发性风味物质的风味贡献由其在风味体系中的浓度和风味阈值共同决定,仅仅通过风味物质的相对含量不能准确描述荞麦酸面团的风味特征[33]。因此,采用相对气味活度(ROAV)结合风味物质的相对含量和风味阈值综合分析各风味物质的风味贡献。通过前期实验数据可以看出,WAS和MBS组的风味化合物相对含量明显高于KBS和WCS组,其具有更明显的酯香和醇香。因此,在后续的风味研究中,重点研究WAS和MBS组。
β-苯乙醇在WAS组和MBS组中的相对含量较高,分别为10.49%和8.74%,且其风味阈值相对较低,为86 μg/Kg,综合分析其对发酵的荞麦酸面团的风味贡献较大,因此将其ROAV定义为100。由表3可知,所有的风味物质均满足0≤ROAV≤100,ROAV值越大,风味贡献就越大。一般认为,当风味物质的ROAV≥1时,对风味体系的风味特征起主要作用,0.1≤ROAV≤1的风味物质对风味体系的风味特征起重要作用[34]。
从表3中可以看出,在WAS组和MBS组中主要作用的风味特征物质均为乙酸乙酯、2-戊基呋喃、壬醛、蘑菇醇、月桂酸甲酯、乙酸苯乙酯、β-苯乙醇和肉豆蒄酸甲酯,其中乙酸乙酯有明显的果香和酒香,2-戊氢呋喃有果蔬香,壬醛有玫瑰、柑橘香,蘑菇醇有玫瑰干草香,月桂酸甲酯和乙酸苯乙酯有明显的酒香和花香,β-苯乙醇有玫瑰香,且在这8种香气物质的ROAV均为MBS组高于WAS组,综合考虑,MBS组总ROAV 明显高于WAS组,说明混菌发酵荞麦馒头的风味强度明显高于单一酵母菌发酵。
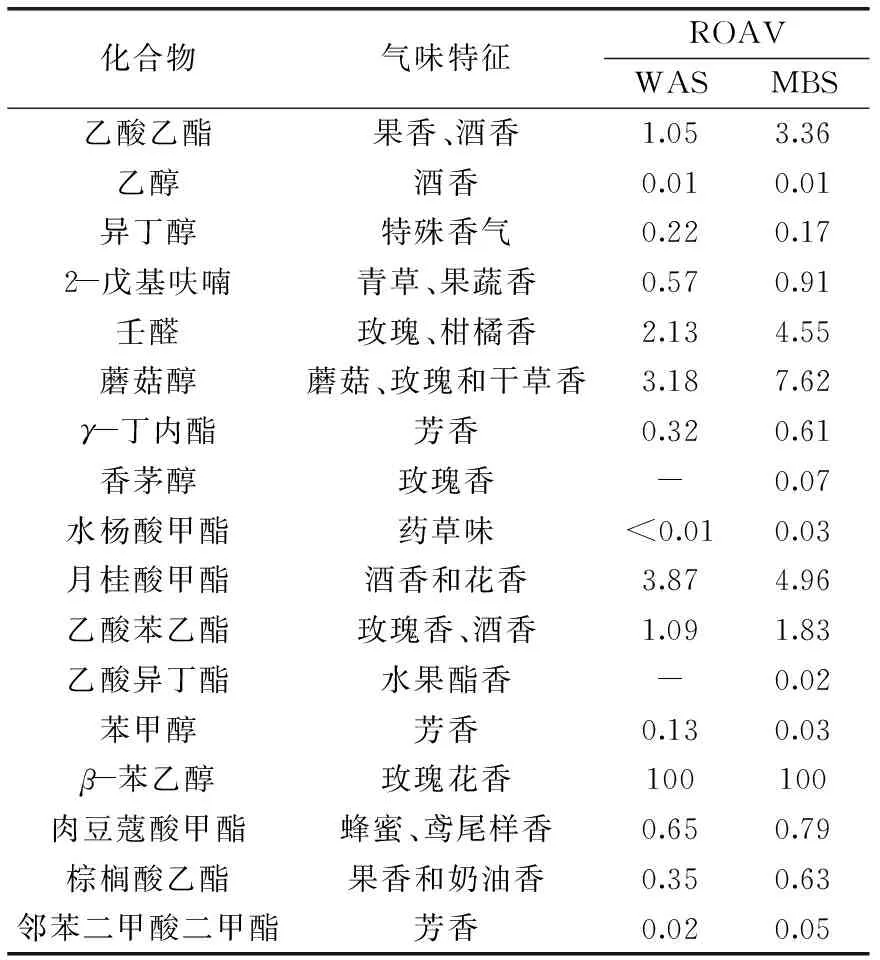
表3 荞麦馒头样品挥发性成分的相对气味活度值及其香气特征
2.4 荞麦馒头的感官特性得分
如图6所示,经过酸面团发酵,馒头的外观和质构有了明显的改善。M-4的加入增加面团的发酵性能使馒头比容增大,J28产胞外多糖的特性能够增加面团的吸水性、稳定性和持气性,从而增加馒头的延展性,提高馒头芯囊细腻度[35]。从图7可以看出,经过酸面团发酵,荞麦馒头的风味、外观、颜色、硬度以及内部结构得到明显改善,这与微生物在酸面团发酵过程中的生长代谢,尤其是乳酸菌代谢产生的胞外多糖密不可分。对比KBS和WAS组发现,酵母菌发酵主要改善荞麦馒头的风味,但是对其内部结构有不利影响;对比KBS和WCS发现,乳酸菌发酵能明显改善荞麦馒头的外观、颜色、硬度和内部结构,但是其风味改善作用不明显且酸味较强。在整体接受度中,MBS组的得分最高,经过酵母菌和乳酸菌的协同作用,能够获得更加浓郁的香气,更加细腻的质构和更加柔软饱满的外观。
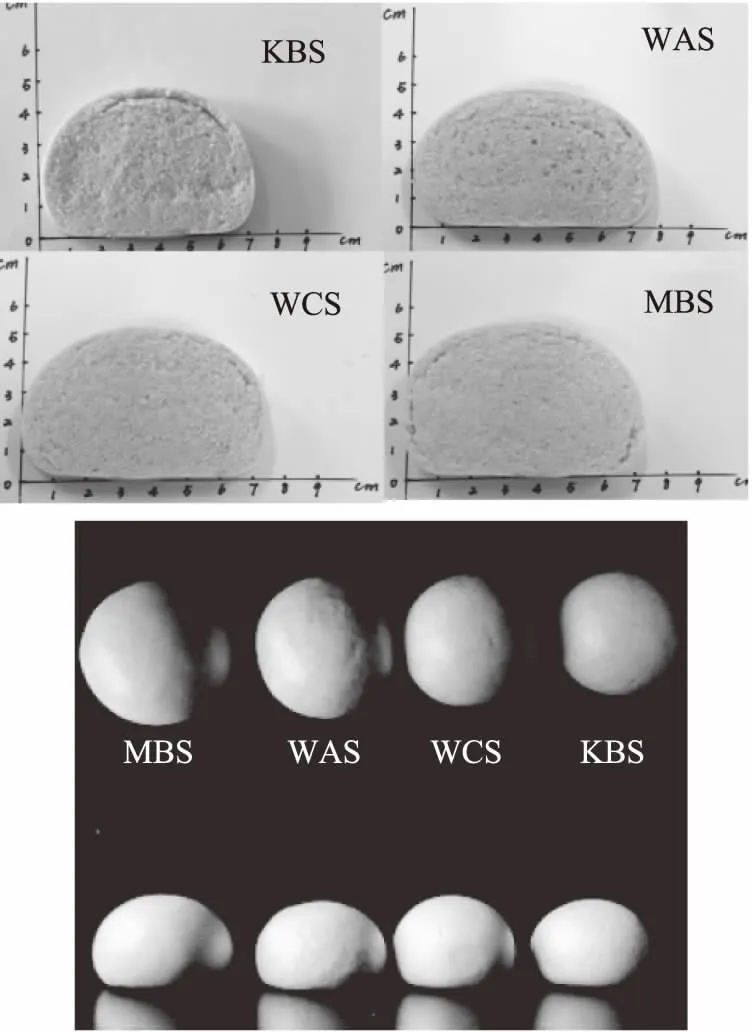
图6 不同荞麦馒头样品的外观质构图片

图7 不同荞麦馒头的感官评定雷达图
3 结论
异常威克汉姆酵母菌的存在能够促进融合魏斯氏菌的生长,且乳酸菌的存在也能够延缓酵母菌的衰亡,二者在荞麦酸面团体系中具有共生作用。电子鼻技术研究结果表明,经发酵后的荞麦酸面团香气具有显著差异性,混菌发酵组香气明显高于单菌发酵组,根据电子鼻输出的雷达指纹图谱分析得到其特征香气物质为乙醇、乙酸、乙酸乙酯、乙偶姻和异戊醇,其中乙酸乙酯风味阈值最低,香气贡献最大。对各组荞麦酸面团馒头进行风味物质分析发现,KBS、WCS、WAS和MBS样品分别检测出55、51、53和56种风味物质,检测出的风味物质主要由醇类、酯类、酸类、杂环芳香类、烷烃类、萜烯类、羰基化合物类等组成。其中,混菌发酵组酯类物质相对含量明显高于单菌发酵组,呈现更浓郁的果香和酒香,结合ROAV分析,混菌发酵荞麦馒头的风味强度明显高于单一乳酸发酵和单一酵母发酵,并在感官评定中取得最高的整体接受度。本研究通过混菌发酵的方式,研究荞麦馒头中的香气物质,为开发具有新型天然生物发酵香气特征的、少用或者不用化学添加剂的工业化烘焙产品提供了基础理论指导。
