基于CT灌注成像的肺癌疗效评估方法初探
2018-09-13李素素肖建宇刘竹君汪源源
李素素,肖建宇,张 坤,刘竹君,郭 翌,汪源源
1. 复旦大学电子工程系,上海 200433;2.上海市医学图像处理与计算机辅助手术重点实验室 上海 200032;3. 天津医科大学肿瘤医院放射科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津 300060;4. 天津医科大学肿瘤医院肺部肿瘤内科,天津 300060
肺癌是全球发病率较高的癌症之一[1-2],因发病初期无明显症状,患者极易错过最佳治疗时期。晚期肺癌通常无法手术切除,死亡率较高[3]。近年来血管靶向治疗给晚期肺癌患者带来了福音[4-5]。肿瘤生长依靠内部新生血管为其输送营养,通过抗血管生成靶向药物治疗可抑制肿瘤内部血管生长或使其慢慢消失[6]。
CT灌注成像是一种功能成像技术,通过静脉注射造影剂,获得造影剂通过肿瘤内部血管的血流(blood flow,BF)、血容量(blood volume,BV)等灌注参数,并通过伪彩色处理获得对应的伪彩色图像,可反映肿瘤内部的微血管分布及血流灌注情况[7-9]。如表1所示,不同的参数对应不同的图像类型。相比于传统CT图像只能从形态学角度评估肿瘤,CT灌注成像可以在肿瘤形态学未发生变化时观察到其内部血管血流参数的变化,反映肿瘤的血流动力学信息,适用于血管靶向治疗的评估[10-12]。图1为典型的肺癌CT灌注图像,其中图1A为最大密度投影(maximum intensity projection,MIP)图像;图1B为血流量的彩色编码图像,图中颜色越接近红色表示相应的灌注参数值越大。其他灌注参数图像也为类似的彩色编码图像。
本研究根据肺癌CT灌注图像特点,结合水平集分割方法和图像形态学处理方法,提出了改进的距离规则化水平集分割方法(modified distance regularized level set,MDRLS)用于MIP图像中肿瘤的分割。然后,将分割得到的区域逐层映射到其他CT灌注参数图像上,通过选取合适的阈值,分割出肿瘤的血管丰富区域,分别计算肿瘤和内部血管丰富区域的体积,并进行三维展示,最后比较其与临床数据的相关性。
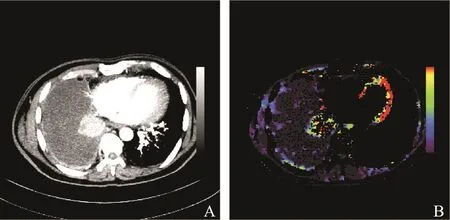
图 1 典型的肺部CT灌注图像
1 资料和方法
本研究在MATLAB R2014a环境中进行。图2为本研究算法流程,共分为4个步骤:图像采集,肿瘤和肿瘤内血管丰富区域的分割,肿瘤和内部血管丰富区域的体积计算,三维显示。

图 2 算法流程图
1.1 图像采集
本研究在天津医科大学肿瘤医院采集了5例患者靶向药物治疗前后的影像,共分为16次检查。每个患者第1次检查均为未治疗,采用血管靶向治疗后,定期随访进行CT灌注影像检查。CT机器型号为SIEMENS_MMWPE36A,图像层厚为1.5 mm。除1例患者只有MIP、BF、BV这3个参数图像外,其余4例患者均包括7个参数图像。

表 1 CT灌注成像的图像类型
1.2 图像分割
主要分为两部分:肿瘤分割和血管丰富区域分割。首先,在MIP灰阶图像上采用MDRLS方法进行肿瘤分割,分割的边缘如图3A中红色标出区域所示;然后,将肿瘤位置逐层映射到BF等其他彩色灌注参数图像上,图3B中白色圆圈标出对应的肿瘤区域;最后,通过选取合适的阈值,完成对BF、BV等灌注图像肿瘤内部血管丰富区域的分割。
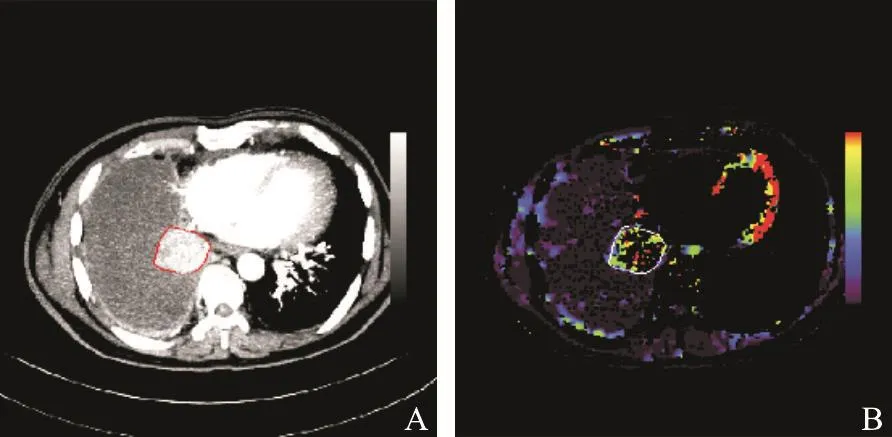
图 3 肿瘤边缘映射过程图
1.2.1 肿瘤区域的分割
肿瘤区域的分割由经验丰富的影像科医师在MIP图像上手动绘制完成,但是每位患者的CT灌注图像层数较多,随着患者数量的增加给医师带来繁重的工作量,因此需要尝试一种计算机辅助的CT灌注图像分割方法。肺癌原发灶通常边界不明显,肿瘤内部灰度分布不均匀,传统的边缘检测算法较难准确地分割肿瘤。DRLS算法[13]可以较好地处理该问题。本研究将DRLS算法用于多层CT灌注图像处理,并结合形态学中的边界提取、区域填充和腐蚀方法提出了MDRLS算法。
CT灌注图像通常有多层。首先,需要在第一层MIP图像上选取包含肿瘤的矩形感兴趣区(region of interest,ROI),矩形区域的边缘在算法指导下演化并最终收敛于肿瘤区域的边缘。然后,将第一层的肿瘤边缘作为第二层的初始ROI,在算法指导下收敛于第二层肿瘤的边缘;依次处理,直到得到最后一层图像肿瘤的边缘。
本研究算法定义水平集函数的能量函数ε(z)为:
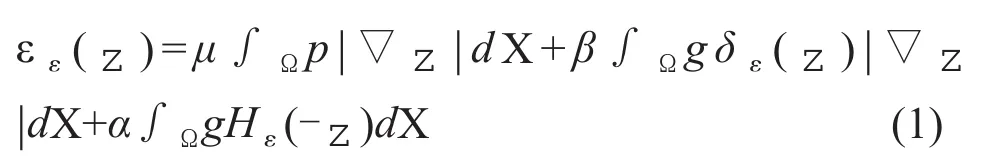
其中z为水平集函数,边缘指示器函数g定义为:

其中I为图像,Gσ是一个标准差为σ的高斯核,δε(z ) 和Hε(-z) 分别是狄拉克函数和海维赛德函数。
通过对式(1)求解,可以最小化水平集能量函数:
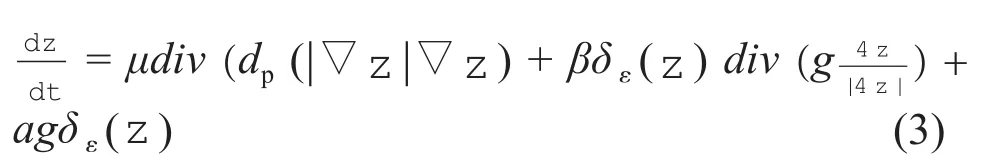
由于CT灌注图像不同层间存在一定的层厚,导致垂直方向上肿瘤边缘的不连续性,下一层图像和上一层图像的边缘可能相差很大,直接使用DRLS算法进行肿瘤区域的分割会出现过分割的现象。本研究提出的MDRLS算法结合了形态学中的边界提取、区域填充和腐蚀方法,获得了较好的分割结果。
图4给出了1例肺癌MIP多层图像的分割结果,其中4C~4F是局部放大图,图4B红色所示为矩形ROI,图4D、4F红色所示为收敛结果。
1.2.2 血管丰富区域的分割
肿瘤血管生成可以引起肿瘤微血管密度的变化,在活体状态下表现为血流灌注增加[14]。因此,血管丰富区域在CT灌注图像中表现为具有较高的灌注参数,图像颜色偏红。本研究分别选取彩色编码的阈值1和阈值2,采用阈值法分割得到不同肿瘤内部血管丰富区域,阈值的确定是多次试验得到的经验值。
如图5所示,红色直线表示阈值1,蓝色直线表示阈值2,左边为BV、BF、PMB的彩色编码图像,右边为MTT、TTP和TTS的编码图像。其中BV、BF、PMBP对应的阈值1为(R,G,B)=(255,0,0),阈值2为(R,G,B)=(224,32,32);MTTA、TTP、TTS对应的阈值1为R=255,阈值2为R=198。
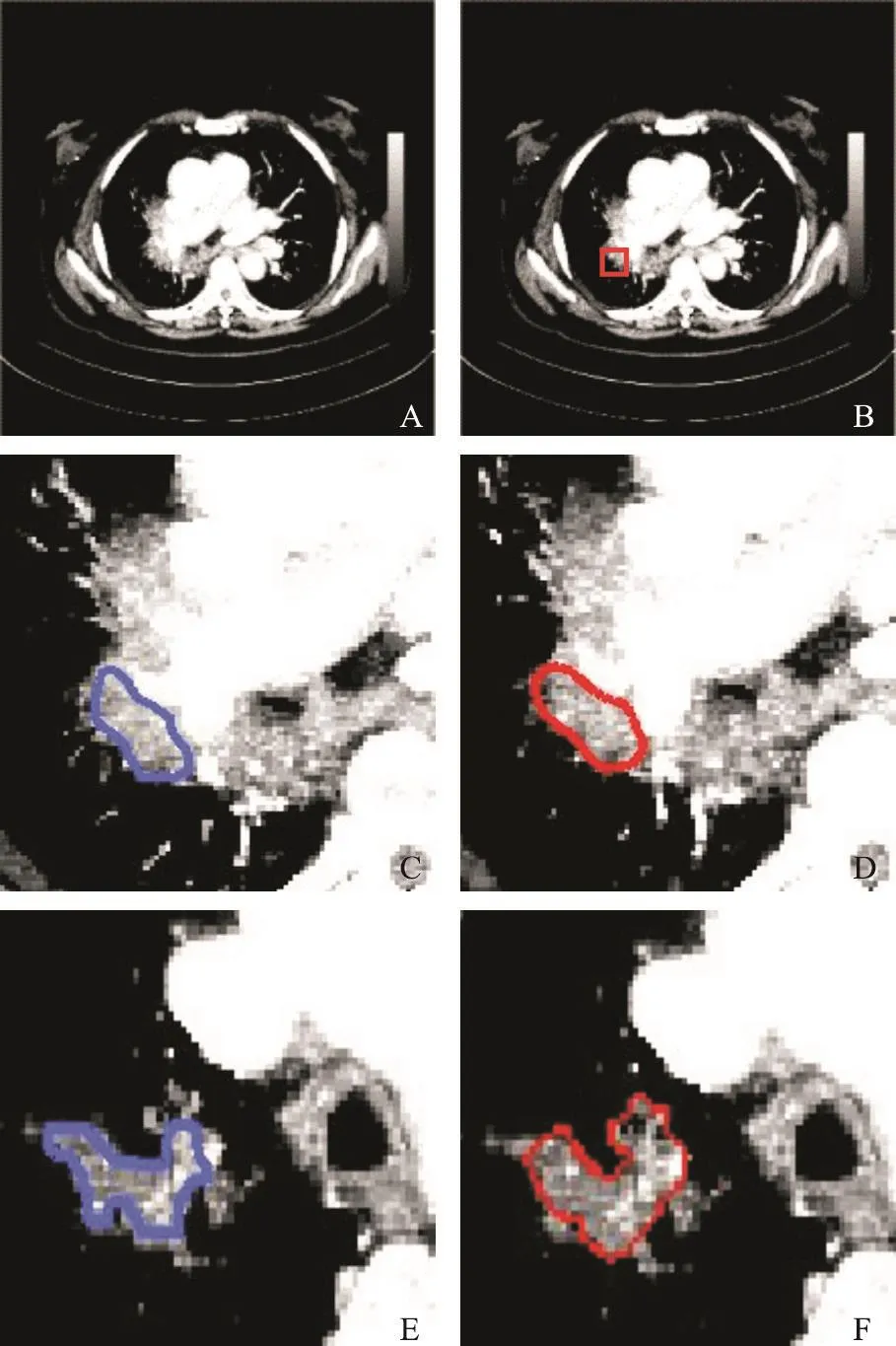
图 4 肺癌多层图像分割
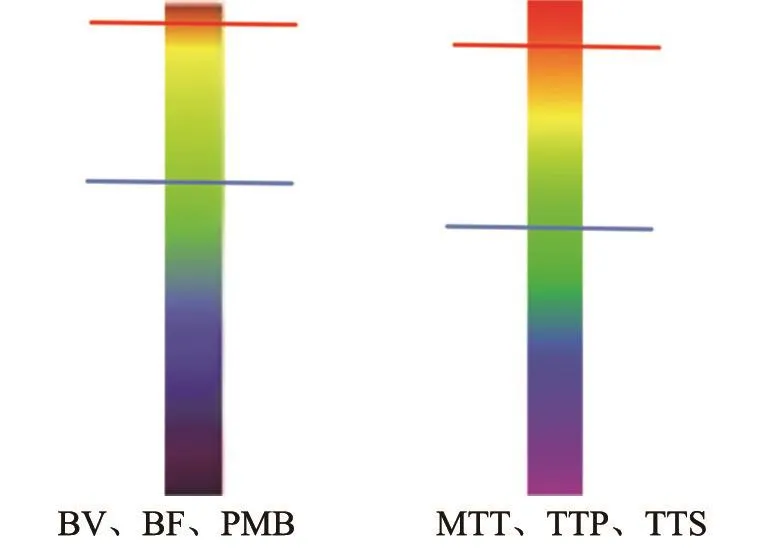
图 5 阈值的选取
1.3 体积计算
肿瘤和血管丰富区域的体积计算公式为:
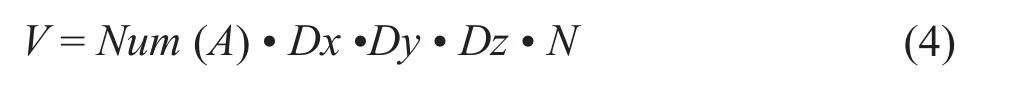
其中V表示肿瘤体积或血管丰富区域的体积,A表示分割得到的肿瘤区域或血管丰富区域,Num(•)表示分割区域包含的像素点个数,Dx、Dy分别表示图像在x和y方向的像素间距,Dz表示断层扫描的图像在z方向上的厚度,N指患者1次检查中包含肿瘤区域的断层图像的张数。
1.4 图像三维可视化
为了便于直观地了解肿瘤的形态以及灌注参数的情况,本研究对肿瘤进行三维显示。图6为某位患者治疗前后的示例,其中半透明部分为肿瘤,亮红色区域为肿瘤内血管丰富区域,治疗前和治疗后分别表示了药物治疗前后的检查情况。
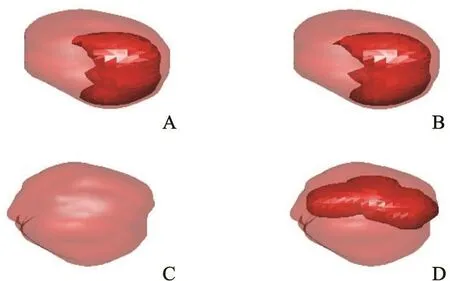
图 6 不同检查时期不同阈值三维显示对照图
2 结 果
图4D、4F红色所示为肿瘤分割结果,图4C、4E黑色所示为手工标记的金标准。本研究采用豪斯多夫距离(Hausdorff distance)[15]来评价分割的效果,双向豪斯多夫距离可以用来度量两个点集间的最大不匹配度。本研究将肿瘤边缘金标准的位置和分割结果的肿瘤边缘位置分别作为两个点集,对每次检查期间MIP图像分割结果的豪斯多夫距离求均值,得到平均豪斯多夫距离,该值越小表明分割效果越好。
平均豪斯多夫距离的统计结果如图7所示。图中每个点表示1次检查中多层图像肿瘤分割的平均豪斯多夫距离。
本研究中所有检查(16次)的平均豪斯多夫均值为10.58,方差为38.08。可见,本研究提出的MDRLS算法总体分割效果良好。
对5例患者治疗前后的检查结果进行统计分析。图8为某患者5次检查结果的统计图,其中MIP参数代表的是肿瘤体积。
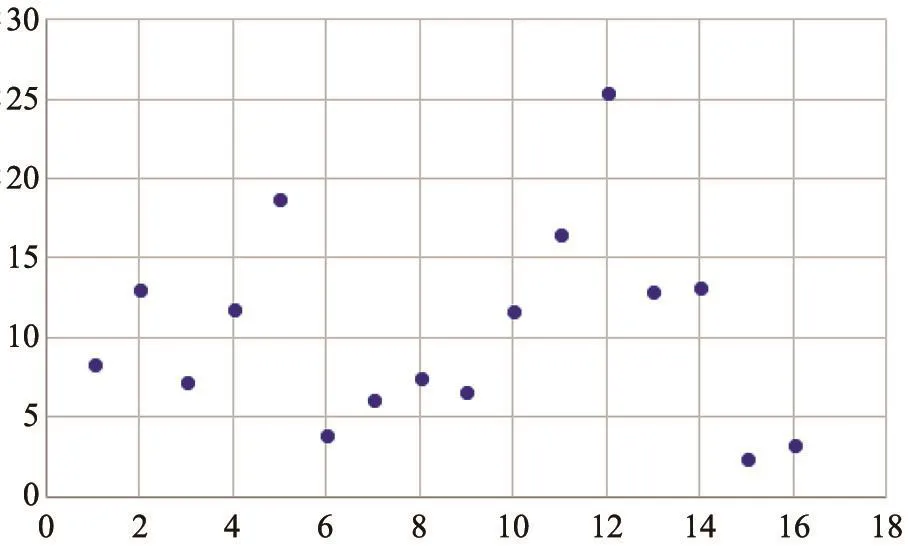
图 7 平均豪斯多夫距离分布图
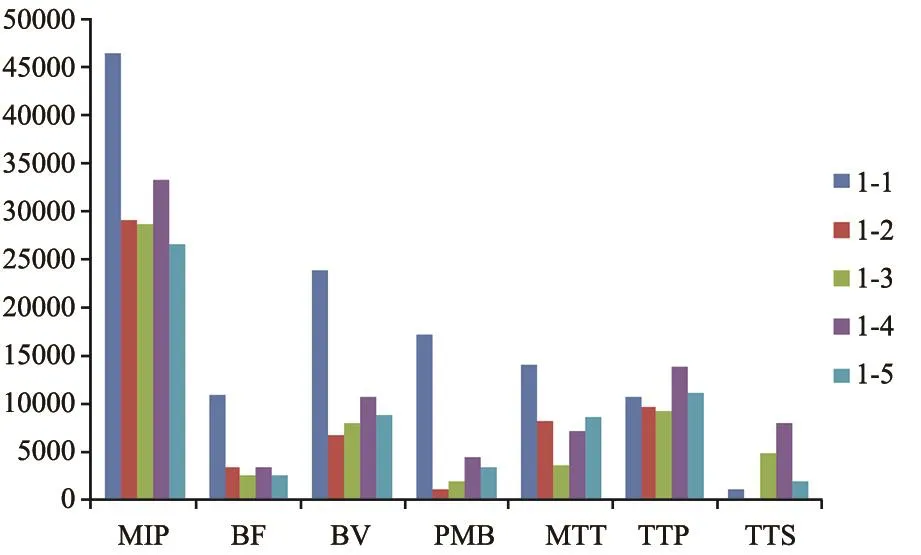
图 8 某患者5次检查结果统计图
3 讨 论
治疗前后检查结果的统计分析表明,使用抗血管生成靶向药物治疗后,总体趋势上患者的BF、BV和PMB均有所下降,表示微血管密度计数降低,即血管生成程度降低,因此恶性生物学行为能力也随之降低[16]。但发现,MTT与肿瘤血管生成无明显相关性[17]。在图6的三维显示结果中,通过观察阈值1和阈值2,均可见靶向治疗后血管丰富区域缩小,表明患者的病情得到一定改善,与临床病理检查结果显示5例患者的病情都得到了控制相吻合。因此,可以选取BV、BF和PMB共3个灌注参数作为肺癌的计算机辅助疗效评估的指标。
本研究初步探索了采用计算机辅助诊断方法对肺癌血管靶向治疗效果进行评估的方法。利用MDRLS方法处理多层图像分割及图像分割中过分割的问题,较好地实现了肿瘤区域的分割,并有效计算出肿瘤和肿瘤内血管丰富区域的体积。结果表明,本研究提出的基于计算机辅助诊断的MDRLS方法可以快速有效地对肺癌术后疗效进行评估,有望为临床治疗提供重要参考。
