超声引导下经皮肾脏肿瘤射频消融术的早期经验
2018-09-13郭芳,李佳,陈磊,胡兵
郭 芳,李 佳,陈 磊,胡 兵
上海交通大学附属第六人民医院超声医学科,上海超声医学研究所,上海 200233
超声引导下经皮射频消融(radiofrequency ablation,RFA)技术是一种能将肿瘤原位灭活的新兴微创疗法,在肝脏肿瘤的治疗中有显著疗效,临床应用日趋成熟。但对于肾脏肿瘤,RFA的应用还处于探索性阶段。本研究主要对超声引导下RFA治疗肾脏肿瘤的疗效及并发症进行评估。
1 资料和方法
1.1 适应证
本研究主要选择:① 肾肿瘤伴严重慢性疾病患者(如冠心病、糖尿病、高血压等);② 合并慢性肾功能不全的肾肿瘤患者;③ 孤立肾(先天性/曾行单侧肾肿瘤根治术/出现对侧转移),若再行外科手术有损失肾脏风险的患者;④ 双侧多发肾肿瘤患者;⑤ 不愿接受密切随访,对于自身不明性质的肾脏肿瘤希望采取非外科手术治疗的患者。⑥ 肾脏转移性肿瘤患者,疾病稳定,可行RFA使局部肿瘤得到控制且降低肾功能逐渐丧失的风险。
1.2 患者特征
2002年6月—2011年12月共选取31例肾脏肿瘤患者(男性25例,女性6例)接受RFA治疗,随访时间大于1个月。患者平均年龄59.6岁(31~78岁),肿瘤平均最大直径(32.3±14.7)mm(13~77 mm),患者详细特征见表1。本研究中31例肾脏肿瘤患者行RFA治疗,其中将肿瘤完全灭活作为治疗目标者28例,以姑息治疗为目的者3例。

表 1 射频消融治疗肾肿瘤的患者特征(31例患者)
1.3 仪器与方法
本研究前期采用美国RITA公司的RITA1500射频治疗仪器和StarBurst SDE多极射频电极针,后期用美国VALLEYLAB公司的冷循环超能射频肿瘤治疗系统和冷循环电极对肾脏肿瘤进行治疗。超声仪器采用意大利ESAOTE公司生产的TechnosMPX DU8彩色多普勒超声诊断仪和MyLabTM90彩色多普勒超声诊断仪,配专用穿刺探头CA411及CA621型凸阵探头(频率为2~4.5 MHz)或CA431型凸阵探头(频率为2.5~5.0 MHz)。两种仪器中均内置实时造影匹配成像技术(contrast-tuned imaging,CnTI)。
患者术前均行CT或MRI检查。前期工作中,先行超声引导下对电极布针进行可行性评估,保证在二维超声图像或超声造影图像上能大致了解肿瘤的大小、位置、特征及与周围组织的毗邻关系等。肿瘤在肾的位置,依肾脏长轴划分为上极、中部和下极;并详细定位为外生型、肾实质型及中央型。根据2000年Gervais等[1]对肾肿瘤位置的定义,“外生型”指肿瘤生长突出肾被膜延伸至肾周脂肪,但不侵犯肾窦;“肾实质型”指肿瘤仅生长于肾实质中,既不侵犯肾周脂肪也不侵及肾窦;“中央型”指肿瘤生长于肾窦或压迫肾窦(图1)。
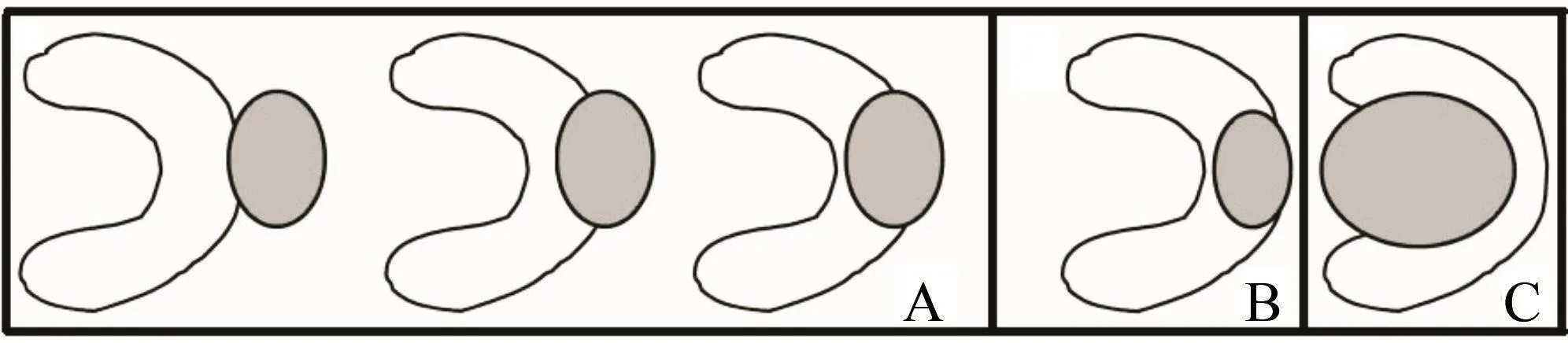
图 1 肾肿瘤位置(阴影部分为肾肿瘤)
患者在接受RFA之前先行肾脏肿瘤穿刺活检术,以取得病理结果进行组织学评估,一般用16~18 G Tru-Cut针配巴特自动枪对肾脏肿块进行穿刺活检。
RFA治疗原则:最大限度消融肿瘤,且确保毗邻组织不受热损伤,以免严重并发症的发生。需多次进针或调整电极针方向时,治疗一般先从肿瘤的远端深部开始,然后治疗肿瘤近端表浅区域。体积大且血供丰富的肿瘤,先灭活血供最丰富的部分,再灭活剩余病灶。肿瘤治疗时呈现强回声及范围变化可观察肿瘤消融过程变化(图2)。尽量保证最终消融范围覆盖整个肿瘤体积。当取出电极时,对针道进行烧灼处理后退针,以减少出血和肿瘤种植传播的风险。记录总的治疗时间,消融结束后记录组织温度。
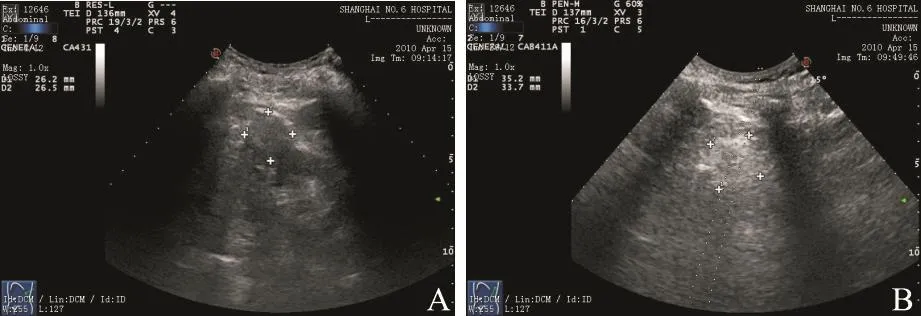
图 2 RFA治疗前、治疗中肿瘤超声图像变化
术后患者卧床休息6 h,予以常规抗炎、止血等治疗,术后24 h内复查超声,患者至少住院观察3 d后方可出院。
1.4 随访模式及方法
本研究主要以二维超声及超声造影为主要随访模式,增强CT或MRI为辅。依照图像引导下肿瘤消融的准则,认为消融区域完全覆盖肿瘤体积才是RFA成功的关键[2],超声造影图像上观察应为射频区域完全无造影剂灌注的表现。注射造影剂后CT值增加<10 HU,或MRI信号增强<15%的图像也是评价肿瘤完全消融的依据[3]。1个月内随访出现增强征象考虑为不完全消融,若在之后的随访中出现则考虑为复发。局部肿瘤复发主要表现为肿瘤体积增大,或原本消融完全后随访时发现在治疗处或紧邻治疗部位的图像有新的造影剂灌注表现。不完全消融或复发的患者可行再次RFA治疗。RFA的总成功率定义为重复消融后达到完全消融的肿瘤个数与总肿瘤个数的比值。
1.5 统计学处理
应用SPSS 19.0软件包建立数据库及进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 病理学检查
26例(26/31)肿瘤患者在行RFA术前对肿瘤进行穿刺活检。病理学检查结果显示,12例为肾透明细胞癌,2例为乳头状肾癌,1例为肾乳头状移行上皮癌,2例为转移癌(转移性腺瘤和转移性肉瘤),1例为肾嗜酸细胞瘤,2例为肾血管平滑肌脂肪瘤,1例为肾脏腺瘤,5例病理不确定。
2.2 RFA成功率
31例肾肿瘤中,28例以灭活肿瘤为目标,RFA术后首次影像学检查显示,22例未发现超声造影剂灌注或CT/MRI图像增强征象,因此初次RFA成功率为78.6%(22/28)(图3)。6例在RFA术后影像学表现出不完全消融的征象,均接受第2次RFA治疗,且4例达到完全消融;1例在接受3次RFA治疗后达到完全消融。由此推算,RFA总成功率为96.4%(27/28)。
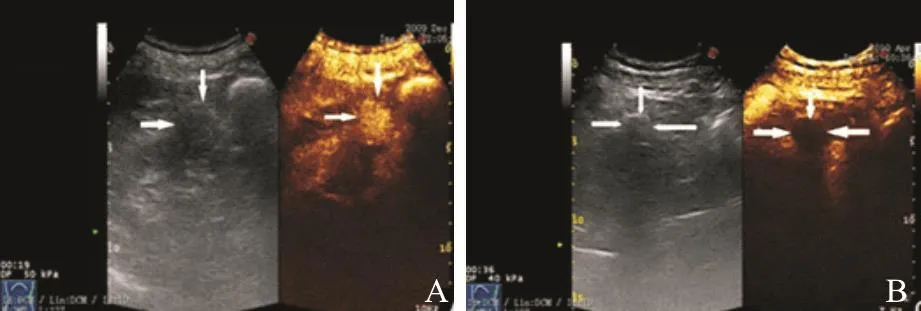
图 3 肾肿瘤完全消融前后超声图像
2.3 治疗后患者随访情况
患者平均随访时间为24.6个月(1~96个月)。射频消融前肿瘤平均最大直径为(32.3±14.7)mm,射频消融后消融灶平均最大直径为(21.8±13.1)mm,即在平均随访时间内肿瘤平均最大直径缩小32.5%(10.5 mm),差异有统计学意义(P<0.05)。
经RFA治疗后,原本没有肾癌病史的患者均未检测出肿瘤转移征象,也无RFA电极拔出道中肿瘤生长的病例。在随访过程中,完全消融的27例肾肿瘤中有2例(7.4%)出现局部复发,复发时间分别为12个月、38个月(平均复发时间为25个月)。复发肿瘤的病理学检查结果1例为肾乳头状移形上皮癌,另1例病理性质不明确,但患者为独肾(一侧肾肿瘤根治术)且切除的肾脏病理学检查结果为肾透明细胞癌。2例患者因年纪较大,均伴有严重慢性疾病,故未进一步行RFA治疗复发灶。
2.4 RFA成功因素
首次RFA后,不完全消融组和完全消融组肿瘤直径分别为(41.0±14.5)mm和(27.1±10.2)mm,不完全消融组中肿瘤直径明显大于完全消融组(P=0.017),表明肿瘤直径是影响RFA成功的重要因素。将肿瘤直径分别以30、35及40 mm为分界点,分为肿瘤直径≤30 mm组和>30 mm组、≤35 mm组和>35 mm组、≤40 mm组和>40 mm组。采用Fisher精确检验,发现肿瘤直径≤30 mm及≤35 mm时,与肿瘤完全消融具有相关性(P=0.022、0.021),而≤40 mm时则无统计学意义(P=0.285)。由此可见,肿瘤直径35 mm可作为评价RFA成功的临界值(表2)。此外,患者年龄、性别、肿瘤位于左肾或右肾、肿瘤在肾中的位置(上/中/下极)及肿瘤类型(外生型/肾实质型/中央型)等与肿瘤是否能完全消融或是否出现局部复发均无明显关联。
2.5 并发症
本研究31例患者中,70%术后出现射频区疼痛或牵拉痛,但持续时间较短,不用药物干预即可缓解;11例(35.5%)患者出现一种或多种自限性并发症(表3)。
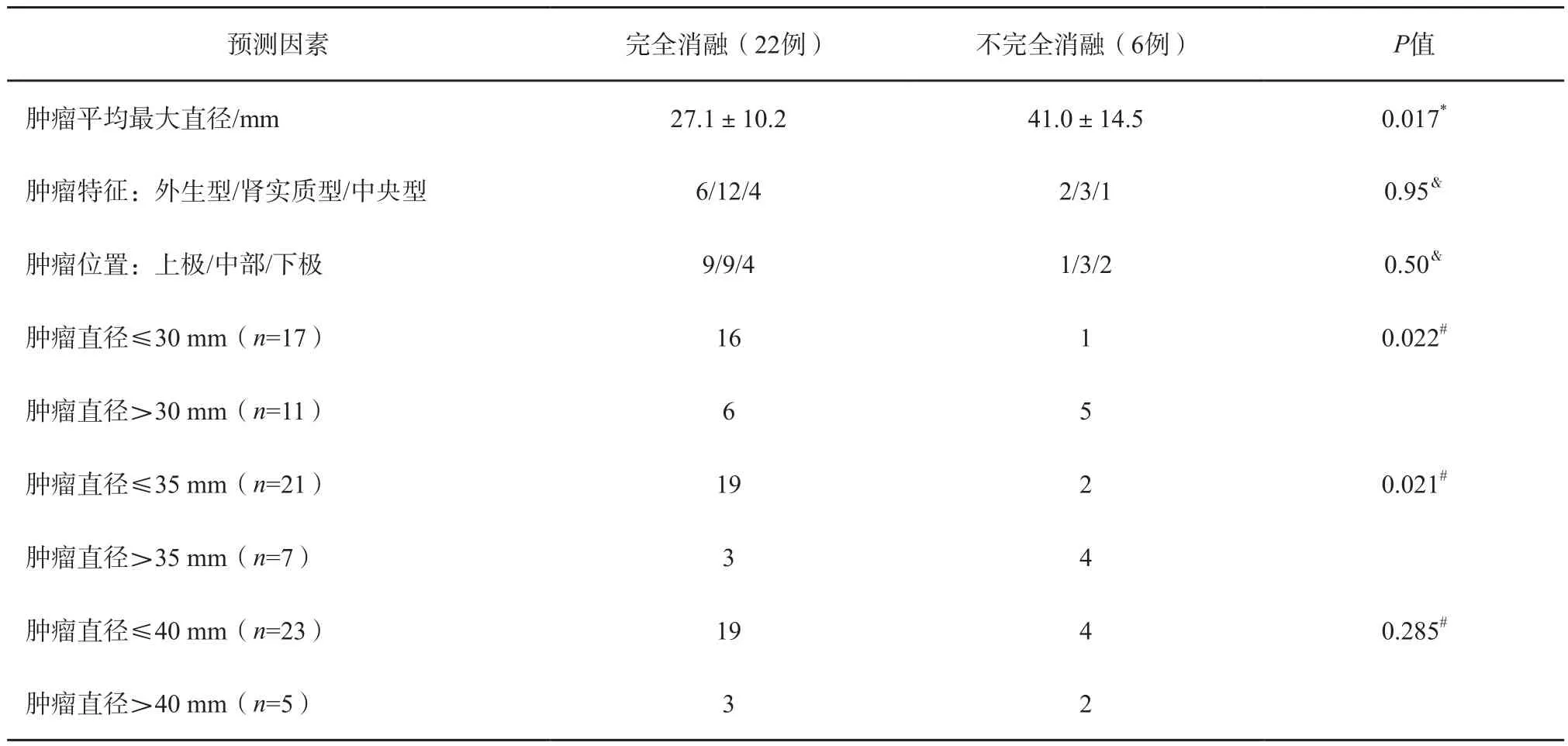
表 2 首次RFA后影响肾肿瘤完全消融的主要因素分析
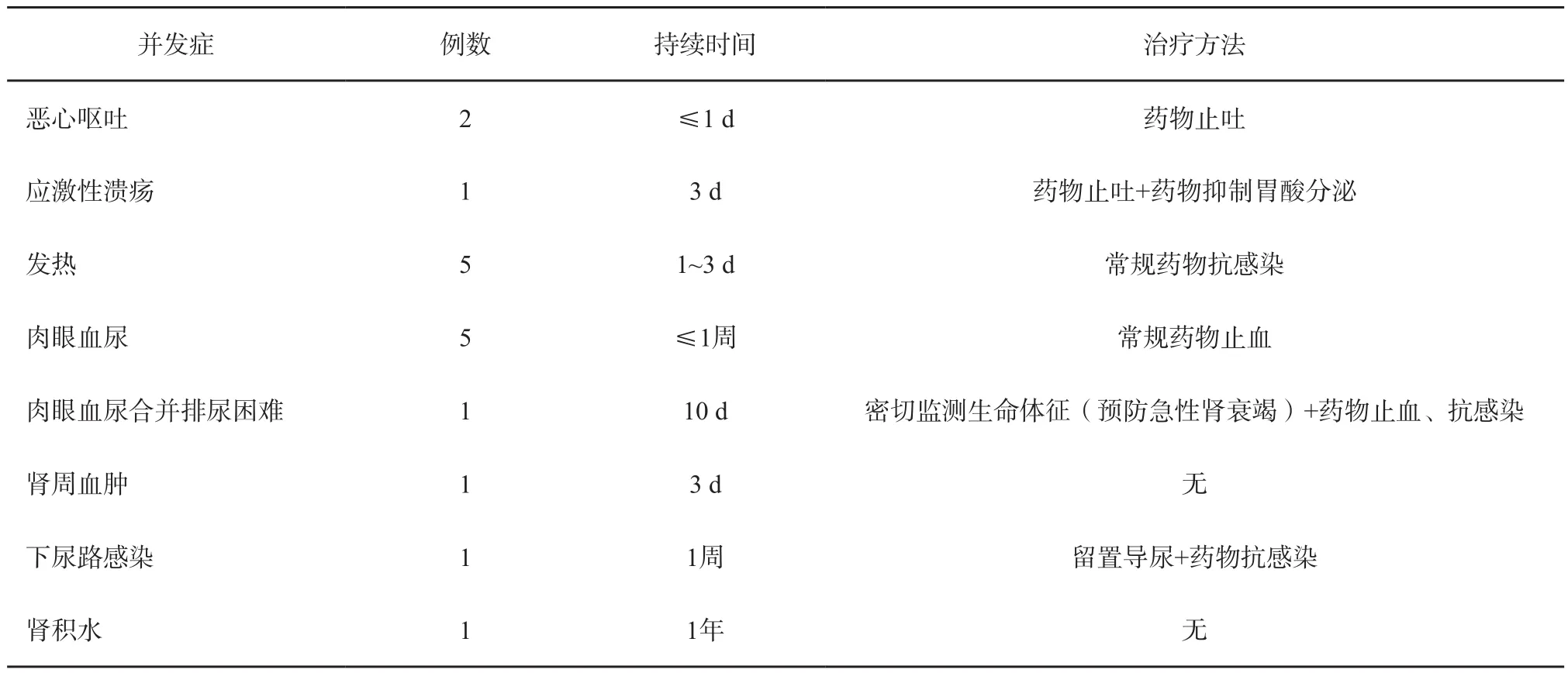
表 3 RFA治疗肾肿瘤后的并发症
3 讨 论
RFA对于体积小的肾肿瘤来说,是一项保留肾单位的微创技术。其原理是在超声或CT等影像设备引导下,将射频电极针直接插入肿瘤组织内,通电后交变电流使电极针周围组织发生离子振荡,摩擦产热,并传导至邻近组织,产生球形或类球形消融区,使电极针周围的肿瘤组织脱水、干燥,继而产生凝固性坏死,达到灭活肿瘤的目的[3]。
本研究31例患者的31个肿瘤治疗目标分为2种:3例行姑息减瘤治疗,28例期望达到肿瘤完全灭活。期望肿瘤完全消融灭活的病例中,初次RFA治疗肾肿瘤成功率为78.6%(22/28),RFA治疗肾肿瘤总成功率达96.4%(27/28),与国外报道的超声引导下或CT引导下经皮RFA治疗成功率基本一致[1,4-7],并且肿瘤在RFA治疗后明显变小,证实了RFA治疗肾脏肿瘤的有效性。
Kunkle等[8]通过Meta分析发现,RFA治疗肾脏小肿瘤后(无论经皮还是腹腔镜下),肿瘤平均复发率为11.7%。本研究局部复发率(7.4%)与Kunkle等报道的结果相比较低。考虑肿瘤的复发原因:① 可能与肿瘤的恶性程度及肾癌病史相关,即肿瘤恶性程度高或患者有肾癌病史,则肿瘤复发概率高。本研究中2例肿瘤复发,1例病理为肾乳头状移行上皮癌,另1例病理性质不明确,但患者为独肾(一侧肾肿瘤根治术)且切除的肾脏病理结果为肾透明细胞癌。这对以后研究中患者的选择及RFA治疗的预后评估分析可能有一定价值。② 不能排除超声引导下图像质量的局限性或穿刺活检后局部出血边缘模糊导致射频电极的布针结果没有达到最优,而存留了不易被影像学检出的微小病灶。在超声引导下RFA过程中,于消融处短时间内会出现一片高回声区,可用来大致估计RFA诱导细胞损伤的范围。但在肝脏肿瘤RFA中,已通过病理学检查证明强回声区不一定与肿瘤坏死范围完全一致[9],且强回声区的出现可能会影响超声图像的能见度,对重置电极进行重叠消融带来困难。③ 行RFA治疗时应尽可能使消融灶直径大于肿瘤直径,但某些外生型肾脏肿瘤紧邻周围肠道,或中央型肿瘤贴近肾盂或输尿管时,可能导致进针角度或范围受限。操作时尽量覆盖整个肿瘤,但不能避免微小病灶残留,且影像学随访对微小病灶的检出率较低[10]。
肿瘤局部复发强调了密切随访的重要性。超声造影检测肿瘤内血流灌注的灵敏度较高,可以早期发现残余灶和复发灶,因此在RFA后1周内行超声造影检查,可以检测肿瘤是否完全消融;增强CT在RFA后1个月进行,因为RFA治疗后肿瘤坏死组织周围会反应性充血[3],当即CT检查可能出现假阳性。之后每隔2~3个月行超声造影随访,同时每6个月查1次增强CT或MRI,将两种影像学结合以更好地评估RFA疗效。本研究结果虽然未显示何种单一因素与复发相关,但复发组中肿瘤体积普遍偏大;患者平均复发时间为25个月,提示需要长期影像学随访。
如前所述,影响初次RFA治疗后肿瘤完全消融的最大因素是肿瘤大小,≤3.5 cm的肾脏肿瘤更易完全消融,>3.5 cm的肿瘤得到完全消融的概率明显降低。本研究并未发现其他因素如患者年龄、性别、肿瘤位于左肾或右肾、肿瘤在肾中的位置(上/中/下极)及肿瘤类型(外生型/肾实质型/中央型)等与肿瘤不完全消融有相关性。但有研究认为,RFA治疗的成功率与中央型肿瘤密切相关,因其附近的大血管因血流作用而疏散了电极产生的热量,从而降低RFA的效能[5],且其毗邻结构复杂,破坏肾窦结构的风险较大[7]。因此,为避免严重并发症的发生,在患者选择及布针方案方面需慎重。如扩大中央型和肾脏下极内侧等部位的样本量,有可能改变肿瘤位置对肿瘤消融残留或复发的统计学结果。
国外文献已报道的与RFA治疗相关的并发症包括血尿、肾周出血、输尿管狭窄、肾结肠瘘形成、肠穿孔、消融道的肿瘤种植、暂时性神经病变、腰大肌热损伤及逆行性感染引发肾脓肿等[6-7,11-13]。一项Meta分析的结果显示,RFA的并发症比手术治疗少,严重并发症的平均发生率为3.1%[11]。本研究中患者并发症均为自限性,其中1例患者术后出现血尿伴排尿困难持续10 d左右,期间对症治疗效果并不显著,考虑因为其肿块接近肾盂,可能会损伤集合管而引起血尿,故不能排除肿瘤的坏死组织或小凝血块排出时阻塞尿路而导致患者排尿困难,后行导尿缓解了症状;另有1例患者RFA术后出现轻度肾积水,持续1年后恢复,考虑该患者肿瘤紧贴肾盂和输尿管,治疗时难免会对两者造成热损伤。此外,没有1例患者因RFA治疗引起肾功能严重降低,表明超声引导下经皮RFA是安全的,可以作为肾肿瘤患者除外科手术以外的一种微创治疗方法。
超声引导下经皮RFA是一种保留肾单位的微创疗法,对直径≤3.5 cm肾脏肿瘤原位灭活的效果显著,相比外科手术具有并发症发生率低、恢复期短等优势,但仍需长期影像学随访观察肿瘤消融后的变化情况。作为相对新兴的治疗技术,超声引导下经皮RFA的远期疗效在国内外均无详尽报道,与外科保守性手术相比,究竟哪种方法对患者长期生存质量更有利,还需累积更多的临床经验,进一步的循证医学研究也是有必要的。
