复方地黄颗粒和毛蕊花糖苷治疗帕金森病模型大鼠的作用靶标研究
2018-09-12梁建庆何建成
梁建庆,何建成
帕金森病(Parkinson's disease,PD)是好发于中老年人的中枢神经退行性疾病,其主要病理改变是中脑黑质致密部多巴胺能神经元(dopaminergic neuron)退行性变,黑质-纹状体多巴胺(dopamine,DA)减少,酪氨酸羟化酶(tyrosine hydroxylase,TH)活性下降。目前,PD的防治药物主要是左旋多巴,但长期服用可引起异动症[1]。本课题组前期动物实验及临床研究发现,复方地黄颗粒及其主要成分毛蕊花糖苷治疗PD有效。基于此,本研究建立PD大鼠模型[2],探讨复方地黄颗粒和毛蕊花糖苷治疗该病的作用靶标,为新型PD治疗药物开发奠定基础。
1 材料与方法
1.1 主要药物及试剂 复方地黄颗粒由熟地黄、白芍、钩藤、珍珠母、丹参、石菖蒲、全蝎等组成(上海中医药大学中药制剂实验室提供),使用前用蒸馏水稀释成灌胃液;毛蕊花糖苷由上海中医药大学中药制剂实验室提供。戊巴比妥钠(上海中西药业股份有限公司);庆大霉素(上海第一制药厂,0.3g/支);美多芭(上海罗氏制药公司,0.25g/片);6-羟基多巴胺(6-OHDA)、阿扑吗啡(APO)、抗坏血酸、谷氨酸(GLU)、天门冬氨酸(ASP)、甘氨酸(GLY)、γ-氨基丁酸(GABA)标准品及优级纯高丝氨酸(HSE)标准品、优级纯邻苯二甲醛(OPA,Sigma公司,美国);GoTaq® qPCR 反转录系统(Promega公司,美国);引物合成由生工生物工程(上海)股份有限公司完成;TH抗体(Santa Cruz公司,美国);即用型快捷免疫组化鼠Max VisionTM试剂盒(迈新生物技术有限公司)。
1.2 实验仪器 TOW-3A型大鼠脑立体定位仪(广东汕头市教育医学仪器厂);ABI 7500型荧光定量PCR仪(美国应用生物系统中国公司);RNA/DNA calculator(Pharmacia公司);高效液相色谱仪:Shimadzu,LC-20AB二元高压泵,SIL-20A自动进样器,RF-10AXL荧光检测器,CTO-10AVP柱温箱(日本岛津公司);色谱柱:Kromasil C18,250.0mm×4.6mm,5μm(美国Sigma公司);CUT4060石蜡切片机(斯沃德(北京)仪器设备有限公司)。
1.3 实验动物及模型建立 雄性SPF级SD大鼠,体重180~200g,由上海中医药大学实验动物中心提供(许可证号:SYXK(沪)2008-0016)。实验条件:恒温(23±2)℃,相对湿度60%~65%,自动光-暗控制(7:00~19:00光照,19:00~7:00暗置),动物摄食、饮水及活动自由。PD模型的制备采用Ungerstedt等[3]所创立的经典方法。手术前进行常规行为测试,确认大鼠无异常旋转行为后,用3%戊巴比妥钠50mg/kg腹腔注射麻醉。将麻醉大鼠固定在大鼠脑立体定位仪上,无菌条件下暴露前囟和后囟,保证大鼠前囟和后囟在同一水平线上。根据包新民等[4]编著的大鼠脑立体定位图谱,以前囟为准,确定右侧黑质二点坐标:①前囟后5.2mm,正中线右侧1.0mm,硬膜下9.0mm;②前囟后5.2mm,正中线右侧2.5mm,硬膜下8.5mm。用颅骨钻于手术要求部位小心钻开颅骨,用5μl微量进样器将6-OHDA(溶于含0.2%维生素C的生理盐水中)先后注入(以1.0mm/min速度缓慢进针,注射速度为1μl/min)右侧黑质二点坐标处,每孔3μl,注射完毕后留针5min,然后以1.0mm/min速度缓慢退针。手术完成后,用医用明胶海绵填塞颅骨孔,缝合切口处皮肤,肌内注射庆大霉素7d。造模10d后,以腹腔注射APO 0.5mg/kg诱发大鼠向一侧旋转,记录开始旋转后30min内的旋转圈数,以旋转圈数平均>7次/min者为合格的PD模型[5]。
1.4 实验分组及给药 将造模成功的72只大鼠分层随机分为6组,每组12只,分别为模型组(Model组)、美多芭组(Madopar组,150mg/kg)、毛蕊花糖苷组(Verba组,60mg/kg)、复方地黄颗粒低剂量组(LCRG组,3.5g/kg)、复方地黄颗粒中剂量组(MCRG组,7.0g/kg)、复方地黄颗粒高剂量组(HCRG组,14.0g/kg);另设正常对照组(NC组,只捆绑动物,不作其他处理)和假手术组(SO组,只注射含0.2%维生素C的生理盐水)。大鼠每日给药量按孙瑞元[6]的方法计算。复方地黄颗粒、毛蕊花糖苷和美多芭分别用蒸馏水溶解,每天灌胃1次。正常对照组、假手术组和模型组以等体积蒸馏水(2ml/只)灌胃,连续用药6周。
1.5 大鼠右侧纹状体N-甲基-D-天冬氨酸受体1(NMDA-R1)、NMDA-R2、γ-氨基丁酸β1受体(GABA-RB1) mRN水平的测定 采用RT-PCR法检测NMDA-R1、NMDA-R2、GABA-RB1 mRNA水平。每组6只大鼠断头取脑,小心分离右侧纹状体并称重。抽提总RNA,反转录后扩增。引物序列见表1;PCR条件为:94℃预变性1min,94℃ 8s,60℃34s,共40个循环;72℃延伸10min。采用相对定量2–ΔΔCt法分析各个样本目的基因的表达变化。

表1 大鼠右侧纹状体NMDA-R1、NMDA-R2、GABA-RB1引物序列Tab.1 Primer sequences of NMDA-R1,NMDA-R2 and GABA-RB1 in right striatum of rats
1.6 大鼠右侧纹状体ASP、GLU、GLY、GABA含量的HPLC测定
1.6.1 脑组织匀浆液的制备 ①取大鼠右侧纹状体置于匀浆管中,以1:10的比例加入0.4mol/L的高氯酸,冰浴下充分匀浆;②冰浴沉淀30min,于4℃、10 000r/min离心15min;③取上清液并每1ml加入0.1mol/L NaHCO3溶液1ml,混匀后于4℃、3000r/min离心5min,取上清液待测。
1.6.2 试剂配制 精确配置GLU、ASP、GLY、GABA及内标HSE的标准品储存液1mmol/L,分析时用超纯水稀释成工作液。精密称取27mg OPA,加入0.5ml甲醇溶解,加入20μl β-巯基乙醇,再用硼酸(pH 9.5)0.4mol/L定容至5ml,避光0~4℃保存。隔日补加β-巯基乙醇10~15μl,共1周。
1.6.3 色谱条件与检测方法 色谱柱:Kromasil-C18,4.6mm×250.0mm,5μm。流动相:A为0.1mol/L乙酸钠溶液(pH6.3)和0.05%四氢呋喃,B为100%甲醇。柱温30℃。检测时脑组织匀浆液稀释250倍,取稀释液37μl加入浓度为0.2μmol/L的内标高丝氨酸溶液3μl,然后加20μl OPA衍生试剂,漩涡混匀30s,静置80s,精确控制在2min时进样20μl进行氨基酸测定。
1.7 大鼠右侧黑质内TH阳性细胞数量的测定 每组6只大鼠经3%戊巴比妥钠麻醉后进行心脏灌注,分离右侧黑质部分,置4%多聚甲醛溶液中固定,石蜡包埋切片,按照试剂盒说明书对大鼠右侧黑质进行免疫组织化学染色后,检测TH阳性表达细胞。镜下观察,每组观察6张切片,每张切片在光镜高倍镜下随机取3个4mm2视野,计算TH阳性反应细胞数。分析软件使用IMS彩色图像分析系统。
1.8 统计学处理 采用SPSS 16.0软件进行统计分析。计量资料以表示,方差齐者,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠右侧纹状体NMDA-R1、NMDA-R2、GABA-RB1 mRNA水平的变化 与正常对照组和假手术组比较,模型组大鼠右侧纹状体内NMDA-R1、NMDA-R2 mRNA表达明显升高,GABA-RB1 mRNA表达明显降低,差异有统计学意义(P<0.01)。复方地黄颗粒及毛蕊花糖苷干预后,NMDA-R1、NMDA-R2 mRNA表达较模型组呈降低趋势,GABA-RB1 mRNA表达较模型组呈升高趋势,以复方地黄颗粒中剂量组改善最为明显,差异有统计学意义(P<0.01,表2)。
2.2 大鼠右侧纹状体ASP、GLU、GLY、GABA含量的变化 与正常对照组、假手术组比较,模型组大鼠右侧纹状体内ASP、GLU含量明显升高,GLY、GABA含量明显降低,差异有统计学意义(P<0.01)。复方地黄颗粒及毛蕊花糖苷干预后,ASP、GLU含量较模型组呈降低趋势,GLY、GABA含量较模型组呈升高趋势,以复方地黄颗粒中剂量组改善最为明显,差异有统计学意义(P<0.01,表3)。
2.3 大鼠右侧黑质内TH阳性细胞数量的变化 镜下观察可见,TH阳性信号定位于细胞质,在正常对照组、假手术组的右侧黑质均可见密集的TH 阳性细胞,呈棕褐色,细胞形状主要为圆形或卵圆形,少数呈多边形;模型组右侧黑质可见少量、稀疏分布的TH阳性细胞;随着给药干预,TH阳性细胞的数量有所增加(图1)。
表2 大鼠右侧纹状体NMDA-R1、NMDA-R2、GABA-RB1 mRNA的表达水平(±s,n=6)Tab.2 Levels of NMDA-R1,NMDA-R2 and GABA-RB1 mRNA in right striatum of rats (±s,n=6)
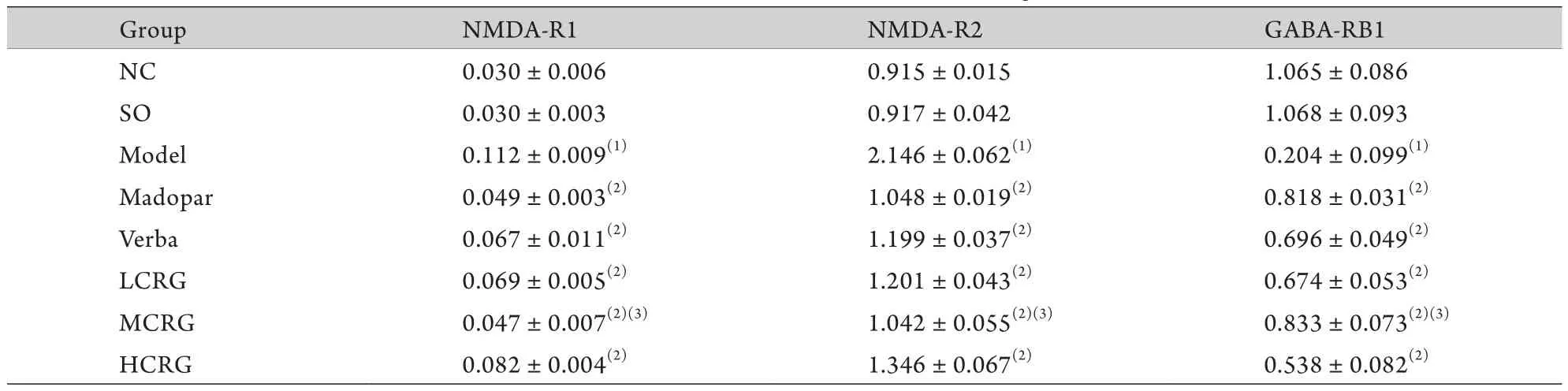
表2 大鼠右侧纹状体NMDA-R1、NMDA-R2、GABA-RB1 mRNA的表达水平(±s,n=6)Tab.2 Levels of NMDA-R1,NMDA-R2 and GABA-RB1 mRNA in right striatum of rats (±s,n=6)
NMDA.N-methyl-D-aspartic acid receptor; GABA.γ-aminobutyric acid; NC.Normal control; SO.Sham operation; LCRG.Low dose group of compound Rehmannia granules; MCRG.Medium dose group of compound Rehmannia granules; HCRG.High dose group of compound Rehmannia granules; (1)P<0.01 compared with NC group and SO group; (2)P<0.01 compared with Model group; (3)P<0.01 compared with LCRG group and HCRG group
Group NMDA-R1 NMDA-R2 GABA-RB1 NC 0.030±0.006 0.915±0.015 1.065±0.086 SO 0.030±0.003 0.917±0.042 1.068±0.093 Model 0.112±0.009(1) 2.146±0.062(1) 0.204±0.099(1)Madopar 0.049±0.003(2) 1.048±0.019(2) 0.818±0.031(2)Verba 0.067±0.011(2) 1.199±0.037(2) 0.696±0.049(2)LCRG 0.069±0.005(2) 1.201±0.043(2) 0.674±0.053(2)MCRG 0.047±0.007(2)(3) 1.042±0.055(2)(3) 0.833±0.073(2)(3)HCRG 0.082±0.004(2) 1.346±0.067(2) 0.538±0.082(2)
表3 大鼠右侧纹状体ASP、GLU、GLY、GABA含量比较(μmol/g,±s,n=6)Tab.3 Contents of ASP,GLU,GLY and GABA in right striatum of rats (μmol/g,±s,n=6)

表3 大鼠右侧纹状体ASP、GLU、GLY、GABA含量比较(μmol/g,±s,n=6)Tab.3 Contents of ASP,GLU,GLY and GABA in right striatum of rats (μmol/g,±s,n=6)
GABA.γ-aminobutyric acid; NC.Normal control; SO.Sham operation; LCRG.Low dose group of compound Rehmannia granules; MCRG.Medium dose group of compound Rehmannia granules; HCRG.High dose group of compound Rehmannia granules; (1)P<0.01 compared with NC group and SO group; (2)P<0.01 compared with Model group; (3)P<0.01 compared with LCRG group and HCRG group
Group ASP GLU GLY GABA NC 1.5982±0.2304 6.1257±0.6214 4.1267±0.1945 4.8682±0.8395 SO 1.6023±0.2375 6.0959±0.5684 4.2105±0.2014 4.8519±0.9542 Model 4.0120±0.1874(1) 14.8526±0.6147(1) 1.0050±0.3001(1) 1.2004±1.0002(1)Madopar 2.0160±0.1945(2) 7.4987±0.5894(2) 3.7981±0.1874(2) 4.4981±0.7998(2)Verba 2.6020±0.2147(2) 9.8652±0.5968(2) 3.2104±0.2224(2) 3.7395±0.8874(2)LCRG 2.5940±0.2258(2) 9.9854±0.6042(2) 3.1248±0.2453(2) 3.7453±0.8953(2)MCRG 2.0130±0.2019(2)(3) 7.5486±0.5784(2)(3) 3.8874±0.2648(2)(3) 4.5214±0.9454(2)(3)HCRG 3.3350±0.2195(2) 12.5684±0.6201(2) 2.8456±0.1994(2) 2.0476±0.8423(2)

图1 大鼠右侧黑质TH阳性细胞变化的免疫组化检测(×400)Fig.1 Changes of TH positive cells in right substantia nigra of rats (Immunohistochemistry,×400)
与正常对照组、假手术组比较,模型组大鼠右侧黑质内TH阳性细胞数明显降低,差异有统计学意义(P<0.01)。复方地黄颗粒及毛蕊花糖苷干预后,TH阳性细胞数较模型组升高,以复方地黄颗粒中剂量组改善最为明显,差异有统计学意义(P<0.01,图2)。
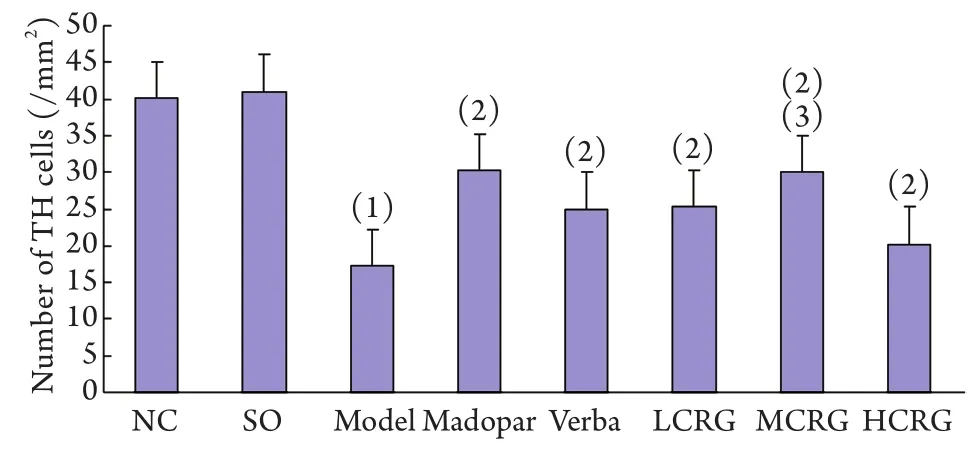
图2 大鼠右侧黑质内TH阳性细胞数量的变化(n=6)Fig.2 Changes in the number of TH positive cells in right substantia nigra of rats (n=6)
3 讨 论
大脑内的神经递质非常丰富,大致可分为氨基酸类、单胺类和多肽类,本实验主要研究氨基酸类神经递质。作为脑内一类重要的神经递质,根据其对突触后神经元的兴奋与抑制作用,氨基酸类神经递质分为兴奋性与抑制性两种,兴奋性神经递质包括GLU和ASP,抑制性神经递质包括GLY和GABA。GLU受体是NMDA-R1、NMDA-R2,GABA受体是GABA-RB1。神经递质与突触后膜受体结合,使突触后膜兴奋或抑制。在病理情况下,兴奋性氨基酸及其受体介导的兴奋毒性在PD的发生发展过程中可能发挥重要作用,兴奋性氨基酸类神经递质在PD大鼠黑质-纹状体系统含量过高,与其受体结合时间过长,引起突触后膜的过度兴奋,产生神经毒性作用,使神经系统缺血、神经紊乱、神经退行性变,可导致DA神经元受损并最终坏死,这种神经元死亡过程被称为兴奋毒性作用。与此相反,抑制性氨基酸类神经递质及其受体在黑质-纹状体系统含量增加,引起突触后膜的过度抑制,有利于维持神经递质合成与失活的动态平衡,遏制兴奋性氨基酸类神经递质的兴奋毒性作用,对DA神经元可起到防御保护作用[7]。DA水平降低是PD患者运动功能障碍的直接原因。TH是DA合成的限速酶,从源头上补充DA的合成酶TH,能增加DA神经元功能,提高PD患者运动能力[8]。本研究结果表明,与正常对照组和假手术组比较,PD模型组大鼠兴奋性神经递质GLU、ASP含量升高,GLU的受体NMDA-R1、NMDA-R2 mRNA表达水平升高;抑制性神经递质GLY、GABA的含量下降,GABA的受体GABA-RB1 mRNA表达水平下降(P<0.01);TH阳性细胞表达数明显降低(P<0.01)。给予复方地黄颗粒和毛蕊花糖苷干预后,GLU、ASP含量下降,GLU的受体NMDA-R1、NMDA-R2 mRNA表达水平下降;抑制性神经递质GLY、GABA含量升高,GABA的受体GABA-RB1 mRNA表达水平升高(P<0.01);TH阳性细胞表达数明显升高(P<0.01)。可见复方地黄颗粒和毛蕊花糖苷能使抑制性氨基酸类神经递质及其受体在黑质-纹状体系统含量增加,兴奋性氨基酸类神经递质及其受体在黑质-纹状体系统含量下降,遏制兴奋性氨基酸类神经递质的兴奋毒性作用,对DA神经元可起到防御保护作用。
祖国医学理论认为,PD的病机是肝肾亏虚、阴虚动风,治宜培补肝肾、滋阴熄风。复方地黄颗粒方中熟地补肾益精,滋阴养血为君药;钩藤熄风定惊,珍珠母滋阴潜阳,白芍滋肝阴,共为臣药;丹参养血,石菖蒲开窍醒神,全蝎熄风,共为佐使药[9-10]。毛蕊花糖苷别名麦角甾苷、毛蕊花苷,属于苯丙素苷类化合物,分子式C29H36O15,分子量624.59,是熟地中的主要有效成分,报道称可保护中枢神经元[11-12]。
上述研究结果表明,PD动物模型中复方地黄颗粒和毛蕊花糖苷的作用靶标可能在于氨基酸类神经递质及其受体基因,以及DA能神经元的保护。其中以复方地黄颗粒中剂量组发挥治疗作用最显著,毛蕊花糖苷组有一定的治疗作用,但较复方中剂量组治疗效果弱。本研究应用RT-PCR、HPLC和免疫组化的方法探讨了复方地黄颗粒和毛蕊花糖苷的作用靶标,这一研究成果使得复方地黄颗粒和毛蕊花糖苷有希望用于治疗神经退行性疾病,尤其是PD,可以增强神经可塑性,促进神经元再生。然而,PD往往涉及多种复杂机制,因此复方地黄颗粒和毛蕊花糖苷是否还通过其他靶标如生物分子或信号网络等发挥治疗作用,仍须更多体内外实验研究予以验证。
