黑质-纹状体DNA甲基化在6-羟基多巴胺所致帕金森病模型大鼠中的作用
2018-09-12梁建庆何建成
梁建庆,何建成
近年来,表观遗传修饰在许多重大疾病致病机制中的作用受到广泛关注[1]。在表观遗传修饰中,DNA甲基化水平的高低可能对疾病产生影响。因此,探讨DNA甲基化与疾病的关系[2-4],更深入地研究疾病的致病机制,可为疾病的预防、诊断和治疗提供新途径[5]。胡雅岑等[6]构建了1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)小鼠帕金森病(Parkinson's disease,PD)模型,并进一步证实DNA甲基化修饰异常在PD发病机制中起重要作用,环境因素(如MPTP)可以通过改变DNA甲基化修饰参与PD的发生发展。本研究构建6-羟基多巴胺(6-hydroxydopamine,6-OHDA)大鼠PD模型,探讨大鼠黑质及纹状体中DNA甲基化水平,以揭示甲基化与PD发病的关系。
1 材料与方法
1.1 主要仪器 大鼠脑立体定位仪(RWD-68003型)购自深圳瑞沃德生命科技有限公司;高效液相色谱仪(1200 Series)购自美国Agilent Technologies公司;色谱柱(4.6mm×150.0mm,5μm,518935-902)购自美国Agilent公司;高速冷冻离心机(Multifuge IS-R)购自德国Thermo公司;超声破碎仪(XL 2000)购自美国Misonix公司;漩涡混匀器(XW-80A)购自上海医科大学仪器厂。
1.2 药物与试剂 6-OHDA(批号:MKBP0832V)、阿扑吗啡(apomorphine,APO,批号:SLBF6369V)、抗坏血酸(批号:063K1082)、胞嘧啶(cytosine,C,批号:C500060)、5-甲基胞嘧啶(5-methylcytosine,5-mC,批号:Lot#1451791V)购自美国Sigma公司;戊巴比妥钠(批号:WS20130112)购自上海中西药业股份有限公司;庆大霉素(0.3g/支,批号:20130675)购自上海第一制药厂;UNIQ-10柱动物基因组DNA分离试剂盒(批号:B511206)购自生工生物工程(上海)股份有限公司;甲基亮氨酸通用甲基化试剂盒(批号:P-1011-2)购自美国Epigentek公司;抗-Dnmt1抗体(批号:ab13537)、抗-Dnmt3a抗体(批号:ab2850)、抗-Dnmt3b抗体(批号:ab13604)均购自艾博抗(上海)贸易有限公司。
1.3 实验动物及分组 30只SPF级雄性SD大鼠,体重180~200g,由上海中医药大学实验动物中心提供[许可证号:SYXK(沪)2012-0002]。动物饲养在上海中医药大学实验动物中心,恒温(23±2)℃,自动光-暗控制(12h:12h,即7:00-19:00光照,19:00-7:00暗置),相对湿度60%~65%,大鼠自由摄食、饮水。将30只SD大鼠分为模型组(Model组)、正常组(NC组)、假手术组(SO组),每组10只。
1.4 大鼠模型制备 SD大鼠的PD模型构建采用Ungerstedt等[7]建立并经过本课题组探索、反复验证的两点法进行制备[8-9]。造模前常规进行神经行为学测试,确认大鼠无异常旋转行为后,采用3%戊巴比妥钠50mg/kg腹腔注射麻醉,剪去颅顶鼠毛,暴露头部皮肤,将其正确固定在大鼠脑立体定位仪上,用1%浓度碘伏溶液在大鼠颅顶部手术区域常规消毒;在无菌条件下用手术刀沿正中线切开大鼠颅顶部皮肤,剥离骨膜,充分暴露前囟和后囟,保证大鼠前囟和后囟在同一水平线上。根据包新民等[10]编著的大鼠脑立体定位图谱,以前囟为准,确定右侧黑质两点坐标:①前囟后5.2mm,正中线右侧1.0mm,硬膜下9.0mm;②前囟后5.2mm,正中线右侧2.5mm,硬膜下8.5mm。使用颅骨钻小心钻开颅骨,用5μl微量进样器将6-OHDA(溶于含0.2%维生素C的超纯水中,即将抗坏血酸0.001g溶于超纯水0.5ml中)先后分别注入(以1.0mm/min速度缓慢进针,注射速度为1μl/min)右侧黑质两点处,每孔3μl,注射完毕后留针5min,以1.0mm/min速度缓慢退针。手术完毕后,用医用明胶海绵填塞颅骨孔,仔细缝合切口处骨膜及皮肤,肌内注射庆大霉素7d,待动物苏醒后放回笼中饲养。假手术组只注射含0.2%维生素C的超纯水,正常对照组只捆绑动物,不做任何处理。造模10d后,以腹腔注射0.5mg/kg APO诱发大鼠向健侧旋转,记录开始旋转至30min内的旋转圈数,以旋转圈数平均>7次/min者为合格的动物模型[11]。
1.5 指标检测
1.5.1 大鼠全基因组甲基化水平检测 摘取大鼠黑质及纹状体组织,采用ELISA法测定大鼠全基因组甲基化水平,取大鼠黑质及纹状体置于EP管中,用UNIQ-10柱动物基因组DNA分离试剂盒提取大鼠黑质及纹状体组织DNA,甲基亮氨酸通用甲基化试剂盒测定大鼠全基因组甲基化率。
1.5.2 大鼠黑质及纹状体组织胞嘧啶、5-甲基胞嘧啶的含量检测 采用HPLC法检测大鼠黑质及纹状体组织胞嘧啶、5-甲基胞嘧啶的含量。色谱条件:色谱柱Agilent,150.0mm×4.6mm,粒径5μm。流动相(新鲜配制并经0.45μm的滤膜过滤)为0.045mol/L无水柠檬酸,0.19mol/L无水乙酸钠,0.43mmol/L辛烷基磺酸钠,0.23mmol/L乙二胺四乙酸,体积分数为0.08的甲醇,pH值4.6,流量1.0ml/min,柱温25℃,检测器工作电位0.48V,灵敏度1μA。
1.5.3 大鼠黑质及纹状体组织Dnmt1、Dnmt3a、Dnmt3b蛋白表达的检测 采用Western blotting法检测大鼠黑质及纹状体组织Dnmt1、Dnmt3a、Dnmt3b蛋白表达,采用AlphaView图像分析软件对扫描图像的目标条带进行灰度分析,各目的条带与β-actin的灰度比值为目的蛋白的相对表达量。
1.5.4 大鼠黑质-纹状体全基因组差异甲基化图谱绘制 采用上海欧易生物医学科技有限公司的MethylRAD技术进行大鼠黑质-纹状体全基因组差异甲基化图谱绘制。
1.6 统计学处理 采用SPSS 16.0软件进行统计分析。所有资料均以表示,方差齐性检验后再进行单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠全基因组甲基化的比较 ELISA检测结果显示,与正常组及假手术组比较,模型组大鼠黑质及纹状体中DNA总体甲基化水平均明显降低,差异有统计学意义(P<0.01,表1)。
表1 大鼠全基因组甲基化率比较(%,±s,n=10)Tab.1 Comparison of the whole genome methylation rate in rats (%,±s,n=10)

表1 大鼠全基因组甲基化率比较(%,±s,n=10)Tab.1 Comparison of the whole genome methylation rate in rats (%,±s,n=10)
(1)P<0.01 compared with normal control group; (2)P<0.01 compared with sham operation group
Striatum methylation rate Normal control 7.14±0.54 9.13±0.69 Sham operation 6.95±0.57 8.99±0.64 Model 4.53±0.58(1)(2) 6.42±0.61(1)(2)Group Substantia nigra methylation rate
2.2 大鼠胞嘧啶、5-甲基胞嘧啶的表达变化 与正常组及假手术组比较,模型组大鼠黑质及纹状体中胞嘧啶明显升高,5-甲基胞嘧啶明显降低,差异有统计学意义(P<0.01,图1、表2)。
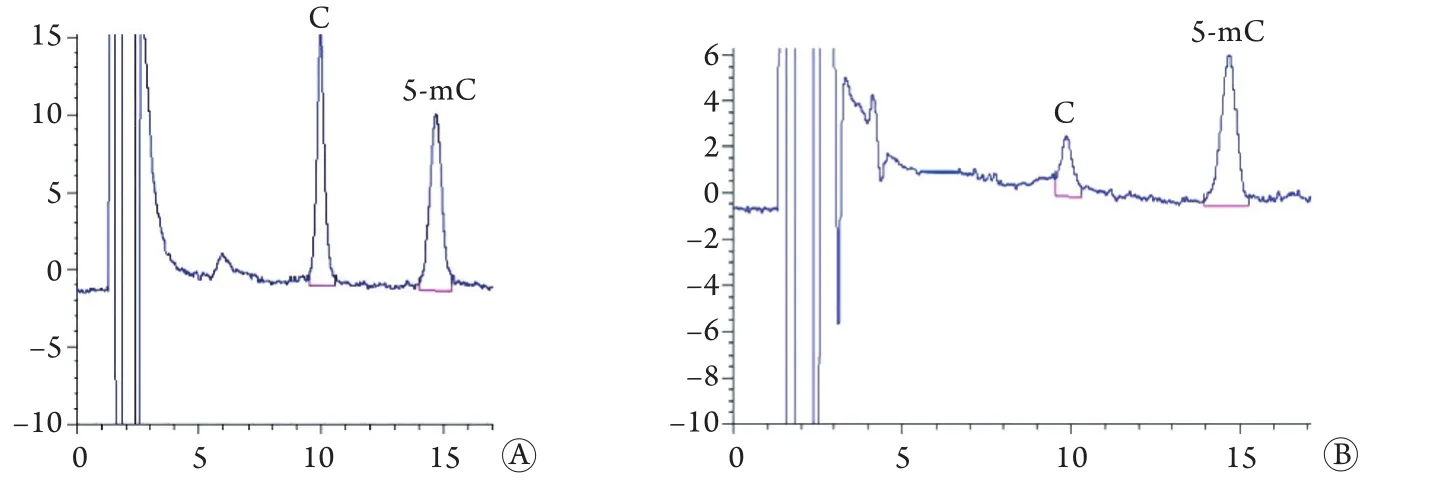
图1 大鼠胞嘧啶、5-甲基胞嘧啶色谱图Fig.1 Chromatogram of cytosine and 5- methylcytosine in ratsC.Cytosine; 5-mC.5-methylcytosine; A.Control article; B.Trial product
表2 各组大鼠胞嘧啶、5-甲基胞嘧啶的比较(μg/g,±s,n=10)Tab.2 Comparison of cytosine and 5-methylcytosine in rats of each group (μg/g,±s,n=10)

表2 各组大鼠胞嘧啶、5-甲基胞嘧啶的比较(μg/g,±s,n=10)Tab.2 Comparison of cytosine and 5-methylcytosine in rats of each group (μg/g,±s,n=10)
C.Cytosine; 5-mC.5-methylcytosine; (1)P<0.01 compared with normal control group; (2)P<0.01 compared with sham operation group
5-mC C 5-mC Normal control 4.16±0.37 4.15±0.36 11.15±0.23 11.29±0.23 Sham operation 4.13±0.32 4.20±0.34 11.23±0.21 11.21±0.25 Model 6.94±0.16(1)(2) 1.95±0.13(1)(2) 19.86±0.62(1)(2) 3.19±0.31(1)(2)Group Substantia nigra Striatum C
2.3 大鼠Dnmt1、Dnmt3a、Dnmt3b蛋白的表达变化 Western blotting检测结果显示,与正常组及假手术组比较,模型组大鼠黑质及纹状体中Dnmt1、Dnmt3a、Dnmt3b蛋白的表达明显升高,差异有统计学意义(P<0.01,图2、3,表3)。

图2 各组大鼠黑质(A)及纹状体(B)中Dnmt1、Dnmt3a、Dnmt3b蛋白表达Fig.2 Expression of Dnmt1,Dnmt3a and Dnmt3b proteins in substantia nigra (A) and striatum (B) of ratsNC.Normal control; SO.Sham operation
表3 各组大鼠黑质及纹状体Dnmt1、Dnmt3a、Dnmt3b蛋白表达比较(/β-actin,±s,n=10)Tab.3 Changes of protein expression of Dnmt1,Dnmt3a and Dnmt3b in rats (/β-actin,±s,n=10)
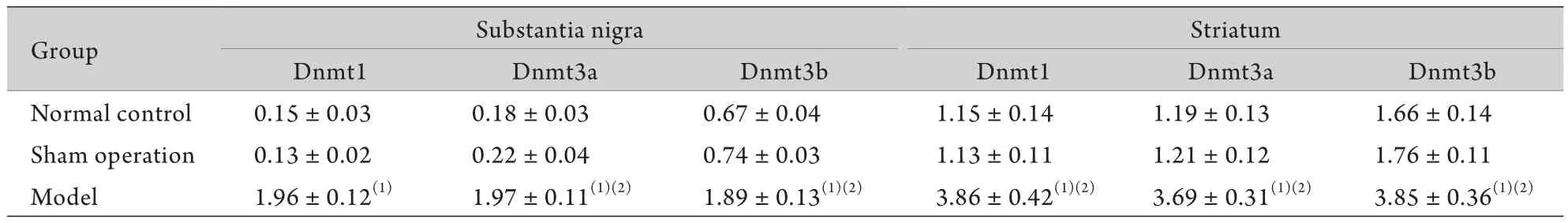
表3 各组大鼠黑质及纹状体Dnmt1、Dnmt3a、Dnmt3b蛋白表达比较(/β-actin,±s,n=10)Tab.3 Changes of protein expression of Dnmt1,Dnmt3a and Dnmt3b in rats (/β-actin,±s,n=10)
(1)P<0.01 compared with normal control group; (2)P<0.01 compared with sham operation group
Group Substantia nigra Striatum Dnmt1 Dnmt3a Dnmt3b Dnmt1 Dnmt3a Dnmt3b Normal control 0.15±0.03 0.18±0.03 0.67±0.04 1.15±0.14 1.19±0.13 1.66±0.14 Sham operation 0.13±0.02 0.22±0.04 0.74±0.03 1.13±0.11 1.21±0.12 1.76±0.11 Model 1.96±0.12(1) 1.97±0.11(1)(2) 1.89±0.13(1)(2) 3.86±0.42(1)(2) 3.69±0.31(1)(2) 3.85±0.36(1)(2)
2.4 大鼠全基因组差异甲基化图谱 从染色体图谱来看,差异甲基化位点在染色体上的分布是不均匀的,将差异位点在染色体上标识如下图(图3)。

图3 各组大鼠黑质(A)及纹状体(B)的差异甲基化图谱Fig.3 Differential methylation atlas of substantia nigra (A) and striatum (B) in normal control group,sham operation group and model group
3 讨 论
DNA甲基化是表观遗传学的重要组成部分,是在DNA甲基化转移酶(DNMTs)的作用下使CpG二核苷酸5'-端的胞嘧啶(C)转变为5'-甲基胞嘧啶(5mC)的过程。DNA甲基化可以发生在腺嘌呤的N-6位、鸟嘌呤的N-7位、胞嘧啶的C-5位等。但在哺乳动物中DNA甲基化主要发生在5'-CpG-3'的胞嘧啶上生成5-甲基胞嘧啶。在哺乳动物中CpG以两种形式存在:一种分散于DNA序列中;另一种呈现高度聚集状态,人们称之为CpG岛。在正常组织里,70%~90%散在的CpG是被甲基修饰的,而CpG岛则往往是非甲基化的(某些特殊区段和基因除外)。正常情况下,人类基因组“垃圾”序列的CpG二核苷酸相对稀少,并且总是处于甲基化状态,与之相反,人类基因组中大小为100~1000bp的富含CpG二核苷酸的CpG岛则总是处于未甲基化状态,并且CpG岛常位于转录调控区附近,与56%的人类基因组编码基因相关,因此基因转录区CpG岛甲基化状态的研究就显得十分重要[12]。DNA甲基化在维持正常细胞功能、遗传印记中起着重要作用,是目前新的研究热点之一。DNA甲基化能关闭某些基因的活性,去甲基化则诱导了基因的重新活化和表达。DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。机体处于甲基化平衡状态是基因表达的合理调控及遗传物质保持稳定的必要保障[13]。Dnmts主要有3种:Dnmt1、Dnmt3a、Dnmt3b。Dnmt1在细胞分裂中起稳定的、最主要的、维持甲基化状态的作用。Dnmt3a与Dnmt3b均为重头甲基转移酶,参与DNA甲基化的从头合成。由此可见,DNA甲基化是由Dnmts来催化和维持的。可见Dnmts调控DNA的甲基化水平,从而达到调节基因表达的作用[14]。
PD是一种常见的中老年人神经系统变性疾病,临床主要表现是震颤、肌强直、运动减少和姿势异常[15]。PD的发病机制十分复杂,与氧化应激、神经递质、神经营养因子及受体、TH(酪氨酸羟化酶)等因素有关。目前,DNA甲基化与PD发病机制关系的研究已经起步,但研究成果不多,结果存在矛盾之处[6]。Lee等[16]以及Charlton等[17]将内源性甲基供体S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)注入啮齿类动物脑内可导致PD样改变,提示过度甲基化可能为PD的诱发因素,Obeid等[18]发现PD患者外周血中SAM相对含量下降。Pieper等[19]发现,PD患者黑质致密部细胞中的TNF-α启动子甲基化水平明显降低,SNCA基因内含子1甲基化水平明显降低,提示低甲基化可能与PD发病相关。因此,本研究致力于从基因组水平对PD的DNA甲基化进行全面探索研究。结果发现,与正常组及假手术组比较,模型组大鼠黑质及纹状体中DNA总体甲基化水平均明显降低,胞嘧啶升高、5-甲基胞嘧啶明显降低,Dnmt1、Dnmt3a、Dnmt3b蛋白的表达明显升高,差异有统计学意义(P<0.01);从染色体图谱来看,模型组大鼠黑质及纹状体差异甲基化位点在染色体上的分布是不均匀的。研究结果提示DNA低甲基化修饰在PD发病中有一定作用。
综上,模型组大鼠全基因组DNA甲基化水平普遍降低,揭示低甲基化与PD的发病机制有关,下一步应探索模型组大鼠1st exon(第一个外显子)、Body(基因区)、TSS200(基因起始位点上游200bp内的区域)、TSS1500(基因起始位点上游1500bp内200bp外的区域)、intron(内含子区)、intergenic(基因间区)等甲基化位点在基因组不同功能元件上的分布,以进一步明确甲基化与PD发病机制的关系。
