盐渍对鸭蛋的白蛋白影响
2018-09-12伍佰鑫刘成国编译
伍佰鑫 ,邓 平 ,刘成国 (编译)
(1.湖南省畜牧兽医研究所,湖南 长沙 410131;2.湖南农业大学食品科技学院,湖南 长沙 410128)
盐鸭蛋又称腌蛋或咸蛋,用食盐腌制,成熟期短,费用低廉;其蛋白软嫩洁白,蛋黄松沙可口,中心油分积聚,外围油分四溢,色泽桔红或橙黄;是人们喜爱的传统食品[1]。盐鸭蛋中的蛋白含有4%~7%的氯化钠(味道感觉太咸),可采用脱盐工艺和电渗析法去除蛋白中的盐[2]。也可预先分离新鲜鸭蛋中的白蛋白(用作其它食糜原材料),直接腌制蛋黄[3]。一般情况下,鸭蛋在盐渍过程中,白蛋白的理化性质会发生改变,水分含量逐渐下降,而盐、灰分、蛋白质和脂类含量增加;随着腌制时间的延长,蒸煮全鸭蛋中的白蛋白硬度变得更低[4]。为了探索鸭蛋腌制期间(30d)白蛋白化学成分、胰蛋白酶抑制活性与凝胶特性的变化,泰国学者做了如下研究[5],可为国内蛋品加工行业创新提供“药引子”。
1 研究方法
按 1个蛋/100ml的比例,室温(28~30℃)配制卤水或浓盐水(25%,w/v)备用。从鸭场采集新鲜鸭蛋(产出后24h内),用自来水洗干净,浸入卤水或浓盐水。每隔5d随机取出一些盐鸭蛋,手工敲碎、将白蛋白与蛋黄分离,对白蛋白进行分析。白蛋白中的水分、蛋白质和盐分含量的测定,分别采用AOAC2000、双缩尿(反应)法和 AOAC2011。运用8-苯胺-1-萘磺酸(德国)为探针,根据荧光强度对蛋白质浓度(线性回归分析)的初始斜率,计算白蛋白的表面疏水性。
胰蛋白酶抑制活性的测定:取200μl白蛋白和 200μl猪胰蛋白酶(0.05mg/ml)37℃培养 15min;添加1000μl反应缓冲液 (50mM三羟甲基氨基甲烷盐酸盐,其中含有 20mM CaCl2,pH8.2); 添加200μl苯甲酰-DL-精氨酸-ρ-硝基苯胺(2mg/ml,美国);混合物 37℃培养 15min;添加 200μl的30%乙酸(v/v);用分光光度计(日本)测量410nm处的吸光度,对ρ-硝基苯胺的释放进行监测;当酶引起吸光度增加0.01个单位/min,就定义为1个单位的胰蛋白酶活性;使胰蛋白酶活性降低1个单位,就定义为1个单位的胰蛋白酶抑制活性。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳:取2ml白蛋白与12ml 5%十二烷基硫酸钠(德国)混合(制备蛋白质样品);取15μg蛋白质样品置于凝胶(12%电泳胶和4%积层凝胶)之上进行电泳(恒流 15mA/凝胶,美国);用染色液(德国,0.125%考马斯蓝Coomassie blue R-125滴入25%甲醇和10%乙酸之中)对凝胶进行染色;脱色采用40%甲醇和10%乙酸;最后估算蛋白条带的分子量。
抑制活性染色:取白蛋白样品与缓冲液(不含β-巯基乙醇)混合;混合样不做热处理,分别取15μg置于2个相同的凝胶之上,通过电泳将蛋白质分离,电泳装置嵌在碎冰中以便减少产生的热量;其中1个凝胶固定,用考马斯蓝R-250染色,作为对照组凝胶;另外1个凝胶用2.5%聚乙二醇辛基苯基醚冲洗15min,去除十二烷基硫酸钠,再用蒸馏水冲洗,浸入50ml胰蛋白酶(0.2mg/ml)50mM三羟甲基氨基甲烷的缓冲液中 (其中含有20mM CaCl2,pH8.2);该凝胶 0~4℃培养 30min、置于室温60min,让胰蛋白酶扩散到凝胶中;用蒸馏水冲洗后浸入酪蛋白溶液(酪蛋白10mg/ml、50mM三羟甲基氨基甲烷的缓冲液,pH8.2),37℃培养90min;凝胶用蒸馏水漂洗、固定、用考马斯蓝R-250染色,形成抑制条带,在清晰的背景上检测暗带;通过对照组比较标准的蛋白质迁移率,估算胰蛋白酶抑制剂的表观分子量。
白蛋白凝胶制备与分析:先用蒸馏水作溶剂,制备白蛋白溶液(10%固形物),轻轻搅拌均匀;倒入套管 (直径25mm),两端都紧紧密封,加热至90℃保持30min;立即冷却至4℃并过一夜;分析之前将白蛋白凝胶切割成圆筒状(直径25mm、高度30mm)。 采用质构仪(Model TA-XT2i,英国)分析纹理轮廓:用压缩圆柱形铝探头(直径50mm)将凝胶压缩至原始高度的40%;在3mm/s的十字头速度下,记录力距变形曲线,记录速度也是3mm/s;用分析软件(MicroStable,版本6,英国)评价硬度、胶粘性、弹性、粘聚性、弹力、咀嚼性和胶质。采用色度计(ColorFlex,美国)分析凝胶的亮度(L*)、红度(a*)和黄度(b*);通过公式 100-[(100-L*)2+a*2+b*2]1/2计算出白色度。用扫描电子显微镜检测腌制0、15d和30d的盐鸭蛋蛋白凝胶的显微结构:将白蛋白凝胶切成小块(1×1×1mm3),用含有 2.5%戊二醛的0.2M磷酸盐缓冲液(pH7.2,德国)固定12h;用蒸馏水漂洗1h;用6种浓度 (25%、50%、70%、80%、90%和100%)的乙醇脱水,每个浓度的脱水15min;对脱水样品进行临界点干燥;涂上一层100%金子(溅射喷涂机SPI-Module,美国);用扫描电镜(JEOL JSM-5800LV,日本)观察凝胶微观结构。
所有试验一式三份,一共三批样品;数据采用单向方差分析(ANOVA),结果用平均值和标准差表示;采用多重比较分析样本之间的差异,统计分析软件是SPSS11.0(美国)。
2 研究结果
2.1 盐渍时间对鸭蛋蛋白化学成分的影响 盐渍期间,鸭蛋蛋白中的水分持续减少,从初期的87.93%减少到盐渍30d的81.20%;同时,盐分随盐渍时间延长而增加,从初期的0.31%增加到盐渍 30d 的 6.19%。 蛋白的亮度(L*)减少、红度(a*)、黄度(b*)和白色度增加,见表 1。
蛋白质表面疏水位点的数量和相对大小,通常决定蛋白质的溶解度,在pH、温度和离子强度等生理条件下的聚集倾向。鸭蛋蛋白的表面疏水性随盐渍时间延长而逐渐增加,从初期的735.04增加到盐渍20d的821.45,表明盐渍诱导了蛋白质构象变化。在盐渍的前15d期间,鸭蛋的胰蛋白酶抑制活性持续下降,只保持63%的活性;盐渍30d的抑制活性最低 (5.68千单位/mg固体),因此,胰蛋白酶抑制剂的变性可能与其生物活性的丧失有关,从而推断抗蛋白酶活性的降低与一些关键蛋白(如类卵母细胞和卵黄抑制剂)的退化有关。
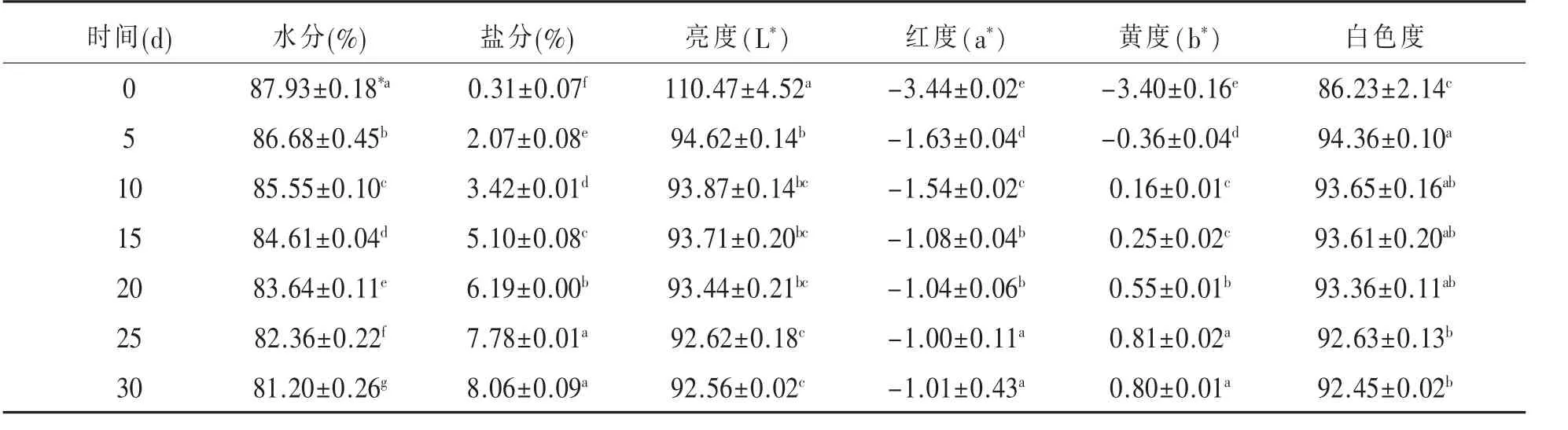
表1 盐渍期间鸭蛋蛋白的水分/盐分/色泽变化
电泳结果发现,鸭蛋蛋白最主要的蛋白质是卵清蛋白,分子量为44kda。在非还原条件下,发现有分子量分别为81、70和16kda的蛋白质,分子量为81kda的蛋白质更可能是卵传铁蛋白,分子量为16kda的蛋白质更可能是溶菌酶。对于抑制活性染色,只保留了分子量为44kda的蛋白带,这种蛋白 (分子量类似)貌似卵清蛋白或其他蛋白质,对胰蛋白酶有抑制作用。抑制活性染色未检出类卵母细胞和卵黄抑制剂,当十二烷基硫酸钠用于电泳时,那些抑制剂可能失去了抑制活性,经胰蛋白酶消化后,那些蛋白条带未被保留。盐渍20d后,分子量为44kda的蛋白带淡于新鲜鸭蛋和盐渍10d鸭蛋的蛋白带,这表明盐渍期间,有抑制活性的蛋白质失去了一些活性,可能归因于抑制蛋白的构象发生了改变,这一结果与鸭蛋白在盐渍过程中降低了胰蛋白酶抑制活性是吻合的,也就是说,盐渍时间对降低胰蛋白酶抑制活性有显著影响。
2.2 盐渍时间对白蛋白凝胶特性的影响 随着盐渍时间的增加,白蛋白凝胶的硬度降低 (P<0.05);新鲜鸭蛋的白蛋白凝胶硬度值(19.08N)最高,盐渍30d鸭蛋的白蛋白凝胶硬度值(3.77N)最低,差异显著(P<0.05);盐渍5d鸭蛋的白蛋白凝胶硬度值(9.26N)就降低了50%,见表2。

表2 盐渍期间鸭蛋的白蛋白凝胶质地变化
与盐渍鸭蛋的白蛋白凝胶相比,新鲜鸭蛋的网络更加密集、空隙更小;盐渍鸭蛋的白蛋白凝胶有较大的空隙,盐渍15d的白蛋白凝胶网络变得较粗糙,均匀度较低;盐渍30d与盐渍15d的白蛋白凝胶质地没有明显差异,但由于盐渍 (特别是30d)白蛋白中的蛋白质浓度更低、盐分含量更高,蛋白质之间的相互联系变得越来越少 (图1),这与蛋白质网络强度降低(表2)是吻合的。

图1 鸭蛋的白蛋白凝胶扫描电镜照片(放大 1万倍/比例尺 5μm)
总而言之,盐渍影响鸭蛋的白蛋白化学组成和凝胶特性,特别是蛋白酶抑制剂受盐渍时间影响,盐渍可将胰蛋白酶抑制活性减少到一定的程度。分子量为44kda的蛋白质在鸭蛋的白蛋白中充当胰蛋白酶抑制剂的角色。随着盐渍时间的延长,白蛋白的胶性变得更弱(吃起来感觉无韧性)、白色度增加。盐渍白蛋白可应用于鱼糜或其他肉制品,通过强化胶粘性、抑制蛋白质水解,改善其适口性等特性。
