正交实验法探究课堂制备氢氧化亚铁的最佳条件
2018-09-12刘晓玲
邹 灵 刘晓玲
江西师范大学化学化工学院(330022)
按照课本上的方法,新制成的氢氧化亚铁会迅速变为灰绿色,学生几乎观察不到白色沉淀。近年来,关于氢氧化亚铁制备条件的相关研究很多,但适合课堂教学的却很少。本文尝试利用正交实验法,力图找出操作简单、现象明显、便于观察、适用于课堂教学的氢氧化亚铁制备条件。
1 实验指标的确定
本实验指标设计为白色沉淀保存时间,即从有白色沉淀生成开始计时,到沉淀周围出现轻微浅绿色停止。
2 因素水平的确定
在参考大量文献及考虑便于课堂实施,笔者选择以下7个因素进行探究:①氢氧化钠溶液浓度;②溶剂是否煮沸;③Fe2+的来源;④Fe2+的浓度;⑤是否进行液封;⑥溶液的滴加顺序;⑦滴管是否伸到液面以下。
3 筛选实验
笔者先对这7个因素分别取2个水平进行筛选实验,限于篇幅不做赘述。经筛选发现氢氧化钠溶液浓度、Fe2+来源、Fe2+浓度对实验结果有较大影响,另外4个因素影响较小。为达到更好实验效果,后续实验中次要因素固定为:溶剂煮沸、反应时液封、氢氧化钠溶液滴加到Fe2+溶液中、滴管伸到液面以下。
4 正交实验
4.1 正交实验因素水平
对氢氧化钠溶液浓度、Fe2+来源、Fe2+浓度这3个主要因素,每个因素取4个水平进行探究,具体情况见表1。配制Fe2+溶液均经过量铁粉处理,新制Fe2+溶液均由过量铁粉与酸反应制得。

表1 正交实验的因素和水
4.2 正交实验步骤
事先配制好所需的氢氧化钠和Fe2+溶液,取Fe2+溶液于试管中,加石蜡油液封。再取氢氧化钠溶液,在滴管伸到液面以下的情况下滴加到Fe2+溶液中。记录白色沉淀保存时间。
4.3 实验方案及结果
实验方案及结果见表2。
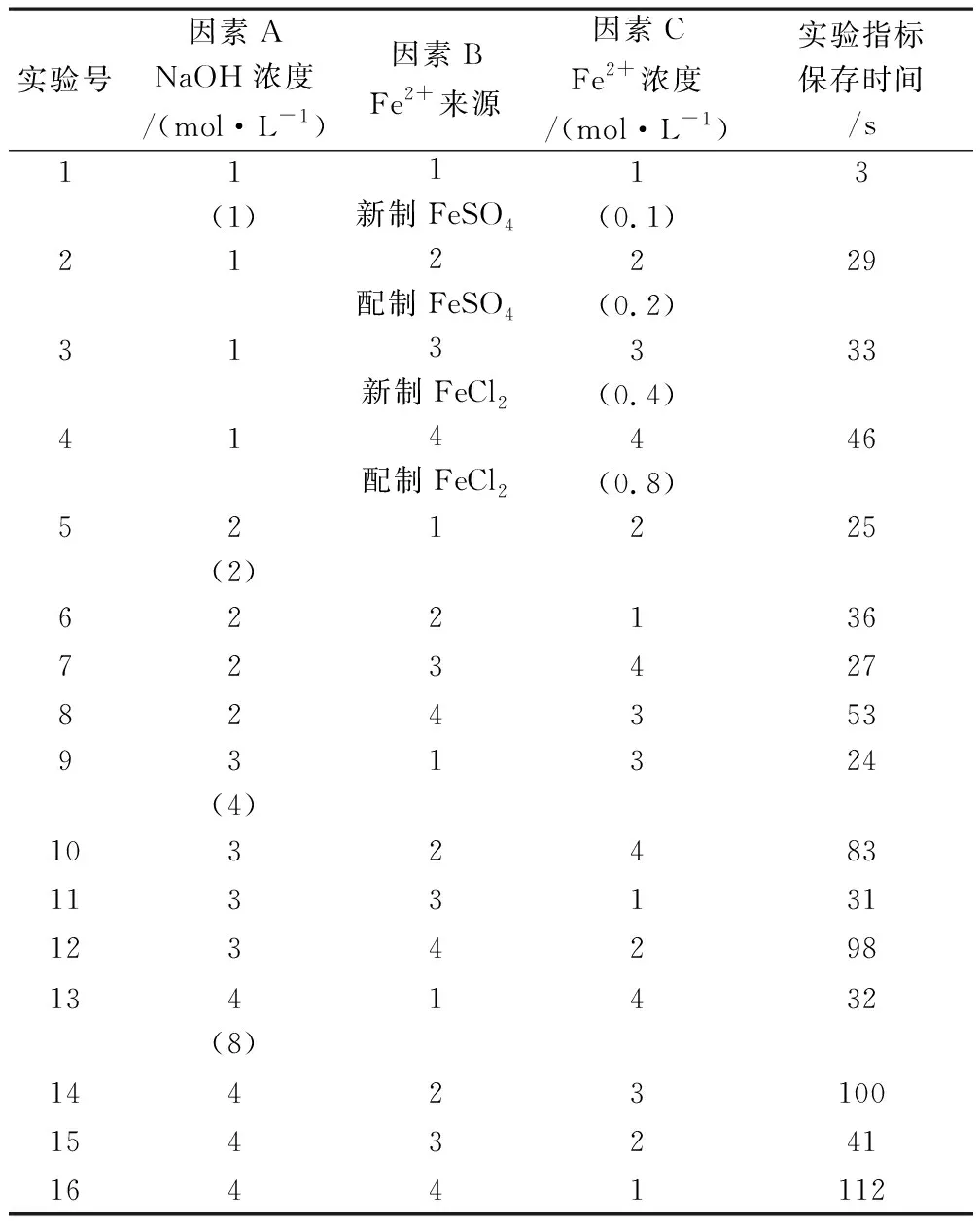
表2 实验方案及结果
4.4 实验数据直观分析
对所得的实验数据进行直观分析,所得结果见表3。

表3 实验数据直观分析
各因素影响顺序为:Fe2+来源> 氢氧化钠溶液浓度> Fe2+浓度;最佳实验方案为:A4B4C3。
5 实验结论
与课本实验方案对比,在反应均进行2 min后,实验结果如图1、图2所示。本改进方案不仅能观察到氢氧化亚铁的白色沉淀,还能看到氢氧化亚铁逐渐变色的过程,便于在课堂教学中实施,有利于学生的观察和认知。

图1 改进方案

图2 课本方案
综上所述,课堂制备氢氧化亚铁的最佳条件为:氢氧化钠溶液浓度8 mol/L、配制经还原性铁粉处理过的FeCl2溶液、Fe2+浓度0.4 mol/L。同时若想达到更佳实验效果,其他条件应为:溶剂煮沸、反应时液封、氢氧化钠溶液滴加到Fe2+溶液中、滴管伸到液面以下。
