超高效液相色谱-串联质谱法测定表层水中全氟及多氟化合物
2018-09-11刘晓雷赵兴茹申金山
刘晓雷 刘 婕 郭 睿 赵兴茹 申金山
1(河北师范大学,化学与材料科学学院,河北,石家庄 050024)2(中国环境科学研究院,国家环境保护饮用水水源地环境保护重点实验室, 北京 100012)
1 引 言
全氟化合物(PFASs)因其良好的化学稳定性和高表面活性,被广泛用于纺织、皮革、杀虫剂、工业生产和消费品中[1]。由于其广泛应用,表层水[2]、沉积物[3]、人类血液[4]等环境介质中均有检出,检出的含氟化合物类型包括如全氟烷基膦酸(PFPAs)、全氟烷基次膦酸(PFPis)和多氟烷基膦酸二酯(diPAPs)等,其中diPAPs在食品包装纸[5]和人类血清[6]中均有检出。研究表明,食品包装纸中的diPAPs可通过与食品接触进入食物从而进入人体[7]。
PFASs具有疏水疏油性质,在水中的溶解度约为0.57~46.2 g/L,因此水是其在自然界中存在的重要介质[8,9]。目前水中PFASs的萃取一般选用WAX和HLB柱,HLB柱对长碳链的全氟烷基羧酸(PFCAs)有较好萃取效果[10],WAX柱对水中PFCAs及PFSAs有较好的回收率[11],也可用于提取表层水中PFPAs及全氟辛酸(PFOS)[12]。文献中多用WAX柱富集水中PFCAs和全氟烷基磺酸(PFSAs)[13]、PFPAs[12]以及diPAPs[14],但WAX柱活化和洗脱过程均不同。水中PFCAs、PFSAs、PFPAs、PFPis和diPAPs五类化合物同时提取和分析的报道较少,研究水中多类PFASs同时提取和分析的方法可节省样品用量、溶剂用量, 提高检测率并降低对环境的危害,具有重要的实际意义。
本研究通过优化固相萃取及仪器分析条件,建立了表层水中PFCAs、PFSAs、PFPAs、PFPis和diPAPs等23种化合物同时提取分析的方法。本方法简便,灵敏度高,重现性好,可满足环境样品中PFASs分析的需要。
2 实验部分
2.1 仪器与试剂
ACQUITY超高效液相色谱-串联四极杆质谱联用仪(UPLC-MS/MS, 美国Waters公司); Milli-Q超纯水机(美国Millipore公司); GM-0.33A真空泵(中国津腾公司); 12位固相萃取装置(美国Supelco公司); 0.45 μm混合纤维素滤膜(英国Whatman公司); 150 mg Oasis WAX固相萃取柱(美国Waters公司)。
甲醇(MeOH)、乙腈(ACN)、乙酸铵(NH4AC)、乙酸(HAC)(色谱级,美国Fisher公司); NH4OH(色谱级,上海安谱公司); 四丁基硫酸氢铵(TBAS, 色谱级,美国JT Baker公司)。
标准品和内标物: 目标物包含11种PFCAs、4种PFSAs、3种PFPAs、3种PFPis和2种diPAPs。11种内标包含13C4-PFBA、13C2-PFHxA、13C4-PFOA、13C5-PFNA、13C2-PFDA、13C2-PFUnA、13C2-PFDoA、18O2-PFHxS、18O2-PFOS、13C2-6∶2 diPAP和13C2-8∶2 diPAP。23种标准品(目标物)如表1所示。标准品储备液浓度为2 μg/mL,内标储备液浓度为250 ng/mL,溶剂为甲醇。本实验所用标准品和内标物均购于加拿大Wellington实验室,纯度均高于98%。
表1 目标物质谱参数
Table 1 Mass spectrometry parameters for detection of target analytes
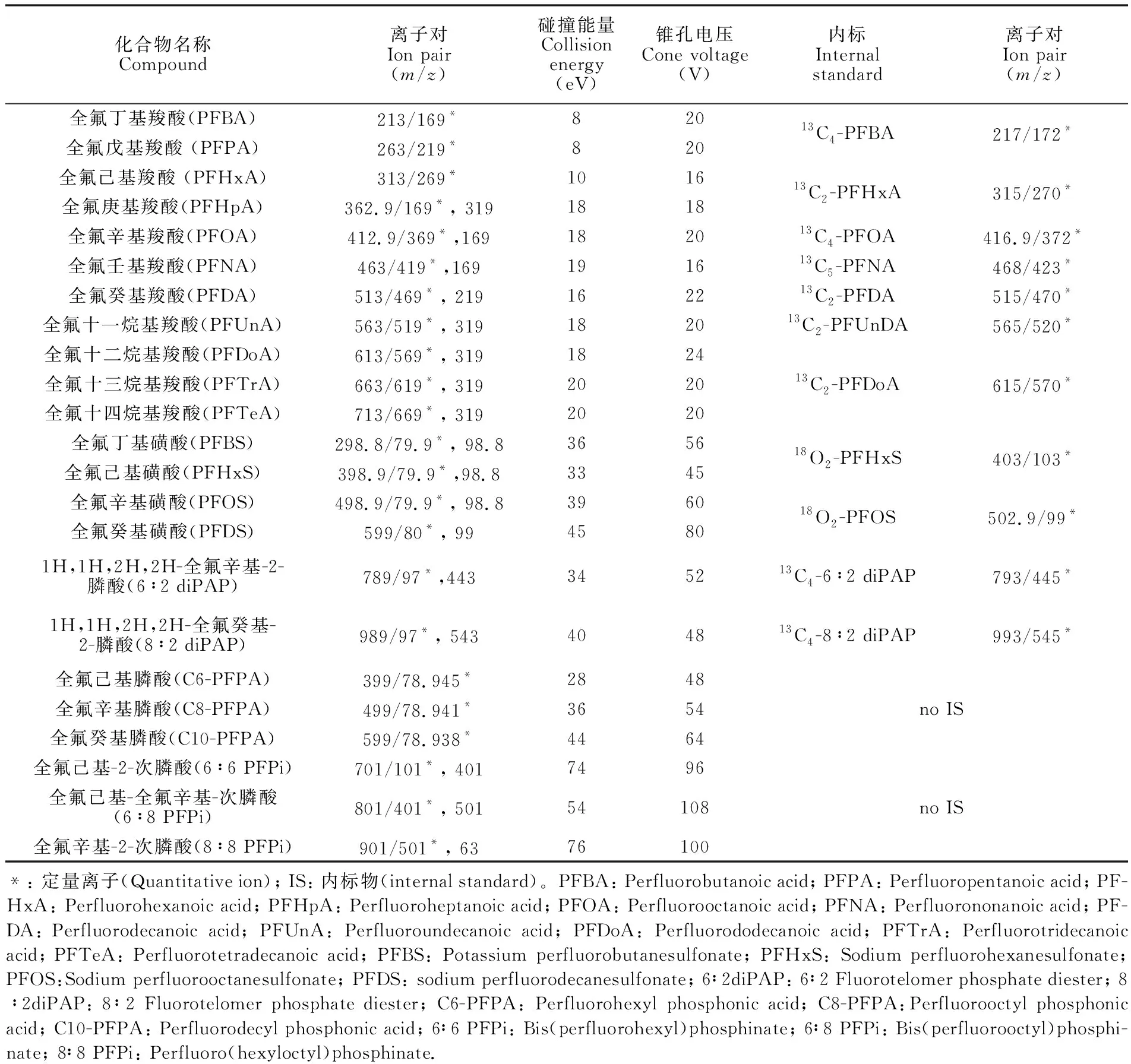
化合物名称Compound离子对Ion pair(m/z)碰撞能量Collisionenergy(eV)锥孔电压Cone voltage(V)内标Internalstandard离子对Ion pair(m/z)全氟丁基羧酸(PFBA)213/169*820全氟戊基羧酸 (PFPA)263/219*82013C4-PFBA217/172*全氟己基羧酸 (PFHxA)313/269*1016全氟庚基羧酸(PFHpA)362.9/169*, 319181813C2-PFHxA315/270*全氟辛基羧酸(PFOA)412.9/369*,169182013C4-PFOA416.9/372*全氟壬基羧酸(PFNA)463/419*,169191613C5-PFNA468/423*全氟癸基羧酸(PFDA)513/469*, 219162213C2-PFDA515/470*全氟十一烷基羧酸(PFUnA)563/519*, 319182013C2-PFUnDA565/520*全氟十二烷基羧酸(PFDoA)613/569*, 3191824全氟十三烷基羧酸(PFTrA)663/619*, 3192020全氟十四烷基羧酸(PFTeA)713/669*, 319202013C2-PFDoA615/570*全氟丁基磺酸(PFBS)298.8/79.9*, 98.83656全氟己基磺酸(PFHxS)398.9/79.9*,98.8334518O2-PFHxS403/103*全氟辛基磺酸(PFOS)498.9/79.9*, 98.83960全氟癸基磺酸(PFDS)599/80*, 99458018O2-PFOS502.9/99*1H,1H,2H,2H-全氟辛基-2-膦酸(6∶2 diPAP)789/97*,443345213C4-6∶2 diPAP793/445*1H,1H,2H,2H-全氟癸基-2-膦酸(8∶2 diPAP)989/97*, 543404813C4-8∶2 diPAP993/545*全氟己基膦酸(C6-PFPA)399/78.945*2848全氟辛基膦酸(C8-PFPA)499/78.941*3654全氟癸基膦酸(C10-PFPA)599/78.938*4464no IS全氟己基-2-次膦酸(6∶6 PFPi)701/101*, 4017496全氟己基-全氟辛基-次膦酸(6∶8 PFPi)801/401*, 50154108全氟辛基-2-次膦酸(8∶8 PFPi)901/501*, 6376100no IS*: 定量离子(Quantitative ion); IS: 内标物(internal standard)。PFBA: Perfluorobutanoic acid; PFPA: Perfluoropentanoic acid; PF-HxA: Perfluorohexanoic acid; PFHpA: Perfluoroheptanoic acid; PFOA: Perfluorooctanoic acid; PFNA: Perfluorononanoic acid; PF-DA: Perfluorodecanoic acid; PFUnA: Perfluoroundecanoic acid; PFDoA: Perfluorododecanoic acid; PFTrA: Perfluorotridecanoic acid; PFTeA: Perfluorotetradecanoic acid; PFBS: Potassium perfluorobutanesulfonate; PFHxS: Sodium perfluorohexanesulfonate; PFOS:Sodium perfluorooctanesulfonate; PFDS: sodium perfluorodecanesulfonate; 6∶2diPAP: 6∶2 Fluorotelomer phosphate diester; 8∶2diPAP: 8∶2 Fluorotelomer phosphate diester; C6-PFPA: Perfluorohexyl phosphonic acid; C8-PFPA:Perfluorooctyl phosphonic acid; C10-PFPA: Perfluorodecyl phosphonic acid; 6∶6 PFPi: Bis(perfluorohexyl)phosphinate; 6∶8 PFPi: Bis(perfluorooctyl)phosphi-nate; 8∶8 PFPi: Perfluoro(hexyloctyl)phosphinate.
2.2 实验方法
取1 L超纯水于聚丙烯样品瓶中,加入混合标准溶液和内标溶液,其终浓度分别为2 ng/L和5 ng/L, 混合均匀,进行固相萃取。依次用6 mL MeOH(含1%(V/V)NH4OH)、 2×6 mL MeOH和2×6 mL超纯水活化WAX柱,然后上样,流速为3 mL/min。上样完成后,用6 mL 25 mmol/L NH4AC(以HAC调节至pH=4.0)溶液淋洗。抽真空10 min,除去水分,用2 mL MeOH淋洗,最后依次用6 mL ACN(含0.5%(V/V)NH4OH)、6 mL MeOH(含1%(V/V)NH4OH)和6 mL ACN(含1%(V/V)NH4OH)溶液洗脱,收集洗脱液,40℃下氮吹近干。用1 mL MeOH复溶,得到样品萃取液。将样品萃取液分为不同溶液组成的3份,用于分析PFCAs和PFSAs的溶液组成为MeOH-H2O(1∶1,V/V); 用于分析PFPAs的溶液组成为MeOH-25 mmol/L TBAS(1∶1,V/V); 用于分析PFPis和diPAPs的溶液组成为MeOH,3份样品均用0.22 μm无菌聚丙烯膜过滤后进行仪器分析。
2.3 UPLC-MS/MS测定
UPLC测定条件: 柱温35℃。分析PFCAs和PFSAs的流动相A为10 mmol/L NH4AC-H2O,流动相B为10 mmol/L NH4AC-MeOH/ACN(80∶20,V/V)。梯度洗脱程序: 0~7.0 min,50%~100% B; 7.0~7.5 min,100%~50% B; 7.5~9.0 min,50% B。流速为0.3 mL/min
分析PFPAs、PFPis和diPAPs的流动相A为0.1% (V/V)NH4OH,流动相B为MeOH。梯度洗脱程序: 0~2 min,20%~50% B; 2~3 min,50%~80% B; 3~5 min,80%~86% B; 5~6 min,86%~20% B; 6~7 min, 20% B。流速为0.3 mL/min
MS测试条件: 负离子扫描下,采用多反应检测模式(MRM),电喷雾离子源(ESI——),离子源温度120℃,去溶剂温度400℃,去溶剂气流速为800 L/h,锥孔气流速为50 L/h,二者均为氮气。目标物质谱检测参数见表1。
2.4 数据处理
应用软件Masslynx V4.1处理数据。PFCAs、PFSAs和diPAPs用内标法处理,PFPAs和PFPis没有对应内标物,用外标法进行定量分析。
3 结果与讨论
提取表层水中PFASs时,多采用WAX和HLB萃取柱[8~10],因HLB柱对短碳链的PFCAs的萃取效果不佳,故研究选用WAX柱。本研究中空白加标样品中均加入混合标准溶液和内标溶液,其添加水平分别为2和5 ng/L。
3.1 固相萃取洗脱液有机相配比的优化
考察了MeOH和ACN不同配比的混合溶液对目标物的洗脱效果。取1 L超纯水空白加标样品,按照2.2节对WAX柱活化、上样及淋洗。考察不同配比洗脱液对目标物的洗脱效果,NH4OH含量固定为1%(V/V),溶剂分别为a: MeOH; b: MeOH-ACN(70∶30,V/V); c: MeOH-ACN(50∶50,V/V); d: MeOH-ACN(40∶60,V/V); e: MeOH-ACN(30∶70,V/V); f: MeOH-ACN(20∶80,V/V); g: MeOH-ACN(10∶90,V/V); h: ACN。
实验结果如图1,洗脱液a对C12以下的PFCAs、C10以下的PFSAs、diPAPs 和PFPAs有较好的回收率(87%~136%); 而洗脱液h对PFPis的洗脱效果相对较好(回收率50%~66%),此条件下,PFTrA和PFDS均达到满意的回收率(72%和73%),PFTeA的回收率仅为32%。综合5类物质的回收率,选择依次用6 mL MeOH(含1%(V/V)NH4OH)、6 mL ACN(含1%(V/V)NH4OH)洗脱目标物。
3.2 固相萃取活化及洗脱溶液中NH4OH含量的优化
研究了NH4OH含量对固相萃取活化和洗脱效果的影响。取1 L超纯水空白加标样品,根据3.1节的结论,以及表2中9种情况进行固相萃取,然后进行液相色谱-质谱联用分析。
如图2所示,在条件9中,C13以下的PFCAs和PFSAs回收率为73%~131%,PFPis回收率为52%~89%, PFPAs回收率是104%~106%,diPAPs回收率为119%~130%,其中PFHpA、PFUnA和PFHxS的回收率偏高,说明基质效应明显。而PFTeA(C14PFCAs)在条件9中的回收率为46%,因此需考察洗脱液组成对PFTeA回收率的影响。
3.3 洗脱液组成对PFTeA的影响
考虑到除PFTeA外,其它目标化合物在条件9时均能得到较高的回收率,在优化PFTeA的条件时,固相萃取柱活化条件与条件9相同,仅变化洗脱液的组成,进而优化PFTeA的回收率。因此考察NH4OH含量为0.5%(V/V),溶剂分别为MeOH、ACN及MeOH-ACN(1∶1,V/V)的洗脱液对PFTeA洗脱效果的影响。如图3所示,洗脱液为6 mL ACN(含0.5%(V/V)NH4OH)时,PFTeA可得到较好的回收率(83%),RSD为3.6%。
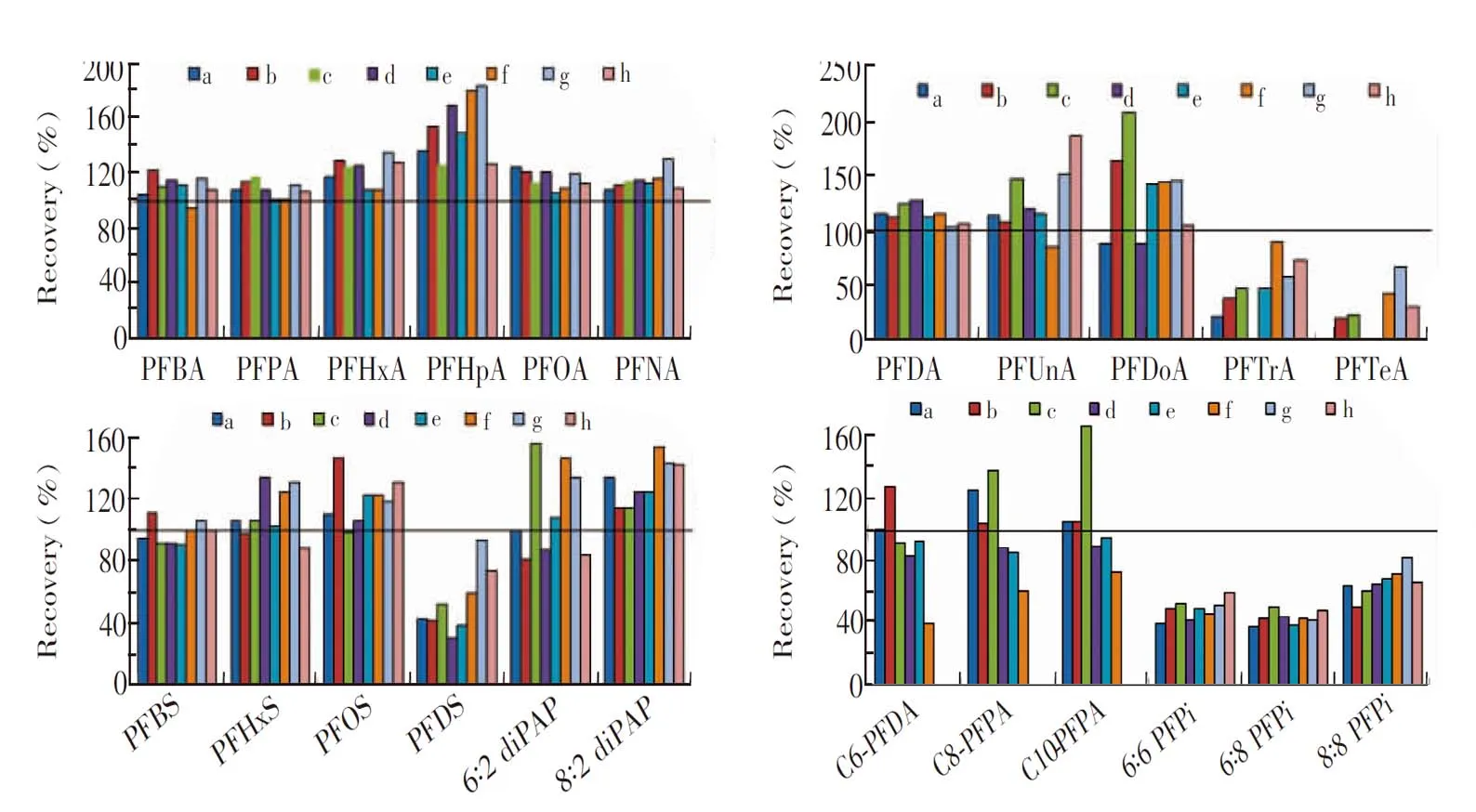
图1 不同有机配比洗脱液对目标物洗脱效果的影响Fig.1 Effects of different organic ratio eluents on recoveries of target compoundsa: Methanol (MeOH); b: MeOH-acetonitrile (ACN)(70∶30,V/V); c: MeOH-ACN(50∶50,V/V); d: MeOH-ACN(40∶60,V/V); e: MeOH-ACN(30∶70,V/V); f: MeOH-ACN(20∶80,V/V); g: MeOH-ACN(10∶90,V/V); h: ACN
表2 固相萃取活化及洗脱溶液组成
Table 2 Composition of activation solution and elution
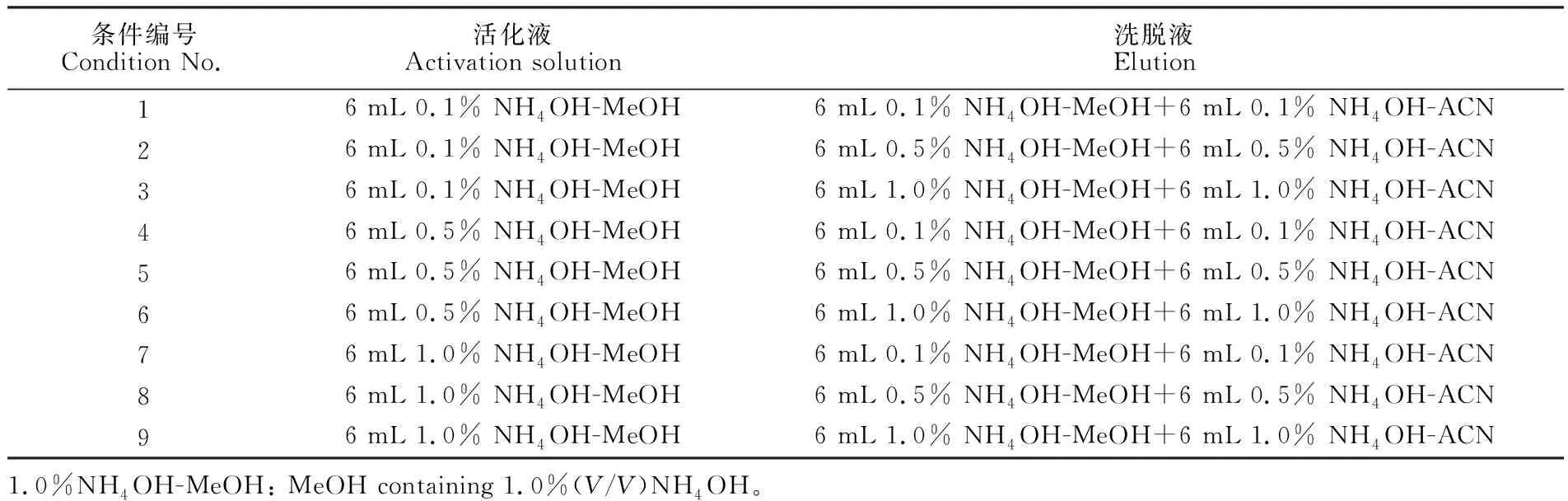
条件编号Condition No.活化液Activation solution洗脱液Elution16 mL 0.1% NH4OH-MeOH6 mL 0.1% NH4OH-MeOH+6 mL 0.1% NH4OH-ACN26 mL 0.1% NH4OH-MeOH6 mL 0.5% NH4OH-MeOH+6 mL 0.5% NH4OH-ACN36 mL 0.1% NH4OH-MeOH6 mL 1.0% NH4OH-MeOH+6 mL 1.0% NH4OH-ACN46 mL 0.5% NH4OH-MeOH6 mL 0.1% NH4OH-MeOH+6 mL 0.1% NH4OH-ACN56 mL 0.5% NH4OH-MeOH6 mL 0.5% NH4OH-MeOH+6 mL 0.5% NH4OH-ACN66 mL 0.5% NH4OH-MeOH6 mL 1.0% NH4OH-MeOH+6 mL 1.0% NH4OH-ACN76 mL 1.0% NH4OH-MeOH6 mL 0.1% NH4OH-MeOH+6 mL 0.1% NH4OH-ACN86 mL 1.0% NH4OH-MeOH6 mL 0.5% NH4OH-MeOH+6 mL 0.5% NH4OH-ACN96 mL 1.0% NH4OH-MeOH6 mL 1.0% NH4OH-MeOH+6 mL 1.0% NH4OH-ACN1.0%NH4OH-MeOH: MeOH containing 1.0%(V/V)NH4OH。
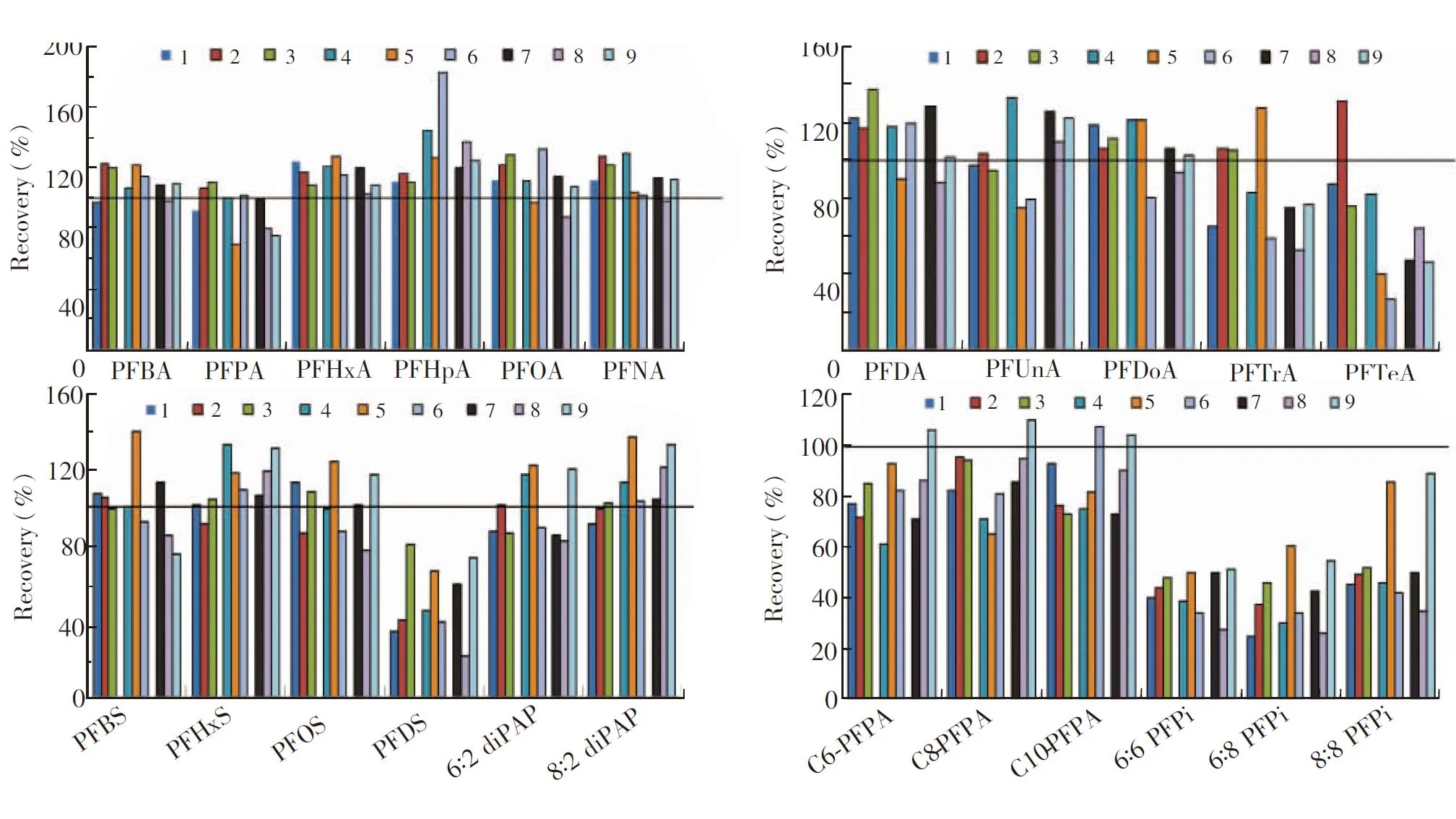
图2 NH4OH含量对目标物回收率的影响Fig.2 Effects of different ammonia solution on recoveries of target compoundsCompositions of solution 1 to 9 are the same as in Table 2
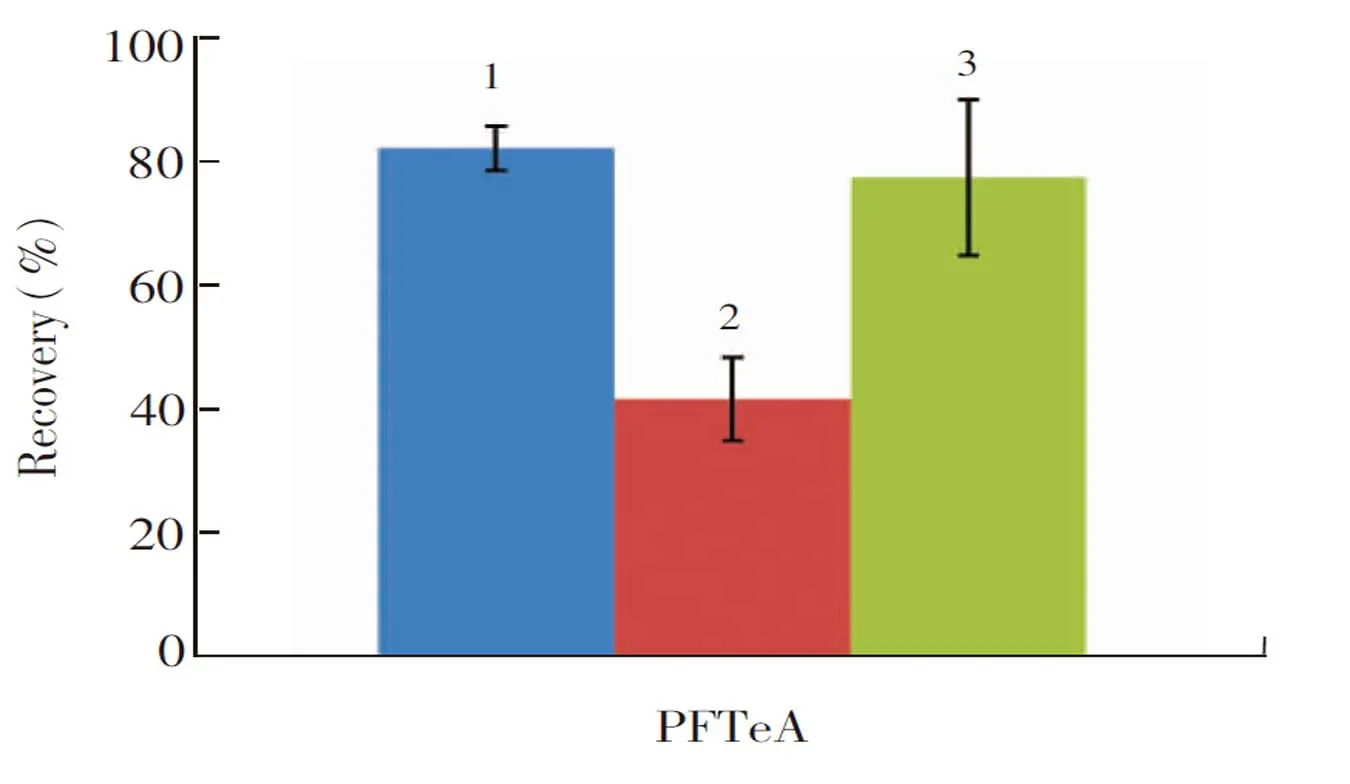
图3 洗脱液组成对PFTeA回收率的影响Fig.3 Effects of elution composition on recoveries of PFTeA1. ACN containing 0.5% (V/V) NH4OH; 2. MeOH containing 0.5% (V/V) NH4OH; 3. MeOH-ACN (50∶50, V/V) containing 0.5% (V/V) NH4OH.
根据图2及图3所示的回收率结果,最终选择的条件为: 固相萃取柱依次用6 mL MeOH含1.0% (V/V)NH4OH、12 mL MeOH、12 mL H2O活化,样品上样后,依次用6 mL ACN(含0.5%(V/V)NH4OH),6 mL MeOH(含1.0%(V/V)NH4OH)和6 mL ACN(含1.0%(V/V)NH4OH)洗脱,以确保所有目标化合物均能得到满意的回收率。
3.4 方法回收率
按2.2节方法,取1 L超纯水空白加入混合标准溶液和内标溶液,配制成空白加标样品,PFCAs、PFSAs、PFPis和diPAPs的添加水平(终浓度)分别为0.5、2和20 ng/L,PFPAs为2、10和20 ng/L,每个加水平重复做3个平行样品,计算各目标物回收率和相对标准偏差(RSD)。如图4所示,23种目标物的平均加标回收率为55%~125%,RSD为0.3%~15.0%。相比于文献中PFCAs和PFSAs的回收率36%~125%[13],更有利于水中PFASs的提取。
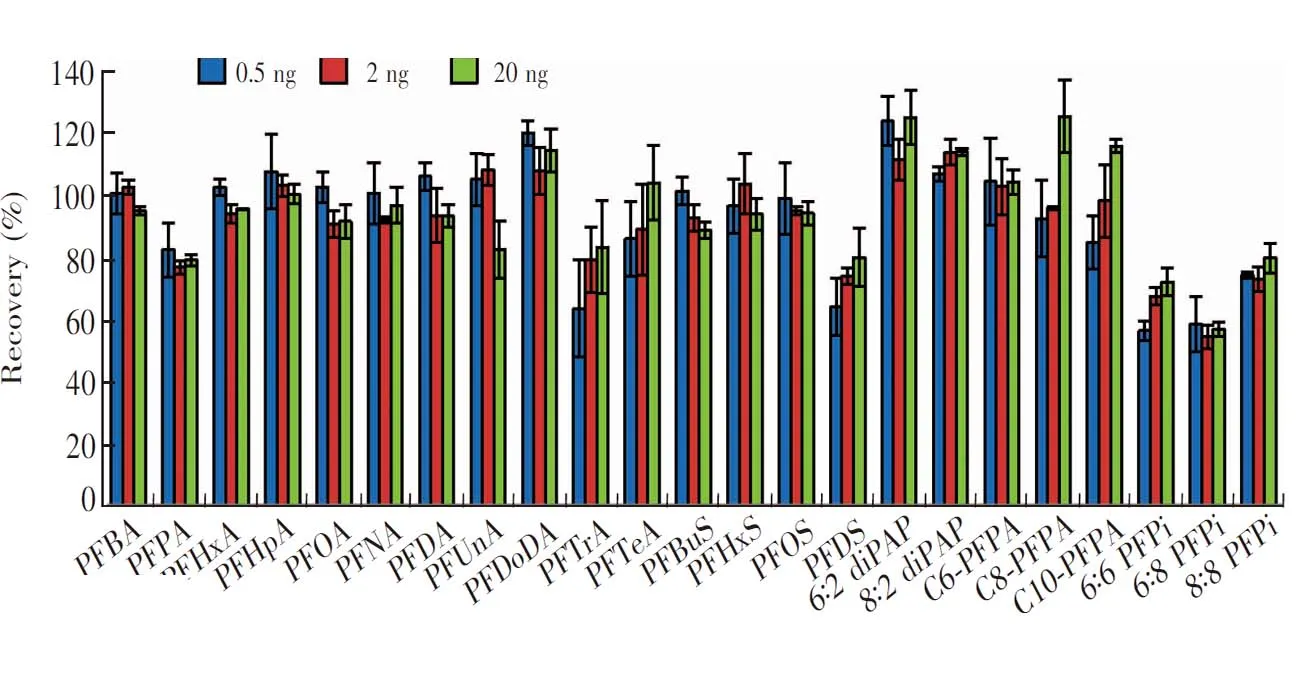
图4 目标物的回收率 (n=3)Fig.4 Recoveries of target compounds (n=3)
3.5 PFPAs样品溶液组成优化
为了得到更好的灵敏度和对称峰形,对PFPAs样品溶液组成进行优化。按MeOH-H2O(1∶1,V/V)、MeOH-25 mmol/L TBAS(1∶1,V/V)和纯MeOH组成配制PFPAs混合标准溶液,进行仪器分析。如图5所示,以MeOH-25 mmol/L TBAS(1∶1,V/V)制备的PFPAs标准溶液有更好的对称峰形。故选择使用MeOH: 25 mmol/L TBAS(1∶1,V/V)分析PFPAs。
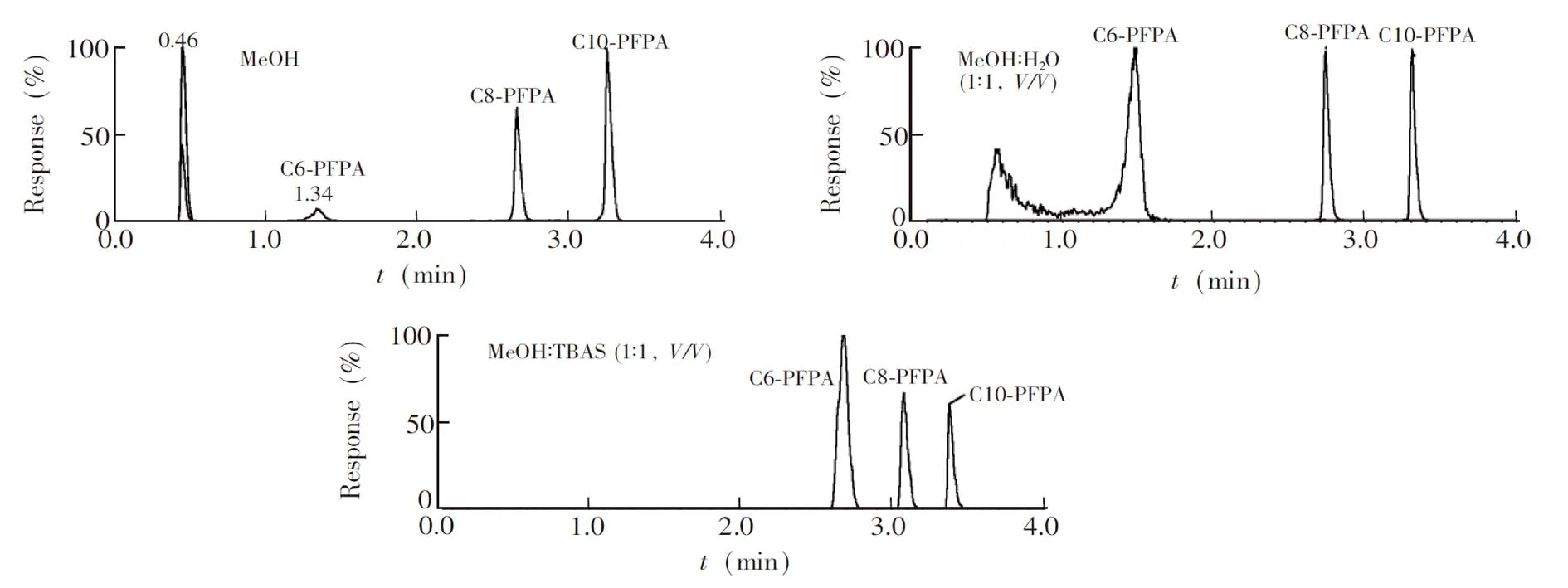
图5 溶液组成对PFPAs标准溶液色谱分离效果的影响Fig.5 Effect of sample solvent composition on chromatographic separation of PFPAs standard solution
3.6 PFPis样品溶液组成优化
实验发现,PFPis的回收率与溶液组成有直接关系。考虑到复溶溶液为MeOH,考察了纯MeOH及MeOH-H2O(1∶1,V/V)对回收率的影响。如图6所示,溶液为MeOH时,3种PFPis中,高、低加标水平的平均回收率为55%~89%,回收率及重现性较好。故后续使用纯MeOH的溶液分析PFPis。
3.7 方法学质量控制
取超纯水,加入一定浓度混合标准溶液,配制成空白加标样品,按2.2节前处理后进行仪器分析。以3倍信噪比为方法检出限,10倍信噪比为定量限,结果见表3。本方法检出限和定量限分别为0.003~0.215 ng/L和0.01~0.714 ng/L,线性相关系数大于0.99,满足定量分析要求。与文献[8]报道的方法(检出限0.01~0.127 ng/L)相比,本方法灵敏度更高,分析的化合物种类更多。
3.8 实际样品分析
取辽宁省抚顺市大伙房水库(DHF)10个采样点的表层水样各1 L,用0.45 μm滤膜过滤后,按2.2节进行前处理,然后进行UPLC-MS/MS测定,结果见图7。表层水中目标物检测浓度范围在ND(未检出)~11.2 ng/L之间,其中PFOA和PFOS总含量为18.8 ng/L,低于饮用水中EPA建议的PFOA和PFOS安全参考值70 ng/L[14],DHF-7中6∶2diPAP含量较高(11.2 ng/L)。
表3 方法的检出限、定量限及线性相关系数
Table 3 Limits of detection, limits of quantification and correlation coefficients of this method
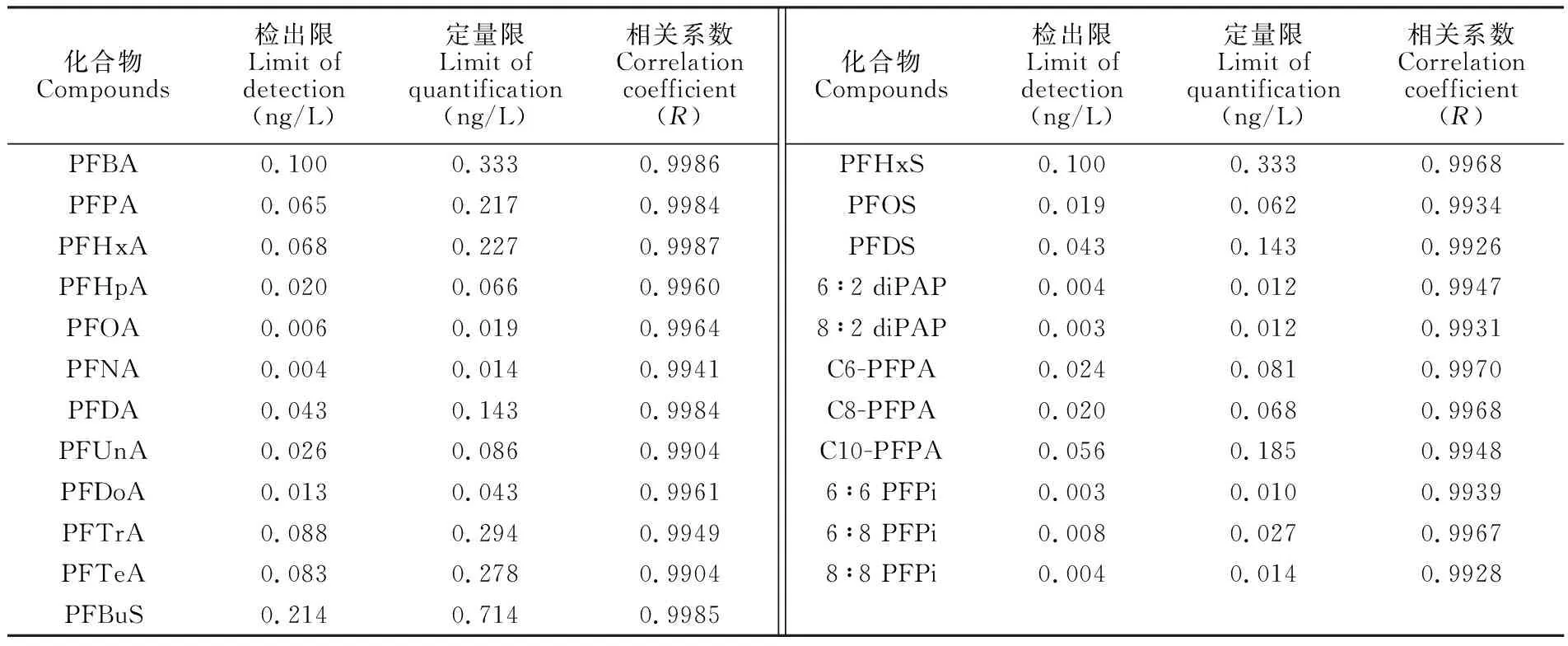
化合物Compounds检出限Limit ofdetection(ng/L)定量限Limit ofquantification(ng/L)相关系数Correlationcoefficient(R)PFBA0.1000.3330.9986PFPA0.0650.2170.9984PFHxA0.0680.2270.9987PFHpA0.0200.0660.9960PFOA0.0060.0190.9964PFNA0.0040.0140.9941PFDA0.0430.1430.9984PFUnA0.0260.0860.9904PFDoA0.0130.0430.9961PFTrA0.0880.2940.9949PFTeA0.0830.2780.9904PFBuS0.2140.7140.9985化合物Compounds检出限Limit ofdetection(ng/L)定量限Limit ofquantification(ng/L)相关系数Correlationcoefficient(R)PFHxS0.1000.3330.9968PFOS0.0190.0620.9934PFDS0.0430.1430.99266∶2 diPAP0.0040.0120.99478∶2 diPAP0.0030.0120.9931C6-PFPA0.0240.0810.9970C8-PFPA0.0200.0680.9968C10-PFPA0.0560.1850.99486∶6 PFPi0.0030.0100.99396∶8 PFPi0.0080.0270.99678∶8 PFPi0.0040.0140.9928
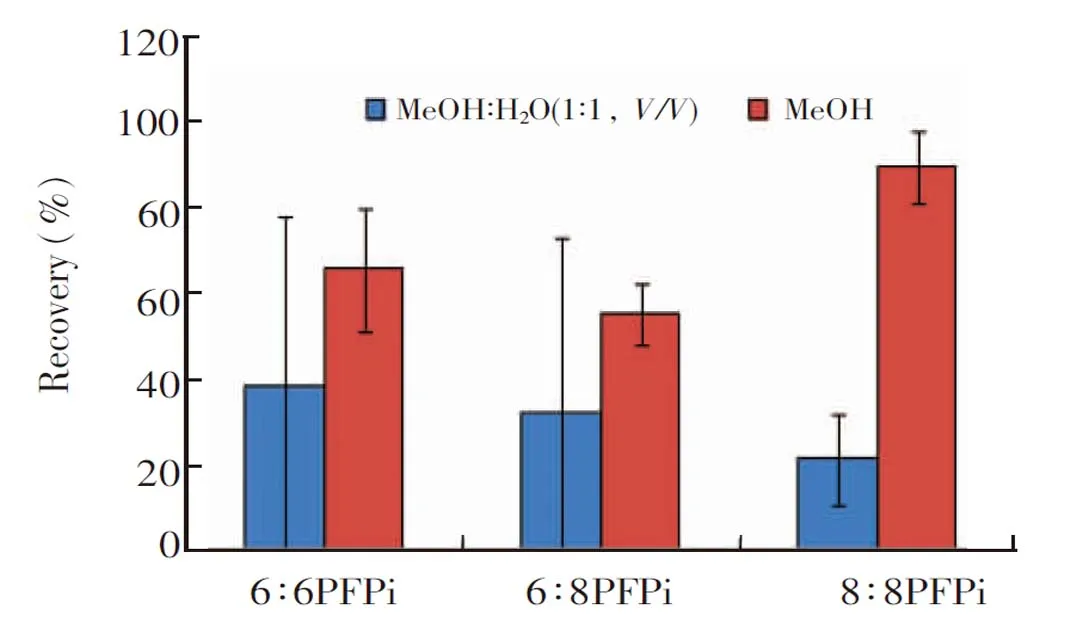
图6 溶剂组成对PFPis样品回收率的影响Fig.6 Effect of solvent composition on recovery of PFPis
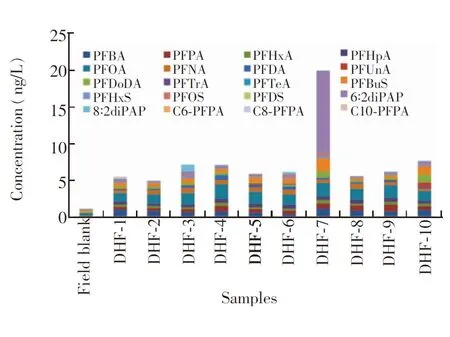
图7 大伙房水库表层水中目标物含量Fig.7 Concentrations of target compounds in surface water of Dahuofang Reservoir
4 结 论
建立了SPE-UPLC-MS/MS分析方法,分析水中23种PFASs,平均加标回收率为55%~125%,检出限和定量限分别为0.003~0.215 ng/L和0.01~0.714 ng/L。本方法简便,灵敏度高,稳定性好,可用于水样中5类PFASs的检测。
