β-淀粉样蛋白的分析检测方法研究进展
2018-09-11王晓英王小兵
蒋 萌 王晓英* 王小兵
1(环境医学工程教育部重点实验室, 东南大学公共卫生学院, 南京 210009)2(天然药化教研室, 中国药科大学中药学院, 南京 210009)
1 引 言
阿尔兹海默症(Alzheimer′s disease,AD)是不可逆的神经退行性疾病,是痴呆最常见的病因,临床表现为记忆、认知障碍,日常生活能力下降等。随着人口的老龄化,AD的发病率越来越高,不仅危害老年人的健康,也给家庭和社会带来了沉重负担,已引起了广泛关注。β-淀粉样蛋白(Amyloidβ-proein,Aβ)级联假说[1]认为Aβ聚集过程中形成具有神经毒性的低聚物和纤维体,进而沉积形成的老年斑是诱发AD的重要因素。众多临床研究提示, 血液、脑脊液和脑组织内的Aβ水平异常与AD的病程进展密切相关,Aβ已成为目前研究AD的重要生物标志物之一。
Aβ是淀粉样前体蛋白(APP)由β、γ-分泌酶经复杂的酶切而产生[2],即APP经β-分泌酶切割生成C99(保留APP最后99个氨基酸),C99随后被γ-分泌酶在C端的不同位置切割生成不同长度的Aβ,主要生成含有40或42个氨基酸的多肽Aβ40和Aβ42。Aβ存在多种形态,如Aβ单体(AβM)和Aβ低聚物(AβO)和Aβ纤维体(AβF)。研究表明,Aβ的单体形式没有神经毒性,而通过成核依赖性复合过程形成的低聚物和纤维体显示出神经毒性[3],Aβ的非正常聚集是AD病的病理基础,在AD病的早期诊断、跟踪、预防和治疗中具有重要价值。而Aβ聚集过程的动力学不稳定性造成了对其检测困难,因此建立灵敏、高效检测不同形态Aβ的分析方法是十分必要的。近年来,关于Aβ分析检测方法研究取得了诸多进展,也已有一些从不同角度对Aβ分析方法的评述与报道[4~8],但并没有全面反映近年来Aβ分析检测方法的研究进展。本文对目前Aβ的检测方法(如神经成像、光学及免疫检测方法)进行了概述和比较。根据识别元件的不同, 重点阐述6类新型电化学生物传感方法(包括无标记、抗体、多肽、凝溶胶蛋白、血红素和多种识别元件联用)在Aβ检测方面的相关应用与最新研究进展,对未来的发展趋势进行了展望,为其深入研究与应用提供参考。
2 Aβ的常规检测方法
目前,Aβ的常规检测方法主要有神经成像方法、光学检测方法及免疫检测方法等。神经成像方法是能直接或间接对神经系统(主要是脑)的功能、结构和药理学特性进行成像的技术,是AD医学研究和临床诊断的重要手段,主要有磁共振成像(MRI)[9,10]、近红外荧光(NIRF)[11~13]和正电子发射断层扫描(PET)[14,15]等。目前,这些成像方法对Aβ的研究基本都是定性研究。MRI可识别脑中各个区域的Aβ斑块,但需使用造影剂(如钆二亚乙基三胺五乙酸[9]、台盼蓝[10]等)提高灵敏度,由于造影剂的毒性和需穿越血脑屏障等因素, 限制了体内成像的可能。NIRF因适宜的穿透深度和无创操作而成为Aβ体内成像的有力技术。常用的NIRF探针有荧光纳米颗粒(如CdSe/ZnS量子点[11])、体内成像示踪剂(如姜黄素类似物CRANAD-58[12,13])。由于光学成像的分辨率随着荧光发射源深度的增加而降低,所以NIRF对Aβ的识别仅限于脑的外表面。PET使用放射性示踪剂识别脑内Aβ斑块,常用放射性示踪剂为11C和18F同位素,二者半衰期较短,分别为20和110 min[14],这极大地制约了该技术的应用与发展。
光学检测方法包括比色法[15,16]、表面荧光强度分布分析(sFIDA)[17,18]、表面等离子共振(SPR)[19,20]、共振光散射(RLS)[21,22]、荧光共振能量转移(FRET)[23]、表面增强拉曼散射(SERS)[24]和荧光传感器[25,26]等(表1)。光学检测方法响应时间短, 分辨率高, 可实现非接触检测,但易受到干扰,稳定性较差。其中,比色传感器由于可视化、低成本和简单快速而广受关注。Deng等[16]以纳米金(AuNPs)为比色探针,AuNPs吸附的适配体(适配体@AuNPs)为Aβ40的结合元件。适配体@AuNPs在高盐条件下聚集形成蓝紫色;加入Aβ后,Aβ与适配体结合形成复合物,附着在AuNPs表面,增加纳米金颗粒的耐盐性, 使AuNPs保持分散状态,溶液呈粉红色,以加入Aβ前后溶液的吸收强度比实现定量检测,检出限LOD为10 nmol/L。sFIDA是一种特异性检测AβO的定量方法,类似于常规夹心酶联免疫吸附测定(ELISA),即Aβ先通过捕获抗体被固定在功能化的玻璃表面上,再结合至少两种以不同荧光染料标记的检测抗体,最后经高分辨率荧光显微镜对表面进行成像。因所用检测抗体均能识别Aβ N-末端部分中的重叠表位,只有AβO可以同时固定结合两种检测抗体,因此sFIDA对AβO较AβM敏感。Kühbach等[18]对384孔板官能化以固定捕获抗体Nab228,加入AβO样品孵育,进一步与Alexa 488和Alexa 647标记的检测抗体6E10和Nab228培育,进而实现sFIDA测定,AβO的LOD为22 fmol/L。SPR是一种研究分子之间相互作用的有效方法,具有灵敏度高、无标记和实时测量等特点,已被用于检测金属离子螯合剂、短肽及抗体与Aβ的相互作用。Xia等[20]先将链霉亲和素交联到覆有聚乙二醇(PEG)自组装单层的SPR芯片上,用于固定来自两个不同流体通道中生物素化的Aβ40和Aβ42抗体,进一步捕获Aβ40和Aβ42,用SPR测定Aβ40和Aβ42的LOD分别为3.3和3.5 pmol/L。RLS基于弹性光散射,具有灵敏、快速和方便的特点。Yu等[22]用Fe3O4@Au复合物为RLS探针结合Aβ,在463.0 nm处测定RLS强度比I/I0(结合/未结合Aβ),LOD为1.2 fmol/L。FRET与供、受体分子间的空间距离紧密相关。Xia等[23]选择AuNPs、CdTe量子点作为供、受体分子。首先多肽PrP(95-110)吸附于AuNPs使之发生聚集,其对CdTe的FRET作用减弱,荧光增强;当AβO与多肽特异性结合,AuNPs无法聚集,使得CdTe荧光减弱,根据荧光变化定量检测AβO,LOD为0.2 nmol/L。此外,SERS也成为检测Aβ的有力技术,通过等离子体基质上电磁场强化的拉曼散射提供分子结构和分子组成的信息。Teresa等[24]先将氨基官能化的Fe2O3@Au的核壳纳米粒子通过酰胺键交联于氧化石墨烯,再偶联Aβ抗体连接Aβ,通过施加激光使纳米粒子产生特定拉曼光谱带以检测Aβ,LOD为500 fg/mL。
表1 Aβ的光学检测方法的比较
Table 1 Comparison of optical techniques for detection of Aβ pepetide

方法Method信号元件Signal element识别元件Recognition element检测范围Detection range检出限LOD文献References比色法Colorimetric method金纳米颗粒Gold nanoparticlesCu2+10.5~313.5 nmol/L0.6 nmol/L[15]金纳米颗粒Gold nanoparticles适配体Aptamer35~700 nmol/L10 nmol/L[16]表面荧光强度分布分析sFIDAAlexa 633ATTO 488Antibody IC16、6E1010~105 fmol/L1.9 ng/L[17]Alexa 488Alexa 647Antibody 6E10、Nab22810~105 fmol/L22 fmol/L[18]表面等离子体共振SPR银纳米颗粒Silver nanoparticlesAntibody M71Antibody 20C210~105 pmol/L100 fmol/L[19]链霉亲和素生物素Streptavidin BiotinAntibody 11A50-B1012F4、6E100.02~150 nmol/LAβ40: 3.3 pmol/LAβ42: 3.5 pmol/L[20]共振光散RLS金纳米颗粒Gold nanoparticles抗体Antibody0.1~104 ng/mL50 pg/mL[21]Fe3O4@ Au-5~5560000 fmol/L1.2 fmol/L[22]荧光共振能量转移FRET量子点Quantum dotsPrP (95-110)0.5~100 nmol/L0.2 nmol/L[23]表面增强拉曼散射SERS纳米颗粒Nanoparticles抗体Antibody0~6 pg/mL500 fg/mL[24]荧光传感器Fluorescence sensorBaYF5∶Yb,Er纳米颗粒BaYF5∶Yb,Er nanoparticles适配体Aptamer0.2~15 nmol/L36 pmol/L[25]羧基荧光素Carboxyl fluorescein适配体Aptamer20~10000 nmol/L12.5 nmol/L[26]sFIDA, surface-based fluorescence intensity distribution analysis; SPR, surface plasmon resonance; RLS, resonance light scattering; FRET, fluorescence resonance energy transfer; SERS, surface enhanced Raman spectroscopy.
基于抗原抗体特异性反应的免疫检测方法包括酶联免疫吸附分析(ELISA)[27,28]、比色免疫法[29]、磁珠免疫法[30,31]、微阵列免疫法[32,33]和毛细管等电聚焦(CIEF)免疫测定[34]等,也是检测Aβ的常用方法(表2)。这些免疫技术通常受到交叉反应和高非特异性结合的影响,且所使用的抗体相对昂贵。现已使用的Aβ抗体有BAN50(检测分子量40~200 kDa的AβO)、82E1(检测分子量高于10 kDa的AβO)、NAB61(检测Aβ二聚体,低聚物和纤维体的病理构象)、Nab228(检测10~25 kDa的AβO)和4G8(检测Aβ的17~24的中心区域氨基酸)等。常规的ELISA主要局限于操作步骤复杂、耗时长,而比色免疫比较直观、简单。Hu等[29]建立了一种AuNPs修饰双抗体的Aβ42比色夹心免疫传感器。分别制备AuNPs修饰的C末端和N末端抗体(C-Ab-AuNP、N-Ab-AuNP),二者与Aβ42孵育形成夹心复合物,引发溶液呈现红色到蓝色的明显变化,通过吸收峰强度的差值定量检测Aβ,LOD为2.3 nmol/L。此外,以磁珠作为捕获抗体的固载物更易于分离和再生,如Pi等[31]构建了基于量子点(λem=525 nm)和磁性分离的三明治免疫法检测Aβ42,先将生物素化C末端抗体连接到链霉亲和素包被的磁珠上,再加入生物素化N末端抗体-链霉亲和素修饰的量子点,在Aβ42存在下,形成夹心复合物, 从而将量子点捕获到磁珠上,经磁性分离,上清液中量子点的荧光强度随Aβ浓度的增加而降低,LOD为0.2 nmol/L。微阵列能将一维材料按一定方式排列起来, 构成阵列体系,易于规模化。Gagni 等[32]将捕获抗体固定在聚合物涂覆的硅微阵列平台上, 特异性识别Aβ42,随后与生物素-检测抗体和荧光素-链霉亲和素同时孵育,测定荧光素的荧光强度,检测Aβ42的LOD为73.07 pg/mL。CIEF免疫技术是集样品前处理与样品测定于一体的新型技术。Haußmann等[34]先使用抗体6E10对细胞培养液中Aβ进行免疫沉淀,再通过毛细管等电聚焦分析以洗脱Aβ;洗脱液中依次加入抗体6E10、生物素化抗鼠二抗、链霉亲和素-辣根过氧化物酶和鲁米诺/过氧化物进行免疫测定,通过测量化学发光信号可以检测低至2 ng/mL的Aβ。
表2 检测Aβ的免疫方法的比较
Table 2 Comparison of immunoassay methods for detection of Aβ
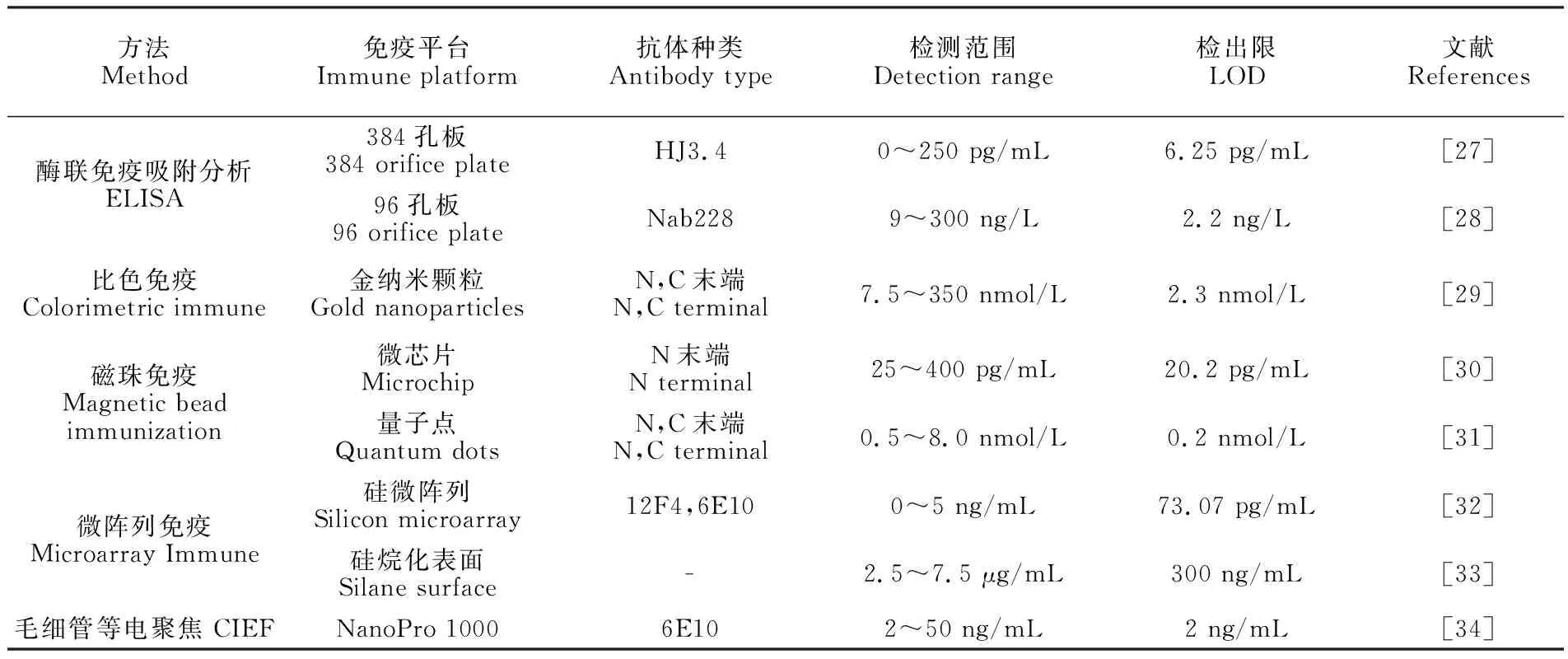
方法Method免疫平台Immune platform抗体种类Antibody type检测范围Detection range检出限LOD文献References酶联免疫吸附分析ELISA384孔板384 orifice plateHJ3.40~250 pg/mL6.25 pg/mL[27]96孔板96 orifice plateNab2289~300 ng/L2.2 ng/L[28]比色免疫Colorimetric immune金纳米颗粒Gold nanoparticlesN,C末端N,C terminal7.5~350 nmol/L2.3 nmol/L[29]磁珠免疫Magnetic beadimmunization微芯片MicrochipN末端N terminal25~400 pg/mL20.2 pg/mL[30]量子点Quantum dotsN,C末端N,C terminal0.5~8.0 nmol/L0.2 nmol/L[31]微阵列免疫Microarray Immune硅微阵列Silicon microarray12F4,6E100~5 ng/mL73.07 pg/mL[32]硅烷化表面Silane surface-2.5~7.5 μg/mL300 ng/mL[33]毛细管等电聚焦 CIEFNanoPro 10006E102~50 ng/mL2 ng/mL[34]
目前,Aβ常规检测方法在灵敏度、分析速度及检测成本方面仍有很大的发展空间。因此,开发高效、准确、快速、简便的Aβ检测新方法,对AD人群同步筛查与检测,AD病情、病程变化跟踪监护,进而实施针对性干预与治疗具有重要意义。
3 电化学生物传感方法检测Aβ
电化学生物传感方法是利用生物活性材料(如酶、蛋白、抗体、微生物及核酸等)作为识别元件,将生化反应转变成可定量的物理/化学信号,从而进行物质检测的技术。由于仪器设备简单、选择性好、灵敏度高、响应快速、成本低及不受样品颜色和浊度的影响等突出特征,电化学生物传感器(换能器为电化学电极)是目前研究Aβ最具潜力的一种快速简便的新型方法。本文根据识别元件的不同,对近几年检测Aβ的电化学生物传感器分别进行简要评述。
3.1 无识别元件的电化学生物传感器
无识别元件的电化学生物传感器无需标记且简单有效。Aβ聚集引起结构构象变化, 影响Aβ氨基酸序列中第10位酪氨酸(Tyr10)暴露于Aβ表面的程度,Tyr10残基在电极表面易氧化,基于此可直接研究Aβ的聚集过程,但定量检测较困难。如Vestergaard等[35]首先使用循环伏安法(CV)、示差脉冲伏安法(DPV)和方波伏安法(SWV)3种技术检测玻碳电极上Aβ序列中Tyr10氧化信号的变化,进而研究Aβ40和Aβ42的聚集过程,结果显示两种肽的聚集过程有显着差异。Veloso等[36]采用SWV研究Tyr10在印刷电极表面氧化信号的减少,进而筛选Aβ聚集抑制剂β-折叠片状五肽。Suprun等[37]研究发现,Aβ序列中Tyr10、3个组氨酸(His6、His13和His14)及甲硫氨酸(Met35)残基的氧化电流随着Aβ42的聚集而降低。Enache等[38]发现Aβ电化学氧化行为取决于上述这5种氨基酸残基及Aβ肽的长度、疏水性及3D结构。
除了上述直接检测Tyr10的方法,还有应用电活性物质的电化学生物传感器,如Zhang等[39]将二茂铁(Fc)连接到Aβ聚集的核心片段(KLVFFAE),通过CV、DPV测量Fc氧化电流随Aβ孵育时间的变化, 实现Aβ聚集过程的电化学检测;并通过监测姜黄素(一种抑制Aβ聚集的电活性酚类化合物)对聚集的影响,验证该方法适用于Aβ抑制剂简单的筛选。此外,EI-Said等[40]在氧化铟锡电极上电沉积AuNPs以吸附Aβ,采用CV进行检测(图1),在0.8 V处显示出特征性的氧化峰,LOD为20.7 ng/g。将该方法应用于AD诱导大鼠脑中提取的Aβ样品,CV图显示雄雌大鼠都在0.8 V处出现峰值,证明该方法检测实际样品的可行性。
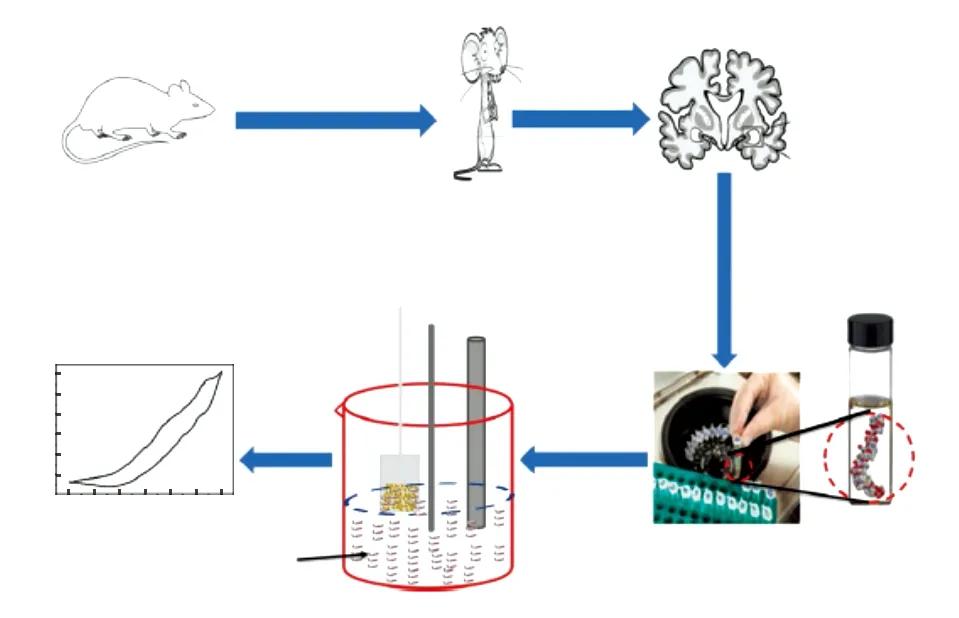
图1 体外监测Aβ的无标记电化学传感器[40]Fig.1 Label-free electrochemical sensor for ex-vivo monitoring Aβ[40]
3.2 基于Aβ抗体的电化学生物传感器
基于Aβ抗体的电化学生物传感器使用较为广泛(表3)。Prabhulkar等[41]将3种抗体(mHJ2、mHJ7.4、mHJ5.1)分别置于碳纤维微电极上,抗体mHJ2和mHJ7.4分别识别Aβ40和Aβ42;抗体mHJ5.1既识别Aβ17~28,又同时识别Aβ40和Aβ42,作为阳性对照;通过SWV检测Tyr10的氧化电流信号进行定量分析。检测Aβ40和Aβ42的线性范围分别为20和50 nmol/L和20~140 nmol/L, LOD均为20 nmol/L。Li等[42]在磁性氮掺杂石墨烯上固载抗体,经磁吸附至丝网印刷金电极上构建免疫传感器,以铁氰化钾为探针,用DPV检测Aβ42加入前后的电流变化值, 进而实现Aβ定量分析,LOD为5 pg/mL。
表3 基于Aβ抗体的电化学生物传感器
Table 3 Electrochemical biosensor based on Aβ antibody
AuNPs因其优良的光电特性和生物相容性而广泛应用于基于抗体的Aβ电化学生物传感器,主要包括电极修饰和抗体标记。Wu等[43]以沉积AuNPs的氧化铝膜为固载电极捕获抗体12F4,用于EIS检测Aβ42, 线性范围为1~10000 pg/mL,LOD为0.01 pg/mL。Lien等[44]在印刷芯片上建立3种(方法A、B、C)Aβ阻抗免疫传感器,它们均由固定在电极上的抗体与Aβ之间的特异性免疫反应产生信号,但电极表面修饰不同。结果表明,方法C的 LOD最低,为0.57 nmol/L。Carneiro等[45]在巯基丙酸(MPA)修饰的金电极上电沉积AuNPs,进而组装抗体DE2B4(结合Aβ 1~17的氨基酸区域)用于直接检测Aβ,采用SWV、EIS得到LOD为5.2 pg/mL。de la Escosura-Muiz等[46]通过多孔磁性微球固载Aβ捕获抗体,进一步结合Aβ和AuNPs标记检测抗体, 形成三明治复合物,由计时电流法(CA)检测盐酸中AuNPs的阴极电流。多孔磁性微球的高孔隙可有效增加表面积,提高检测的灵敏度,LOD低至19 pg/mL。该方法首次应用于AD患者血清、血浆和脑脊液中Aβ的检测,血清和血浆中未检出,脑脊液中Aβ浓度为(811±40) pg/mL,与ELISA测定结果一致。Liu等[47]在MPA修饰电极上固载抗体6E10(识别所有Aβ片段的共同N末端)以捕获复合物(Aβ16-血红素-AuNPs),复合物可催化O2为H2O2产生电流。因目标物Aβ40/42、复合物与6E10竞争结合, 导致催化电流下降,该方法可检测10 pmol/L的Aβ40/42。Han等[48]制备了新型Au@Fc-Zn-MOF作为检测抗体标记物,将石墨烯、氨基末端化聚乙二胺大分子修饰电极上结合AuNPs,并连接捕获抗体/Aβ/Au@Fc-Zn-MOF标记抗体,最后采用SWV检测,检测Aβ的浓度范围为0.0001~100 ng/mL,LOD为0.03 pg/mL。
酶因其高催化活性已在Aβ检测中得以应用,主要包括碱性磷酸酶(ALP)和葡萄糖氧化酶(GOD)。Rama等[49]首先在AuNPs修饰的丝网印刷电极上固载生物素化Aβ,当加入目标物Aβ和Aβ抗体的混合溶液时,生物素化Aβ和目标物竞争性结合Aβ抗体,最后与连接ALP的IgG孵育,ALP催化底物3-吲哚基磷酸酯与Ag+的混合物产生电信号,检测Aβ的浓度范围为0.5~500 ng/mL,LOD为0.1 ng/mL。此外,Liu等[50]通过对氨基苯酚氧化还原循环建立检测Aβ的竞争性免疫法,电极上固载的抗体捕获Aβ复合物(链霉亲和素-ALP/生物素-Aβ的复合物),ALP催化对氨基苯基磷酸产生电化学活性物对氨基苯酚,并在还原剂三(2-羧乙基)膦存在下,对氨基苯酚可在电极上进行氧化循环从而实现信号放大。因目标物Aβ和Aβ复合物竞争性结合固载抗体,因此电流随目标物Aβ浓度的增加而降低,LOD为5 pmol/L。 Diba等[51]应用PEG、MPA、AuNPs修饰丝网印刷碳电极构建基于抗体12F4/Aβ/抗体1E11-ALP的夹心测定法(图2A),通过DPV检测ALP和底物4-氨基苯酚磷酸酯之间的特异性电催化反应测定Aβ的浓度,线性范围为100 fmol/L~25 pmol/L,LOD为100 fmol/L。Wang等[52]基于氧化铈掺杂氧化锌(Ce∶ZONFs)的花状纳米材料构建鲁米诺电化学发光(ECL)传感器检测Aβ(图2B)。通过酰胺化和物理吸附将鲁米诺结合到Ce∶ZONFs表面,再结合Ab2(二抗)-GOD@Ce:ZONFs-Lum的复合物作为信号探针,采用半胱氨酸银纳米线修饰的玻碳电极固定一抗,依次加入Aβ和二抗复合物。GOD催化葡萄糖产生H2O2,Ce∶ZONFs再催化H2O2产生自由氧, 促进鲁米诺发光,且Ce4+↔Ce3+反应可通过快速电子转移增加ECL反应速率, 提高ECL信号,检测Aβ的线性范围为80 fg/mL~100 ng/mL,LOD低至52 fg/mL。

图2 (A)基于ALP酶促反应[51]和(B)鲁米诺ECL[52]的夹心免疫法测定Aβ的示意图Fig.2 Schematic diagram of Aβ assay by sandwich immunoassay based on (A) alkaline phosphatase (ALP) enzymatic reaction[51] and (B) luminol electrochemiluminescence (ECL)[52]
3.3 基于Aβ多肽的电化学生物传感器
应用多肽片段特异性识别Aβ的电化学生物传感器的文献不多。Beheshti等[53]合成了4种Fc-多肽的生物复合物,都携带Aβ疏水序列:(赖氨酸)-亮氨酸-缬氨酸-苯丙氨酸-苯丙氨酸,但是C末端用不同基团修饰。通过CV、EIS测量Fc氧化还原过程中电流变化来检测Fc-多肽与固定在金电极表面的Aβ(12-28)的相互作用,结果表明,Fc-多肽可以阻止AβF形成,其程度取决于修饰基团的性质。Li等[54]基于具有序列RGTWEGKWK的肽可通过氨基酸侧链间的疏水作用结合AβO42,将一端标记Fc另一端含有11-巯基烷酸(MUA)的功能性肽探针和9-巯基-1-壬醇(MNH)先后组装在金电极表面,由于MUA比MNH稍长,因此肽探针可以摆动或弯曲;而肽探针与靶标AβO42的结合会导致电极表面电子转移的显著变化,用SWV测量该信号变化从而检测AβO42,检测范围为0.48~12 nmol/L,LOD为240 pmol/L。 Li等[55]合成甲基紫(MV)-葫芦脲(CB)-多肽RGTFEGKF-MUA的复合物(图3A),通过SWV检测MV-CB与Aβ42竞争结合固定在电极上多肽而产生的信号变化,线性范围为0.5~2.5 nmol/L。
细胞朊蛋白(膜结合糖蛋白,PrPC)已在全基因组筛选中被鉴定为AβO的高亲和力受体[56]。研究表明,PrPC与AβO相互作用的核心区域是PrP (95~110),这些残基位于PrPC的非结构化N末端区域内,具有THSQWNKPSKPKTNMK的氨基酸序列。Xia等[57]制备了金刚烷(Ad)-PrP(95~110)-AgNPs的复合物,并将该复合物固定到β-环糊精改性的电极表面,目标物AβO与AgNPs竞争性结合PrP (95~110),采用线性扫描伏安(LSV)法检测AβO的线性范围为0.02~100 nmol/L,LOD为8 pmol/L。该课题组基于类似的原理将PrP (95~110)和AuNPs直接固定在金电极上,Aβ与AuNPs竞争性结合PrP (95~110),Aβ检测范围为0.1~200 nmol/L,LOD为45 pmol/L[58]。此外,Xing等[59]在PrP (95~110)功能化的电极上结合AgNPs,可以产生强的氧化电流;而当AβO竞争结合PrP (95~110)后,由于不能形成AgNPs/ PrP (95~110)复合物, 电流几乎下降到背景水平,LOD为6 pmol/L。Rushworth等[60]将生物素化的PrP (95~110)连接到链霉亲和素修饰的丝网印刷金电极上,构建无标记阻抗传感器(图3B),LOD为0.5 pmol/L,该方法应用于检测培养基中7PA2细胞模型分泌的AβO,测得其浓度为24 nmol/L。Liu等[61]构建基于PrP (95~110)的类三明治结构,通过固定在金电极的多肽和游离的多肽/ALP复合物“夹心”法检测Aβ,ALP通过催化底物二茂铁甲醇形成氧化还原信号进而实现定量检测,检测范围为0.005~20 nmol/L,LOD为3 pmol/L。一些基于Aβ多肽的电化学生物传感器的相关技术具体参数见表4。目前,此方面的研究主要集中在应用PrP (95~110)检测Aβ,未来应着眼于发展多种新型的Aβ特异性多肽。

图3 基于(A)合成肽[55]和(B)PrP(95~110)[60]的Aβ电化学生物传感器Fig.3 Aβ electrochemistry biosensor based on (A) coupling peptide[55] and (B) PrP (95-110)[60]
表4 基于Aβ多肽的电化学生物传感器
Table 4 Electrochemical biosensor based on Aβ peptides
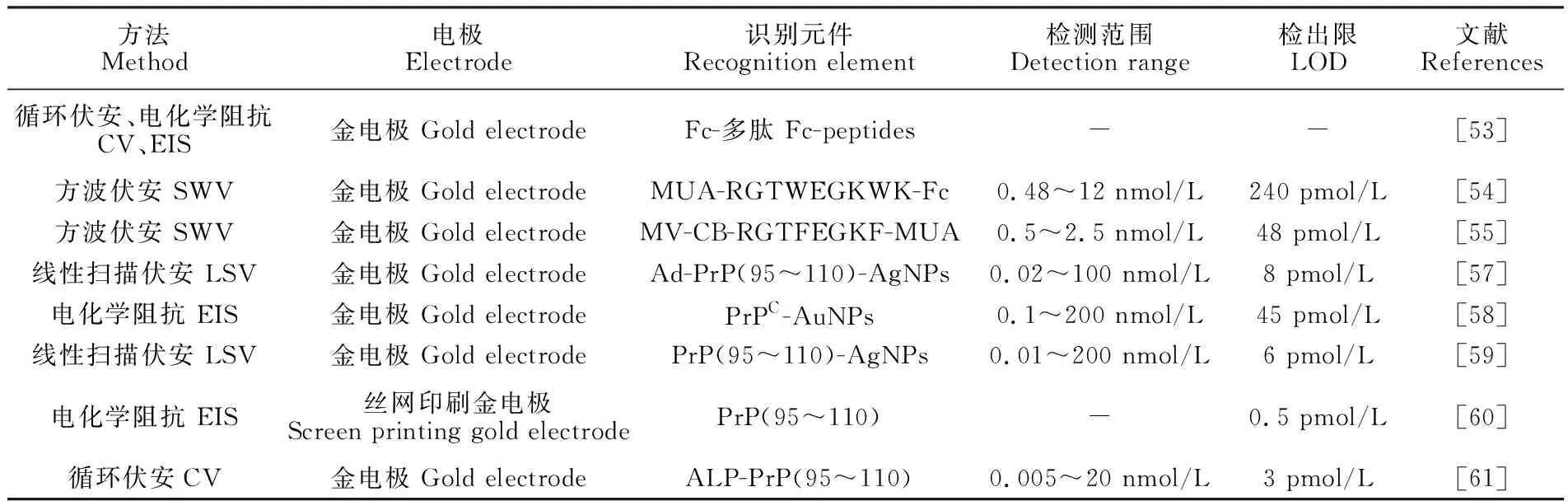
方法Method电极Electrode识别元件Recognition element检测范围Detection range检出限LOD文献References循环伏安、电化学阻抗CV、EIS金电极 Gold electrodeFc-多肽 Fc-peptides--[53]方波伏安 SWV金电极 Gold electrodeMUA-RGTWEGKWK-Fc0.48~12 nmol/L240 pmol/L[54]方波伏安 SWV金电极 Gold electrode MV-CB-RGTFEGKF-MUA0.5~2.5 nmol/L48 pmol/L[55]线性扫描伏安 LSV金电极 Gold electrode Ad-PrP(95~110)-AgNPs0.02~100 nmol/L8 pmol/L[57]电化学阻抗 EIS金电极 Gold electrode PrPC-AuNPs0.1~200 nmol/L45 pmol/L[58]线性扫描伏安 LSV金电极 Gold electrode PrP(95~110)-AgNPs0.01~200 nmol/L6 pmol/L[59]电化学阻抗 EIS丝网印刷金电极Screen printing gold electrodePrP(95~110)-0.5 pmol/L[60]循环伏安CV金电极 Gold electrode ALP-PrP(95~110)0.005~20 nmol/L3 pmol/L[61]
3.4 基于凝溶胶蛋白的电化学生物传感器
凝溶胶蛋白在血浆和脑脊液中作为分泌蛋白,并在细胞质中作为主要的肌动蛋白结合物以调节肌动蛋白的组装[62]。1999年,Chauhan等[63]发现凝溶胶蛋白能以浓度依赖的方式选择性结合可溶性AβM。Yu等[64]用多壁碳纳米管/AuNPs修饰电极固载凝溶胶蛋白,进而捕获Aβ和HRP-AuNPs-凝溶胶蛋白的复合物(图4A),由HRP催化底物3,3′,5,5′-四甲基联苯胺在+0.35 V产生的电信号, 间接对Aβ进行定量分析,检测范围为0.1~50 nmol/L,LOD低至28 pmol/L,将其应用于AD大鼠脑脊液和脑组织(海马、前额叶皮层和纹状体)中Aβ的检测,与ELISA所测结果一致。此外,Yu等[65]也构建类似的类三明治Aβ传感器(图4B), 用硫蛋白(Th)取代HRP,通过Th的还原信号对Aβ进行定量检测,线性范围为0.2~40 nmol/L, LOD为50 pmol/L。应用凝溶胶蛋白电化学检测Aβ的相关报道较少,其结合途径、作用机理有待深入研究。

图4 基于凝溶胶蛋白结合Aβ的(A)HRP[64]和(B)Th三明治免疫法[65]检测AβFig.4 Sandwich immunoassay for Aβ based on (A) HRP[64] and (B) Th gelsolin-bound Aβ[65]
3.5 基于血红素的电化学生物传感器
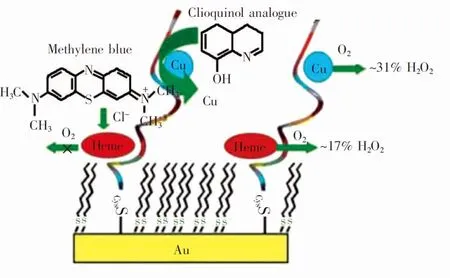
图5 基于Aβ自组装单层研究铜和血红素的作用[69]Fig.5 Effect of copper and heme on Aβ self-assembled monolayer[69]
血红素可以结合Aβ形成具有类过氧化物酶活性的复合物,并且能抑制Aβ聚集[66],血红素与Aβ的结合在AD的早期阶段可能发挥较为重要的作用。Zhou等[67]采用CV和DPV研究Aβ和血红素的相互作用,结果表明,His13和His14可能是两者的结合位点,且血红素能抑制AβF的形成。Neumann等[68]通过CV分析氨基己硫醇-血红素与Aβ16的相互作用,表明血红素-Aβ复合物可以增强血红素的过氧化活性。Pramanik等[69]通过Aβ16-半胱氨酸复合物在金电极上形成自组装单层,再将铜、血红素附着在自组装单层上,研究它们对Aβ聚集的影响(图5),结果表明, 血红素-Aβ比Cu-Aβ催化能力更强。目前, 基于血红素的Aβ电化学生物传感器还处于发展阶段,基本都是定性研究。
3.6 多种识别元件联用的Aβ电化学生物传感器
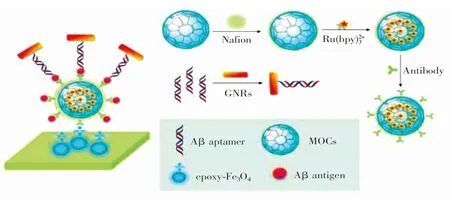
图6 基于三明治型ECL磁性适配体传感器检测Aβ[75]Fig.6 Detection of Aβ based on a sandwich-type ECL magneticaptasensor[75]
核酸适配体(Apamer)是一类寡核苷酸配体,具有成本低、亲和力和特异性高、结构和碱基序列可设计以及合成简单等特点。2002年,Ylera等[70]在Aβ40的N端连接半胱氨酸, 通过半胱氨酸和巯基丙基生成二硫键将其交联在微珠上,利用亲和柱法筛选Aβ40的apamer,筛选出Kd值最小(亲和力最高)的RNA核酸适配体β55。Takahashi等[71]通过筛选获得Aβ40寡聚体的RNA核酸适配体N2、E2。Tsukakoshi等[72]在选择α-突触核蛋白低聚物的适体时,发现适体也与AβO结合,其中适配体T-SO508与Aβ40寡聚体的结合力最强。目前,未见单独应用Aβ适配体作为识别元件检测Aβ的电化学方法的相关报道。

4 结论与展望
本文重点阐述了新型电化学生物传感方法在Aβ检测方面的相关应用。但是,面对临床实际样品中聚集过程动力学不稳定的痕量Aβ,提高电化学生物传感方法的灵敏度、特异性以及实用性仍是当前研究的重点。从目前的研究现状可知, Aβ电化学生物传感方法具有如下的发展趋势。
(1)新型复合纳米材料的应用。纳米材料与电化学生物传感技术的有机结合,可显著提高分析方法的准确性、灵敏度和响应速度,为Aβ的分析研究与发展提供了新的思路和手段。目前Aβ分析研究中使用的纳米材料较单一,在各种特殊结构和生物相容性纳米材料的研制、复合及应用方面,仍有较大的发展空间。
(2)多种Aβ生物识别元件的联用。目前Aβ的生物识别元件主要有抗体、多肽、凝溶胶蛋白、血红素及核酸适配体。Aβ分析研究中单一生物识别元件的应用较多,使用中各有利弊。Aβ多种识别元件的联用可扬长避短、优势叠加,将是未来Aβ检测方法的研究方向。
(3)Aβ不同聚集形态的同时检测。目前Aβ分析研究仍停留在同一形态的单一检测。在单一流程中实现Aβ不同聚集形态的同时检测,不仅能降低成本、节省时间,更对AD早期发现、跟踪、预防和治疗具有重要意义。
(4)提高Aβ传感检测的实用性。目前,Aβ电化学生物传感器实际检测效果不理想。将传感设计与样品前处理有效偶联,集分离反应、信号产生、信号检测为一体,有效提高传感器的实用性,将是未来Aβ研究的重点。
