谷氨酰胺转氨酶改性花生蛋白质研究
2018-09-11高锦鸿曹宇锋张丽霞黄纪念
芦 鑫,高锦鸿,曹宇锋,张丽霞,黄纪念*
(1.河南省农业科学院 农副产品加工研究中心,河南 郑州 450002; 2.河南省农产品生物活性物质工程技术研究中心,河南 郑州 450002; 3.河南农业大学 食品科学技术学院,河南 郑州 450002)
由于花生蛋白质资源丰富、营养丰富、便于加工,已经成为世界第三大植物食用蛋白质资源[1-3]。花生蛋白质虽然已经广泛应用于食品领域,但由于其凝胶性差,只能通过添加凝固剂(盐、果胶)才能形成凝胶,这限制了花生蛋白质在凝胶类食品中的应用[4-6]。谷氨酰胺转氨酶( TGase) 是一种酰基转移酶,可以催化蛋白质中的谷氨酰基和赖氨酸在分子内及分子间形成ε-( γ-谷氨酰基) -赖氨酸共价交联[7],增加蛋白质尺寸,密切蛋白质间的联系,提高持水能力,从而改善蛋白质的凝胶能力[8]。前人将TGase应用于花生蛋白质改性已有诸多研究[9-11],但大多以溶液黏度来评价改性反应进行的程度,由于TGase作用于花生蛋白质形成大小不一的凝胶颗粒,使蛋白质溶液呈现不均一的悬浊体系,测定的溶液黏度不够准确客观且重复性差,以此评估改性反应情况不够合理;同时,也缺乏对TGase改性花生蛋白质过程中蛋白质结构组成变化的结果,因此,有必要引入新的变量来考察TGase改性花生蛋白质过程并分析改性对花生蛋白质结构的影响。
在TGase改性花生蛋白质过程中,会从溶液中析出形成漂浮于液面的凝胶颗粒,将这些凝胶颗粒定义为改性蛋白质。以改性蛋白质产率、持水能力作为评价指标,分析酶解时间、pH值、加酶量对TGase改性花生蛋白质的影响,确立最佳的改性条件,并分析改性过程中花生蛋白质二级结构、亚基组成的变化规律,并对比改性前后花生蛋白质功能特性的差异,为TGase改性花生蛋白质的后续研究提供参考。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂 花生蛋白质粉:自制,具体条件见文献[12];KBr:光谱纯,上海阿拉丁生化科技股份有限公司生产;丙烯酰胺、N,N′-亚甲双丙烯酰胺、三羟甲基氨基甲烷、甘氨酸:电泳纯,美国Amersco公司生产;TGase(活性4 200 U/g):济南青瑞生物科技有限公司生产;电泳Marker(分子质量15~170 ku):美国赛默飞世尔科技公司有限公司生产;其他试剂:分析纯,国药集团化学试剂有限公司生产。
1.1.2 仪器与设备 电泳仪:DYCZ-24DN,北京市六一仪器厂生产;凝胶成像仪:Gel-Doc XR+,美国伯乐生命医学产品有限公司生产;质构仪:TMS-pro,美国FTC公司生产;傅里叶红外分析仪:IS5,美国赛默飞世尔科技有限公司生产;全自动凯氏定氮仪:K-05,上海晟声自动化分析仪器有限公司生产。
1.2 方法
1.2.1 TGase改性花生蛋白质 根据前期研究[9-11],配制质量浓度70 g/L的花生蛋白质溶液,在45 ℃下,分别以120、140、160 U/g的加酶量加入TGase,在pH值7.7、8.0、8.3分别反应35、45、55 min,具体见表1。反应结束后,采用配置0.075 mm孔径滤布的平板离心机于1 000 r/min下离心,收集滤网上的蛋白质凝胶团,称取3 g凝聚团测定持水能力,剩余采用冷冻干燥,获得改性花生蛋白质,称质量计算改性花生蛋白质产率。
表1 花生蛋白质TGase改性响应面试验的因素与水平
1.2.2 花生蛋白质持水能力测定 为了反映改性过程中花生蛋白质形成凝聚团结构的均一完整程度,引入评价指标——持水能力。考察称取0.5 g样品,放入Amicon Ultra-4(配置截留分子质量3 ku超滤芯)超滤离心管,称取总质量,4 000 r/min离心15 min,将过滤出的水倒出并擦干滤膜和离心管内壁残留的水珠,称取离心后总质量,计算持水能力[13]。
式中:WHC为持水能力,M1为样品和离心管离心前的总质量,M2为离心后样品和离心管的总质量,η为样品中的水分含量,M为样品的质量。
1.2.3 改性花生蛋白质产率测定 采用凯氏定氮法(GB 5009.5—2010,N为5.46)测定花生蛋白质含量(Co)与改性花生蛋白质含量(Cf),采用下面公式计算:

1.2.4 花生蛋白质微观结构分析 采用电子扫描显微镜分析未改性花生蛋白质与TGase改性花生蛋白质[14],其中,TGase改性花生蛋白质样品(下同)为70 g/L花生蛋白质溶液以加酶量144.20 U/g、pH值8.15、45 ℃反应46 min的产物。
1.2.5 花生蛋白质二级结构分析 参考芦鑫等[14]的方法,获取TGase改性花生蛋白质样品的红外光谱后,用Origin 8.5以二次微分从红外光谱1 600~1 700 cm-1的波峰中寻找隐峰,按照1 610~1 642 cm-1归属β-折叠、1 642~1 650 cm-1归属无规卷曲、1 650~1 660 cm-1归属α-螺旋、1 660~1 680 cm-1归属β-转角、1 680~1 700 cm-1归属β-逆折叠[15]进行归类计算二级结构组成。
1.2.6 花生蛋白质的变性电泳测定 分别取0.1 g样品加入2 mL样品处理液(0.02 g/mL SDS、0.05 g/mL β-巯基乙醇、0.001 g/mL溴酚蓝、0.10 g/mL甘油、0.05 mol/L pH值为 6.8的 Tris-HCl),100 ℃水浴加热3 min,10 000 r/min离心10 min,取上清液,用于电泳。电泳条件:3%浓缩胶浓度、10%分离胶、取5 μL上清液上样,浓缩胶时采用15 mA,分离胶时采用30 mA。电泳完毕后,迅速将凝胶采用考马斯亮蓝R-250溶液染色60 min,收集染色液,随后加入脱色液在摇床上脱色[16]。胶片在凝胶成像系统中拍摄并用Image Lab 5.0进行分析。
1.2.7 蛋白质凝胶质构测定 为评价改性对花生蛋白质凝胶性的影响,以大豆蛋白质作为对照,分别配制150 g/L的大豆与花生蛋白质溶液,将蛋白质溶液在90 ℃加热40 min,随后用冰水浴迅速将凝胶冷却至室温,最后将样品放入4 ℃冰箱过夜[17-18]。二次压缩试验前,在室温下静置1 h,测定时采用Φ50 mm圆形探头、压缩距离10 mm、前进速度60 mm/min、压缩速度60 mm/min、后退速度60 mm/min,计算硬度、黏附力、黏附性、内聚性、弹性、胶黏性、咀嚼性。
1.2.8 蛋白质的功能特性 为考察改性对花生蛋白质功能特性的影响,分别测定花生蛋白质与TGase改性花生蛋白质的吸水性、吸油性、乳化性、乳化稳定性、起泡性、起泡稳定性[19-20]。
1.3 数据处理
采用SAS 9.2进行Box-Behnken设计的响应面分析,以Duncan’s法进行单因素方差分析。
2 结果与分析
2.1 TGase改性花生蛋白质最优条件的确立
通过对响应面试验结果(表2)进行方差分析发现:以改性蛋白质产率为因变量的回归模型高度显著(P<0.01),且失拟项P=0.06>0.05(表3),表明该模型可以客观地反映改性因素对改性花生蛋白质产率的影响规律,并且由于R2为0.992 4(调整R2为0.978 8),因此,模型的回归方程能够准确反映改性花生蛋白质产率的变化趋势,以确立最佳的TGase改性条件,获得的回归方程如下:

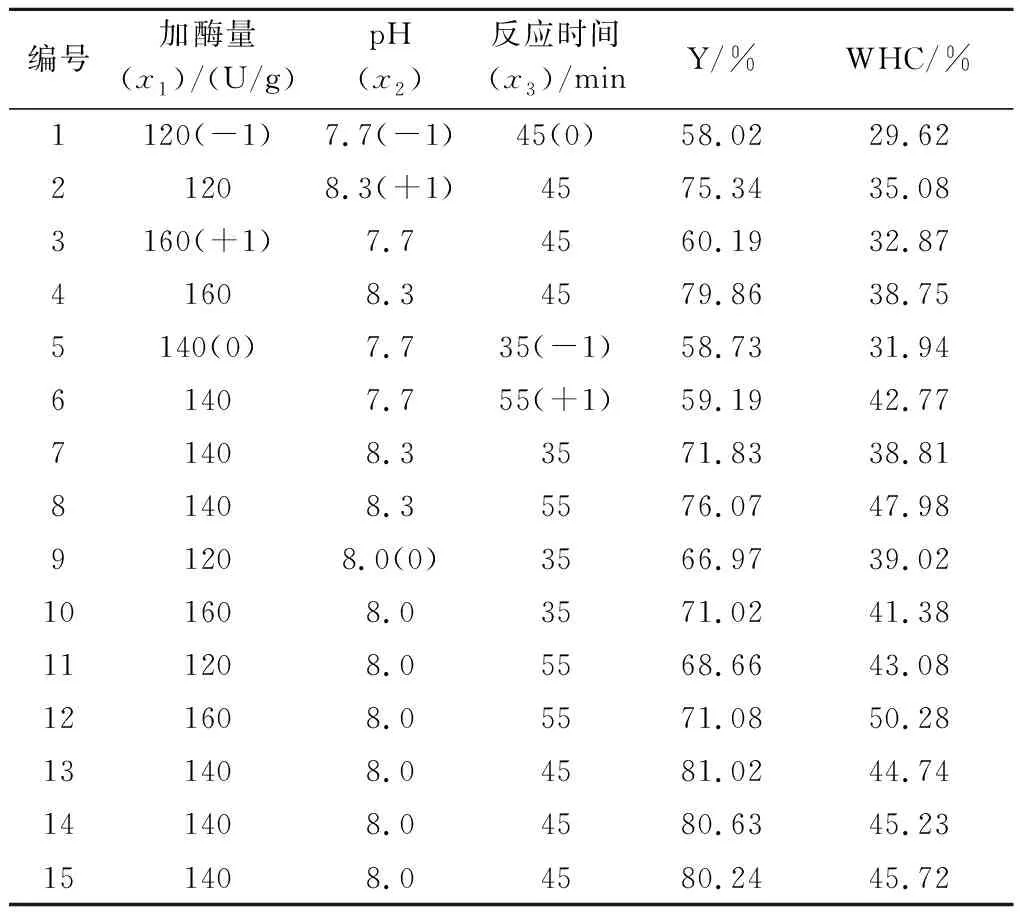
表2 花生蛋白质TGase改性响应面分析试验设计及结果
注:括号中数字为试验编码值。
在响应面考察的因素变化范围中,加酶量和pH值是高度显著因素(P<0.01),且pH值的影响大于加酶量,酶解时间是非显著影响因素(P>0.05);同时,因素间的交互作用不显著(表3)。
分析持水能力发现,模型高度显著(P<0.01),且失拟项P=0.10>0.05,说明模型能够客观反映改性因素与改性蛋白质持水能力的关系,其中反应时间是第一影响因素,pH值是第二影响因素,加酶量是第三影响因素(表3)。此外,由于R2=0.985 3,调整R2=0.958 9,表明该回归模型的回归曲线可以预测持水能力的变化趋势,方程回归模型如下:

表3 TGase改性因素对改性花生蛋白质产率与持水能力影响的方差分析
注:以改性花生蛋白质产率为因变量的回归模型R2为0.992 4(调整R2为0.978 8),以持水能力为因变量的回归模型R2为0.985 3(调整R2为0.958 9);*、**分别表示在0.05、0.01水平上差异显著、极显著。
由于酶解时间对改性花生蛋白质产率是非显著影响因素,固定酶解时间45 min,分析加酶量与pH值对改性花生蛋白质产率与持水能力的影响。由图1a、图1b可知,pH值7.7~8.3时,加酶量增加可以提高改性蛋白质产率与持水能力,且当pH值在8.0以上时,增加加酶量能更有效地促进改性蛋白质形成、改善持水能力(图1c、图1d))。增加加酶量可以提高酶分子与底物碰撞的概率,从而加速TGase改性反应,提高改性蛋白质产率,且随着加酶量的增加,也会促进TGase催化已改性的花生蛋白质继续形成分子间、分子内的共价交联,从而使蛋白质凝聚团更加致密,提高持水能力。在高pH值条件下,增加加酶量能更有效地促进酶解反应的原因可能是,在碱性条件下,TGase的活性中心更加暴露,有利于酶解反应的进行,从而提高改性蛋白质的产率。由图1可知,获得高改性蛋白质产率的试验条件与获得高持水能力的试验条件存在差异,当pH值为8.0~8.1时产生高持水能力的凝胶团,而pH值为8.1~8.2时,改性蛋白质产率最高。这可能是蛋白质凝聚方式改变引起的差异,花生蛋白质的等电点(pI)在4.5左右[21],当pH值大于pI时,花生蛋白质带负电,且随pH值偏离pI程度越大,蛋白质所带电荷极性越强。当蛋白质带有较强的同性电荷,由于排斥力作用,蛋白质分子间凝聚速度减慢,削弱蛋白质分子间的链接,导致蛋白质凝胶团紧密程度下降,从而导致持水能力下降[22]。
SAS分析显示,在取值范围内,TGase改性花生蛋白质产率存在最大值,预测最高产率为(83.19±0.66)%,对应的反应条件为:加酶量为144.16 U/g,pH值为8.17,反应时间为45.96 min。由于持水能力在取值范围内仅存在鞍点,故仅以改性蛋白质产率为优化目标,根据实际情况,对最佳酶解因素进行调整如下:加酶量为144.20 U/g,pH值8.15,时间为46 min,在此条件下,产率为(83.17±0.38)%,持水能力为(45.63±0.24)%。
2.2 TGase改性对花生蛋白质结构的影响
2.2.1 微观结构 采用电子显微镜观察未改性花生蛋白质与改性花生蛋白质的形态发现:未改性花生蛋白质颗粒为表面凹凸不平的球体(图2a),而改性花生蛋白质颗粒体积增加(图2c),且改性后的花生蛋白质表面的结构更加粗糙且凹凸不平(图2d)。上述结果表明,TGase改性会改变蛋白质微观结构,这与张春红等[23]采用TGase改性花生蛋白质膜会改变原有微观结构的报道一致。
2.2.2 二级结构 由表4知,在TGase改性过程中,α-螺旋、无规卷曲、β-折叠和β-转角随改性时间延长均有所下降,其中β-转角下降程度明显;而β-逆折叠则显著提高,从未改性的16.25%上升到改性45 min的22.90%,经过TGase改性后,花生蛋白质的二级结构组成接近大豆蛋白质。推测由于TGase催化产生新的共价联结,导致形成新的空间位阻,造成花生蛋白质的多肽链伸展方向与弯曲方式发生变化。另外,对比大豆蛋白质的二级结构组成,未变性的花生蛋白质与其存在显著差异。
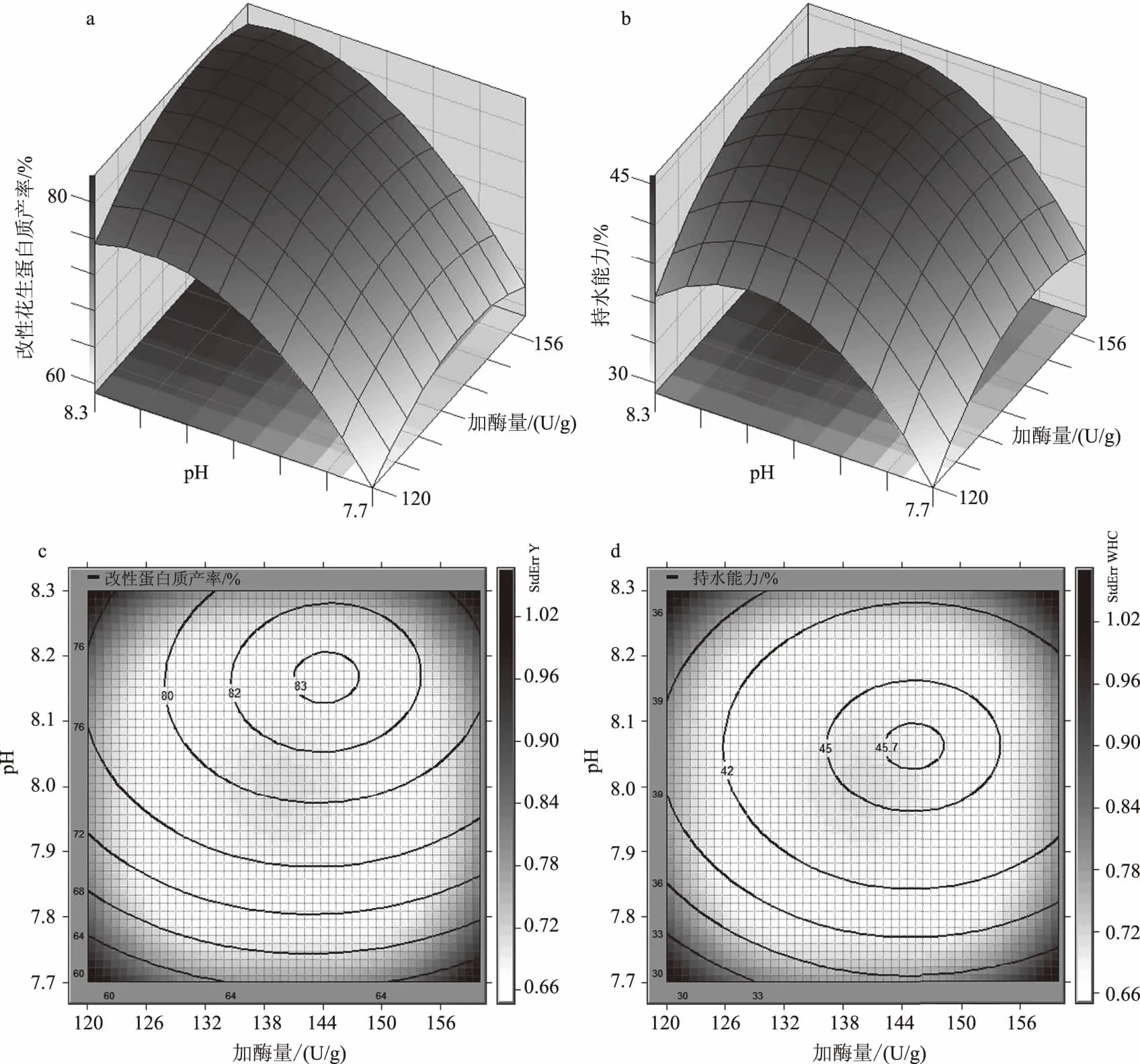
图1 加酶量和pH值对改性花生蛋白质产率与持水能力的影响

a、b为花生蛋白质(×500、×2 000); c、d为TGase改性花生蛋白质(×500、×2 000)图2 花生蛋白质与TGase改性花生蛋白质的微观结构

样品改性时间/minβ-折叠无规卷曲α-螺旋β-转角β-逆折叠 大豆蛋白质29.82±0.42b10.75±0.55b12.50±0.78d25.47±0.53d21.52±0.33c花生蛋白质030.49±0.72a11.27±0.15a14.84±0.14a27.15±0.08a16.25±0.35h530.51±0.39a11.08±0.05ab14.52±0.54a26.57±0.09ab17.31±0.30g1029.81±0.25b11.23±0.16a14.45±0.59a26.30±0.30bc18.21±0.13f1529.66±0.04b11.11±0.10ab14.10±0.42ab26.35±0.37bc18.79±0.12f

续表4 大豆蛋白质与TGase改性花生蛋白质的二级结构 %
注:同列不同小写字母表示在0.05水平上差异显著。
2.2.3 亚基组成 由图3可知,随着改性时间的延长,花生蛋白质的亚基组成发生明显变化,除了原有的花生球蛋白质、伴花生球蛋白质Ⅰ和Ⅱ以外,还产生了分子质量大于70 ku的高分子蛋白质,并且该蛋白质含量也逐渐增加。高分子蛋白质是TGase催化花生蛋白质分子内、分子间形成共价交联的产物。上述发现与前人研究TGase改性乳蛋白质的亚基组成变化相似[24-25]。

泳道1为标准蛋白质; 泳道2—7分别为TGase改性0、5、15、25、35、45 min的花生蛋白质图3 TGase改性花生蛋白质的变性电泳图
2.3 TGase改性对花生蛋白质性质的影响
由表5可知,通过经过TGase改性后,花生蛋白质凝胶硬度、黏附力、黏附性、胶黏性显著提高,但内聚性、弹性、咀嚼性显著下降,表明TGase可以部分改善花生蛋白质的凝胶性。与大豆蛋白质形成的凝胶相比,TGase改性花生蛋白质形成的凝胶硬度高、弹性差、咀嚼性差,这说明改性花生蛋白质形成的凝胶性质与大豆蛋白质凝胶存在明显差异,产生上述差异的原因是蛋白质凝胶性质除受蛋白质结构的影响外,还受氢键、二硫键、疏水表面积、盐离子、加工条件等因素影响。可见,TGase改性花生蛋白质可以提高凝胶性,但形成的凝胶硬度高而弹性差,不耐咀嚼,需要采用其他方法来进一步改善花生蛋白质凝胶特性。

表5 TGase改性对花生蛋白质凝胶质构特性的影响
注:同列不同小写字母表示在0.05水平上差异显著。
由表6可知,通过TGase改性的花生蛋白质的吸水性、吸油性有了明显提高,分别较花生蛋白质提高到1.41、1.30倍,这表明通过TGase改性使蛋白质分子间与分子内形成更多的共价联结,使其形成了更加严密与完整的蛋白质网络结构,从而提高对水、油的包覆能力。但改性会降低花生蛋白质乳化能力与起泡能力,这可能是TGase催化导致形成了高分子质量花生蛋白质聚合物,这类蛋白质在溶液、界面中不稳定,易聚集、沉淀析出,从而削弱了蛋白质的乳化能力[26]。此外,由于高分子蛋白质的形成会降低蛋白质在界面重新排列的能力,从而削弱界面膜的稳定性,造成蛋白质起泡能力下降。上述结果与前人报道相一致[20,26]。

表6 TGase改性对花生蛋白质功能性的影响 %
3 结论与讨论
本研究以改性蛋白质产率与持水能力为评价指标,确定TGase改性花生蛋白质的最佳工艺为:70 g/L 花生蛋白质溶液在加酶量为144.20 U/g、pH值 8.15、反应温度45 ℃、反应时间46 min条件下,改性蛋白质的产率为(83.17±0.38)%。通过电子显微镜、红外光谱与变性电泳分析改性对花生蛋白质结构的影响,结果表明:TGase改性会增加蛋白质颗粒的尺寸,并增加表面的粗糙程度;同时,花生蛋白质中β-转角比例下降;而β-逆折叠显著提高,经过TGase改性后,花生蛋白质的二级结构组成接近大豆蛋白质;另外,花生蛋白质的原有亚基无明显变化,但有TGase催化产生高分子蛋白质。上述结构变化使改性前后的花生蛋白质功能特性产生差异,改性后的花生蛋白质凝胶特性有部分改善,其硬度、黏附性、胶黏性显著提高,吸油性、吸水性也有大幅提高,但乳化能力与起泡能力明显降低。
与前人研究相比,本研究以改性蛋白质产率与持水能力作为评价指标,弥补了传统TGase改性蛋白质采用黏度作为评价指标时结果随机性大的缺点,为客观分析TGase改性花生蛋白质提供了可靠途径。同时,确定的最优工艺也为TGase改性花生蛋白质的工业化转化提供了参考。本研究虽然分析TGase改性前后花生蛋白质结构与功能的变化,但并未量化花生蛋白质结构变化与功能特性间的关系,这方面的研究需要进一步开展。
