苍苓散对轮状病毒肠炎患儿肠道菌群的影响
2018-09-10陈治珍梁丹丹郑智俊陈佩文黄晓利陈晓刚
陈治珍,梁丹丹,郑智俊,陈 璟,罗 菲,陈佩文,黄晓利,刘 华,陈晓刚
轮状病毒(rotavirus, RV)是导致世界范围内特别是低收入国家婴幼儿急性腹泻的主要病原体[1-2]。RV感染所导致的急性胃肠炎,会出现不同程度的腹泻、呕吐、发热等症状,严重者可引起电解质紊乱、酸碱平衡失调、多器官损害、休克乃至死亡[3-4]。在我国,每年RV肠炎的门诊病例高达2500万例,住院23万例,死亡3.8~4.7万例,医疗花费累计近8亿元[5]。规范液体疗法的推广使用虽然降低了病死率,但RV肠炎目前仍无特效治疗方法,且在低收入国家中,疫苗的有效性也并不理想[6]。近年来,研究发现RV肠炎患儿存在肠道菌群失调[7],补充益生菌则能减轻腹泻次数,但起效较慢,对于其是否能有效缩短病程,则有不同结论[8-9]。本研究基于16S rDNA的高通量测序技术,研究小儿腹泻病的中药临床验方苍苓散对RV肠炎患儿肠道菌群的影响,现报道如下。
1 对象与方法
1.1 对象 选择广州中医药大学第一附属医院RV肠炎住院患儿9例作为研究对象。患儿为11~38月龄,平均为21.67月龄。RV肠炎的诊断标准:参照中华医学会制定的《儿童腹泻病诊断治疗原则的专家共识》[10],①患儿出现大便性状改变;②大便次数比平时增多;③胶体金法检测大便中RV抗原阳性者。纳入标准:除满足上述诊断标准外,尚须满足以下要求,①大便常规,白细胞≤5个/高倍镜,红细胞≤5个/高倍镜;②大便沙门菌、志贺菌、致病性大肠杆菌培养阴性;③排除心、肝、肾疾病,中枢神经系统疾病及遗传代谢、内分泌疾病等基础病史。
1.2 方法
1.2.1 药物制备及治疗措施 苍苓散复方煎液由广州中医药大学第一附属医院制剂室制备。确定患儿入院前1周未使用抗生素及益生菌,经其父母知情同意后,患儿每日服用上述苍苓散复方煎液150 ml,配合液体疗法(口服补液盐或静脉补充3∶2∶1液),疗程为5 d。
1.2.2 标本采集及细菌总DNA提取 用无菌标本管分别留取治疗前(CM0)与治疗后(CM1)第5 d的粪便,不少于2 g,-80 ℃保存备用。4 ℃解冻标本,加入三羟甲基氨基甲烷-乙二胺四乙酸缓冲液(pH8.0),震动5 min,使标本充分混匀。采用QIAamp DNA Stool Mini Kit(德国Qiagen公司)提取细菌总DNA,用Thermo NanoDrop 2000紫外微量分光光度计和1%琼脂糖凝胶电泳进行质检。
1.2.3 引物设计与合成 16S rDNA扩增选择区域为V3~V4,通用引物是F341和R806。在通用引物的5'端加上适合HiSeq2500 PE250测序的index序列和接头序列,完成特异性引物的设计(i5,i7为index区域):正向引物(5'-3')AAT GATACGGCGACCACCGAGATCTACAC[i5]TCG TCGGCAGCGTCAGATGTGTATAAGAGACAGA CTCCTACGGGRSGCAGCAG;反向引物(5'-3')CAAGCAGAAGACGGCATACGAGAT[i7]GTCTC GTGGGCTCGGAGATGTGTATAAGAGACAGGAC TACVVGGGTATCTAATC。
1.2.4 PCR扩增、产物纯化、测序 以稀释后的基因组DNA为模板,使用KAPA HiFiHotstart Mix PCR kit(中国艾德科技公司)进行PCR反应。PCR产物检测后切胶回收,进行文库质检、定量,并根据每个样本数据量按相应比例混合。测序采用HiSeq平台,得到2×250 bp的Paired-End数据,通过拼接,获得较长tags序列后进行16S rDNA分析。
1.3 分析方法
1.3.1 可操作分类单元分析 对原始数据进行质控后,用Usearch软件行去嵌合体和聚类操作,先将序列按照丰度从大到小排序,按97%相似度的标准聚类,得到可操作分类单元(operational taxonomic units, OTU),每个OTU被认为可代表1个物种。对每个标本的序列进行随机抽平处理,并提取对应的OTU序列。根据序列绘制聚类维恩图,分析苍苓散治疗前后患者的肠道菌群多样性。
1.3.2 物种丰度分析 从各个OTU中挑选出丰度最高的1条序列,作为该OTU的代表序列。使用核糖体数据库计划(ribosomal database project,RDP)方法,将该代表序列与已知物种的16S rDNA数据库进行比对,从而对每个OTU进行物种归类。根据物种注释结果,分别在门、纲、目、科、属分类等级对各个标本做物种相应的柱状图,形成物种相对丰度柱状图。
1.3.3 单个样本多样性分析 利用Qiime软件计算样本的Alpha多样性指数的值,并作出相应的稀释曲线,对单个样本中物种多样性进行分析,包括observed species指数(表示实际观测到的OTU数量)、chao1指数(估计样品所含OTU的总数)、香农指数和辛普森指数(估算微生物群落的多样性,指数越大,多样性越高)。单个样本多样性分析稀释曲线是用已测得16S rDNA序列中已知的各种OTU的相对比例,来计算抽取n个Reads时各Alpha多样性指数的期望值,然后根据一组n值(一般为一组小于总序列数的等差数列)与其相对应的Alpha多样性指数的期望值做出曲线。
1.3.4 样本间多样性分析
1.3.4.1 UniFrac热图分析 通过利用系统进化的信息来比较样品间的物种群落差异,它对样品两两之间进行比较分析,计算得到样品间的UniFrac距离矩阵。其计算结果可以作为一种衡量Beta多样性的指数,其数值越大表示样品间的差异越大。
1.3.4.2 相似性分析 是一种非参数检验,用来检验2组组间的差异是否显著大于组内差异,从而判断分组是否有意义。
1.3.4.3 多响应置换过程分析 多响应置换过程分析(multi-response permutation procedures, MRPP)用于分析组间微生物群落结构的差异是否显著的一种分析方法,通常与PCA、主坐标分析(principal coordinates analysis, PCoA)、NMDS等降维图配合使用。
1.3.4.4 主坐标分析 使用PCoA是一种研究数据相似性或者差异性的可视化方法。它基于由物种组成计算得到的距离矩阵,展示各个样本或群体之间的差异大小。
1.3.5 显著性差异分析 通过秩和检验找出RV肠炎患儿在苍苓散治疗前(CM0)与治疗后(CM1)有明显差异的物种。
1.4 统计学处理 使用秩和检验对不同分组之间进行显著性差异分析,2组间的差异分析采用R语言stats包的wilcox.test函数,对于2组以上的组间差异分析采用R语言stats包的kruskal.test函数(独立标本)或friedman.test函数(非独立样本),选取秩和检验后满足P<0.05的结果。
2 结 果
2.1 OTU聚类 以97%相似度的标准聚类,得到292个OTU,其中CM0与CM1标本包含的数目分别为255、227个,2种标本共有的OTU数目为190个(见图1)。
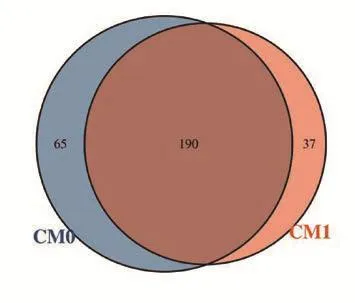
图1 OTU 维恩图Figure 1 OTU Venn diagram
2.2 苍苓散治疗前后肠道菌群结构 对所有OTU进行物种归类,测得326个界,323个门,312个纲,307个目,295个科,256个属。图2、3可知所有标本在门、纲、目、科、属水平上的物种的丰度比例,即表明优势菌群。
在门水平上以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)为主要菌群(图2A);RV肠炎患儿在苍苓散治疗前(CM0)与治疗后(CM1)肠道中菌群优势物种极其相似,但所占比例不同:CM0优势菌群所占比例由大到小为厚壁菌门>放线菌门>拟杆菌门>变形菌门;CM1优势菌群所占比例由大到小为厚壁菌门>拟杆菌门>变形菌门>放线菌门(图3A)。
纲水平上以拟杆菌纲(Bacteroidia)、Negativicute纲、放线菌纲(Actinobacteria)、γ-变形菌纲(Gammaproteobacteria)、梭菌纲(Clostridia)为主要菌群(图2B);CM0优势菌群所占比例由大到小为放线菌纲>Negativicutes纲>梭菌纲>拟杆菌纲>γ-变形菌纲;CM1优势菌群所占比例由大到小为拟杆菌纲>γ-变形菌纲>Negativicutes纲>放线菌纲>梭菌纲(图3B)。
目水平上以拟杆菌目(Bacteroidales)、Selenomonadales目、双歧杆菌目(Bifidobacteriales)、肠杆菌目(Enterobacteriales)、梭菌目(Clostridiales)为主要菌群(图2C);CM0优势菌群所占比例由大到小为双歧杆菌目>Selenomonadales目>梭菌目>拟杆菌目>肠杆菌目;CM1优势菌群所占比例由大到小为拟杆菌目>肠杆菌目>Selenomonadales目>双歧杆菌目>梭菌目(图3C)。
科水平上以拟杆菌科(Bacteroidaceae)、韦荣球菌科(Veillonellaceae)、双歧杆菌科(Bifidobacteriaceae)、肠杆菌科(Enterobacteriaceae)为主要菌群(图2D);CM0优势菌群所占比例由大到小为双歧杆菌科>韦荣球菌科>拟杆菌科>肠杆菌科;CM1优势菌群所占比例由大到小为拟杆菌科>肠杆菌科>韦荣球菌科>双歧杆菌科(图3D)。
属水平上以拟杆菌属(Bacteroides)、大肠杆菌-志贺菌属(Escherichia/Shigella)、双歧杆菌属(Bifidobacterium)、韦荣球菌属(Veillonella)为主要菌群(图2E);CM0优势菌群所占比例由大到小为双歧杆菌属>拟杆菌属>大肠杆菌-志贺菌属>韦荣球菌属;CM1优势菌群所占比例由大到小为拟杆菌属>大肠杆菌-志贺菌属>双歧杆菌属>韦荣球菌属(图3E)。
2.3 单个样本多样性分析 样本物种丰度Alpha多样性指数稀释曲线见图4。通过秩和检验分析,苍苓散治疗前后,香浓指数的P值为0.25,辛普森指数的P值为0.25,observed species的P值为0.5,chao1指数的P值为0.91,其差异无统计学意义(P均>0.05)(表1)。
2.4 样本间多样性分析
2.4.1 UniFrac热图分析 UniFrac能够通过对样本进行聚类分析并计算样本间距离,判断样本物种组成的相似性,样本越靠近说明2个样本的物种组成越相似。加权UniFrac在计算距离时考虑了序列的丰度,非加权UniFrac不考虑序列丰度。通过对UniFrac结果的聚类,具有相似Beta多样性的样品聚类在一起,反应了样品间的相似性。苍苓散治疗前、后的聚类分析图,说明样品的物种组成相似(见图5)。
2.4.2 PCoA分析 横坐标表示第一主坐标成份,括号中的百分比表示第一主坐标成份对样品差异的贡献率,纵坐标表示第二主坐标成份,括号中的百分比表示第二主坐标成份对样品差异的贡献率。如果2个样本距离较近,则表示这2个样本的物种组成较相近。对苍苓散治疗前后的标本PCoA分析显示,2组间差异无统计学意义(见图6)。
2.4.3 Anosim分析 横坐标表示所有样本以及每个分组,纵坐标表示UniFrac距离的秩。R介于(-1,1)之间,R>0,说明组间差异显著;R<0,说明组内差异大于组间差异,统计分析的可信度用P表示,P<0.05 表示差异具有统计学意义。对苍苓散治疗前后的标本Anosim分析显示,2组间差异无统计学意义(见图7)。
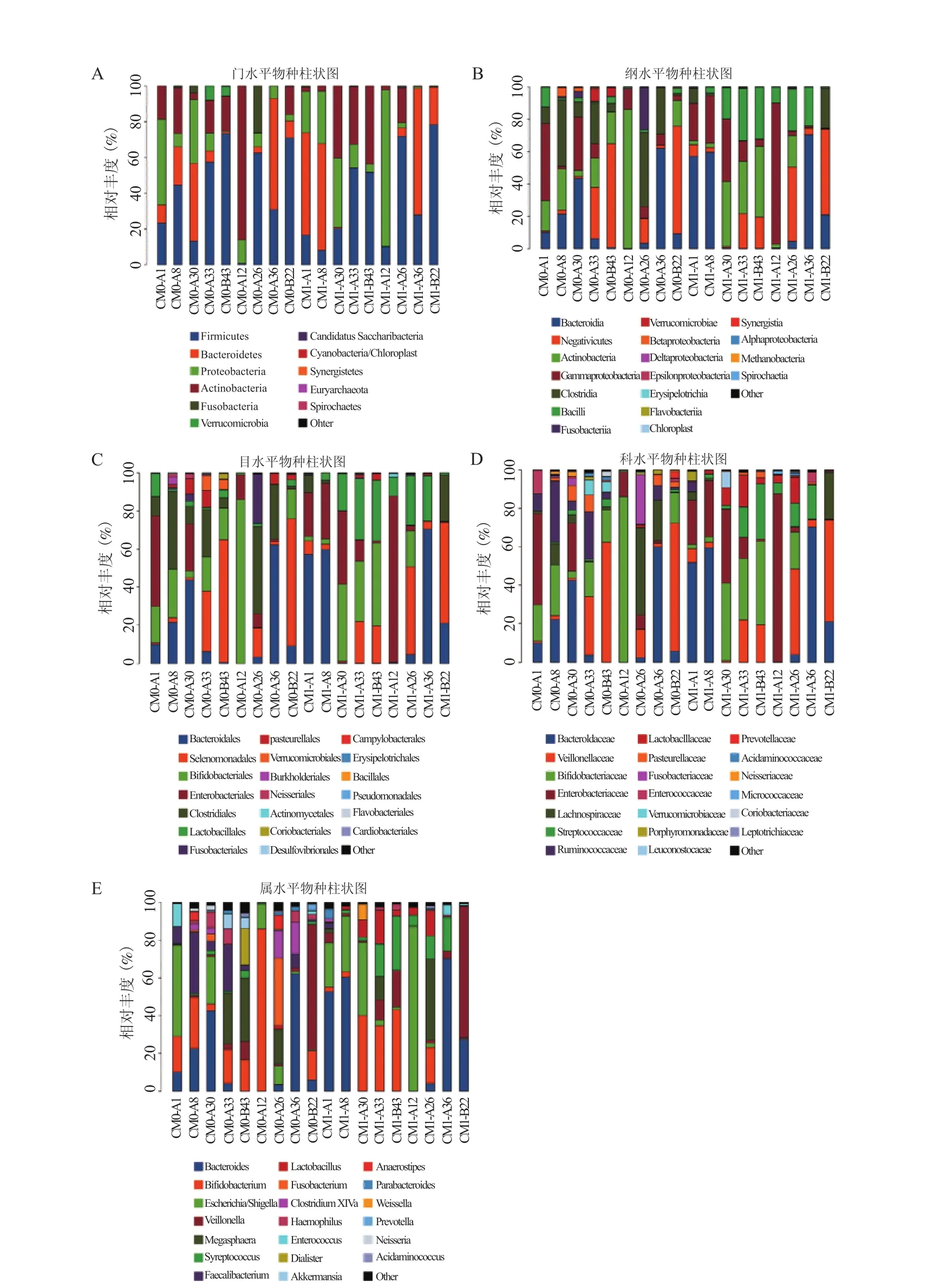
图2 标本各分类水平中的丰度柱状图各图中横坐标为标本编号Figure 2 Abundance profiling of the samples in different phylogenetic levels
2.4.4 物种MRPP分析 统计量(A)值>0说明组间差异大于组内差异,A值<0说明组内差异大于组间差异,Observe Delta值越小说明组内差异越小,Expect Delta值越小说明组间差异越小;P<0.05为差异显著。苍苓散治疗前后的标本MRPP分析显示,2组间差异无统计学意义(P>0.05)(见表2)。

图3 2组标本各分类水平中的丰度柱状图各图中横坐标为分组编号Figure 3 Abundance profiling of the samples in 2 groups in different phylogenetic levels
2.5 物种分析 苍苓散治疗前患儿的标本中脱硫弧菌目(Desulfovibrionales)、脱硫弧菌科(Desulfovibrionaceae)、瘤胃菌科(Ruminococcaceae)、嗜胆菌属(Bilophila)、隐秘杆菌属(Faecalibacterium)丰度较高;治疗后患儿的标本中乳杆菌目(Lactobacillales)、乳 杆菌科(Lactobacillaceae)、 乳杆 菌属(Lactobacillus)、丰度较高。通过对样品均值的秩和检验分析发现,2组物种间差异有统计学意义(P<0.05)(见表3)。
3 讨 论
小儿以腹泻症状为主,在中医学中称为“泄泻”。中医理论认为,该病的主要病机为脾困湿盛,故当以运脾化湿为治法,苍苓散则是治疗小儿泄泻的有效验方。该方由苍术、茯苓、陈皮、厚朴、山楂炭、甘草等组成,方中重用苍术运脾燥湿,宣阳化浊,茯苓淡渗利湿,健脾和中,两者相合,相辅相成;配陈皮、厚朴芳香化湿,调理气机;辅以甘草益中焦、和百药,山楂炭酸敛止泻,使脾运湿化,升降调和,而清浊得分,以达止泻之效。有前瞻性、多中心的随机对照临床研究证实,该方治疗包括RV肠炎在内的小儿急性非感染性腹泻病有显著疗效[11],但目前尚未明确其具体作用机制。
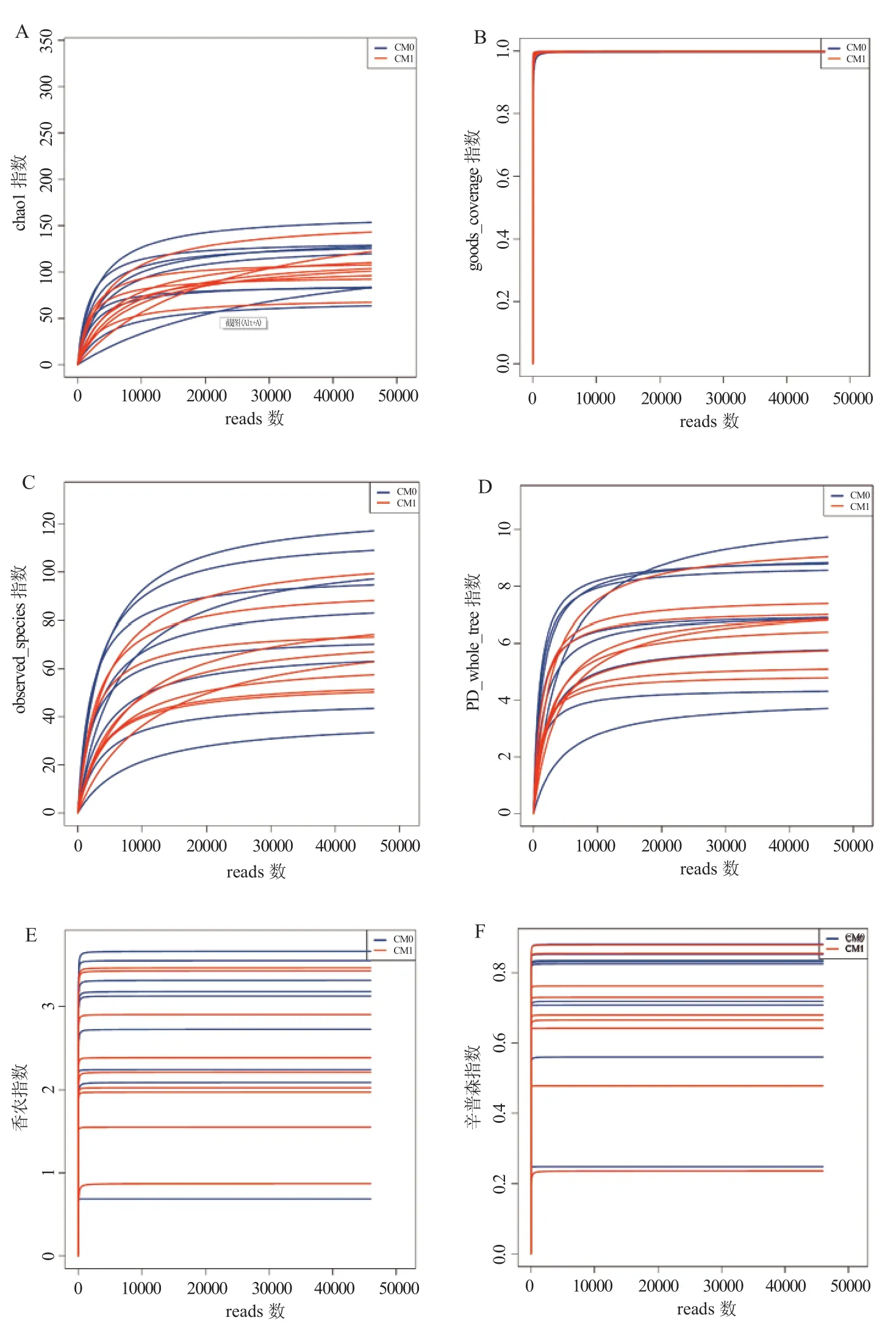
图4 标本物种丰度Alpha多样性指数稀释曲线图横轴表示抽取的reads数量,纵轴表示相应Alpha多样性指数的值。图中一种颜色代表一组样品,测序条数不能覆盖样品时,曲线呈直线上升;测序条数增加到覆盖样品中的大部分微生物时,曲线呈现平滑趋势Figure 4 Rarefaction curves of the Alpha diversity in the samples
近年来,肠道菌群与婴幼儿RV感染的关系得到重视。研究发现,RV肠炎患儿与同龄健康婴幼儿的肠道菌群间存在显著差异,表现为多样性降低,感染后恢复期的稳定性下降,某些特定菌群也有较大不同,如变形菌门(Proteobacteria)的丰度增高,而厚壁菌门(Firmicutes)的丰度则降低等[7]。最近的研究结果还提示,婴幼儿接种RV疫苗的成功率与肠道菌群相关,特别是变形菌门中的沙雷菌属(Serratia)和肠杆菌属(Escherichia coli)在疫苗无反应者的肠道中丰度显著低于有反应者,而这些菌属可通过鞭毛和内毒素的途径等,影响机体的免疫反应,这可能是低收入国家人群中疫苗有效性不佳的重要原因[12],但这种肠道菌群间的差异是否是食物、卫生环境或宿主因素所导致的,目前尚无研究结论。

表1 样品Alpha多样性统计结果Table 1 Statistical results of the Alpha diversity in the samples

图5 Beta多样性热图A. 加权UniFrac;B. 非加权UniFracFigure 5 Heat map of Beta diversity in the samples

图6 2组标本主坐标分析图A. 加权的UniFrac结果;B. 非加权的UniFrac结果;图中各点分别表示各个样品,不同颜色代表样品属于不同的分组Figure 6 Principal co-ordinates analysis of the main samples in 2 groups
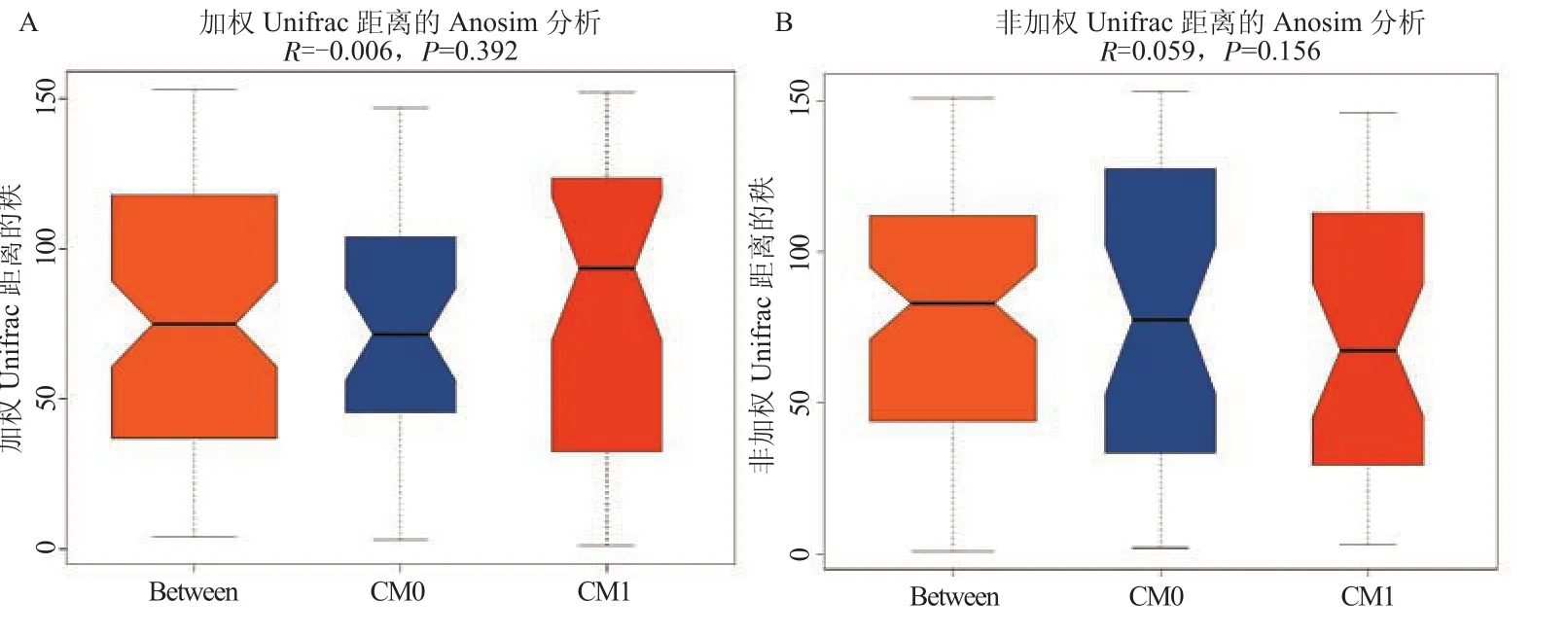
图7 2组标本相似性分析图A. 加权Unifrac结果;B. 非加权Unifrac结果Figure 7 Anosim analysis of the samples in 2 groups

表2 MRPP 2组间差异分析Table 2 MRPP differential analysis between 2 groups

表3 2组间差异显著物种列表Table 3 The significant different species between 2 groups
本项研究利用基于16S rDNA的高通量测序技术,对苍苓散治疗前后患儿的肠道菌群进行了比较,发现2者在门水平上均以厚壁菌门的丰度为最高。治疗后(CM1)肠道菌群中乳杆菌科、乳杆菌目与乳杆菌属均较治疗前(CM0)显著增多(P<0.05)。乳杆菌是人和哺乳动物肠道内的重要益生菌,研究发现乳杆菌制剂——Lactobacillus rhamnosus GG能改善肠道免疫功能,提高RV感染后小猪空肠黏膜内的sIgA水平[13],减轻RV感染婴幼儿及实验动物的腹泻症状[13-14]。既往以荧光定量PCR检测法的研究也发现,苍苓散治疗后RV肠炎患儿sIgA含量的升高与乳杆菌之间呈显著的正相关[15],进一步提示中药可能通过影响肠道相关益生菌如乳杆菌的功能而起治疗作用。
此外,本项研究结果中,用香农指数、辛普森指数所估算的微生物群落多样性,UniFrac聚类分析判断的物种组成相似性,以及PCoA、Anosim分析及物种MRPP分析等,均未能发现苍苓散治疗前后患儿的肠道菌群结构存在显著差异,这可能与样本量小及观察治疗的时间较短有关。此外,研究原设计有益生菌对照组,但可能因为近几年RV疫苗的推广使用,婴幼儿RV肠炎的发病率显著下降,故未能采集到足够病例,今后需要更大样本、更深入的对照研究,以进一步明确中医药治疗婴幼儿RV肠炎的肠道菌群具体机制。
