不同品种党参游离糖成分的气相色谱-质谱研究
2018-09-10李家宇左之文王曦璠陈林王玺贺炜周卿意骏张水寒
李家宇 左之文 王曦璠 陈林 王玺 贺炜 周卿意骏 张水寒
〔摘要〕 目的 运用气相色谱-质谱联用技术对党参Codonopsis pilosula (Franch.) Nannf、素花党参Codonopsis pilosula Nannf. var. modesta (Nannf.) L. T. Shen及川党参Codonopsis tangshen Oliv.的游离糖成分进行分析鉴定。方法 采用震荡提取法从党参中提取多种游离糖化合物,游离糖成分经乙酰化后利用气相色谱-质谱法分析其组成、结构。结果 通过气相色谱-质谱分析结合标准品数据以及相关文献,鉴别出3种党参中7种游离糖成分,分别为山梨糖、半乳糖、葡萄糖、D-甘露糖、果糖、肌醇、蔗糖,游离糖含量存在差异。结论 气相色谱-质谱联用技术可以对党参游离糖成分进行定性及定量分析,为党参品质分析提供科学依据。
〔关键词〕 党参;乙酰化;游离糖;气相色谱-质谱联用
〔中图分类号〕R284.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2018.12.010
党参作为一味传统的名贵中药材,来源为桔梗科植物党参Codonopsis pilosula (Franch.) Nannf.、素花党参Codonopsis pilosula Nannf. var. modesta (Nannf.) L. T. Shen或川党参Codonopsis tangshen Oliv.的干燥根[1]。其味甘性平,具有补中益气、健脾益肺之功效[2]。主治脾肺虚弱、气短心悸、食少便溏、虚喘咳嗽、内热消渴等症[3]。党参之名始见于《本草从新》,书中所述的“真党参”系指产于山西上党(今山西长治)的五加科人参[4]。随着五加科人参资源的减少,形似人参的替代品被采用,至清代已将根有狮子盘头的一类替代药材独立出来作为新的药材品种,并定名党参。
党参的质量评价一直备受关注,“味甜者佳”的观点作为民间判断党参质量优劣的方式,但存在缺陷,如何更加客觀、科学地评价党参甜度与质量的关系值得研究。通常,“甜味”的强弱用甜度来表示[5],而甜度与游离糖的含量相关。气相色谱-质谱联用(GC-MS)方法具有高分离度、高速度、高灵敏度等特点,已在众多领域中得到广泛应用[6-8]。因而,本文采用GC-MS分析方法对不同品种、不同产地党参中的游离糖成分进行了快速测定和比较,以期为党参品种甄别和品质分析提供科学参考。
1 材料与方法
1.1 材料与试剂
甲醇(德国Merck公司)、乙酸(美国Tedia公司)为色谱纯;其他试剂均为分析纯;实验用水采用重蒸纯净水(华润怡宝饮料长沙有限公司)。单糖标准品:D-木糖、鼠李糖、岩藻糖、阿拉伯糖、核糖醇、L-阿拉伯糖醇、木糖醇、山梨糖、半乳糖、葡萄糖、果糖、D-甘露糖、肌醇、甘露醇、D-山梨醇、蔗糖、半葡胺标准品(长沙锦农生物科技有限公司)。
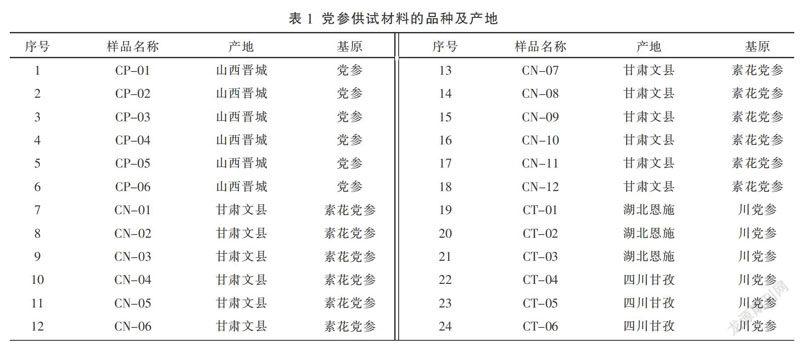
本实验所采用的24批党参药材(见表1)分别采集自山西省晋城市、甘肃省文县、湖北省恩施县及四川省甘孜州等地,经湖南省中医药研究院湖南中药研究所刘浩助理研究员鉴定,分别为桔梗科植物党参Codonopsis pilosula (Franch.) Nannf.的干燥根、素花党参 Codonopsis pilosula Nannf. var. modesta (Nannf.) L. T. Shen的干燥根、川党参Codonopsis tangshen Oliv.的干燥根,均为2015版《中华人民共和国药典》所收载的品种。
1.2 仪器
GC-2014气相色谱仪(日本岛津公司);NDK200-1氮吹仪(杭州米欧仪器厂);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);SHZ-DIII循环水式真空泵(上海贝仑仪器设备有限公司);KM-500DB台式超声波清洗器(昆山市美美超声仪器有限公司);HC-700高速多功能粉碎机(永康市天祺盛世工贸有限公司);AE240电子天平(瑞士梅特勒-托利多国际有限公司)。
1.3 气相色谱检测条件
VF-23 ms(30 m×0.25 mm×0.25 μm) 毛细管柱;载气为高纯氦;柱流量1.0 mL/min;分流比45∶1;进样口温度220 ℃;柱压73.0 kPa;程序升温:起始温度100 ℃,10 ℃/min升至180 ℃,保持1 min,1 ℃/min升至190 ℃,保持2 min,30 ℃/min升至220 ℃,保持2 min,0.5 ℃/min升至222 ℃,保持3 min,0.5 ℃/min升至230 ℃,保持5 min。
1.4 质谱检测条件
电子轰击(EI)离子源,离子源温度220 ℃,接口温度250 ℃,质量扫描范围45~550 m/z。
1.5 标准品及供试品溶液的制备
1.5.1 标准品溶液的制备 精密称取5.0 mg核糖醇标准品,溶于50.0 mL二甲亚砜(DMSO)中,定容[9]。配制成0.1 mg/mL的核糖醇-二甲亚砜溶液备用。精密称取0.1 mg标准品,溶于0.2 mL核糖醇-二甲亚砜溶液(0.1 mg/mL)中。以0.03 mL 1-甲基咪唑为催化剂,0.2 mL乙酸酐为乙酰化试剂[10],30 ℃水浴,振荡、搅拌10 min,加1.0 mL蒸馏水,除去过量乙酸酐,终止反应。以0.2 mL二氯甲烷萃取2次,合并后用无水硫酸钠除去残留水分,过0.22 μm滤膜,备用。
1.5.2 党参供试液的制备 将样品置于烘箱中干燥至恒重。精密称取样品细粉50.0 mg,置于10.0 mL离心管中。加入1 mL含0.1 mg/mL核糖醇提取液(三氯甲烷∶甲醇∶水=12∶5∶1),4 ℃震荡过夜。3 000 r/min离心10 min,取上层清液,挥干。复溶于0.1 mL二甲亚砜中,以0.03 mL 1-甲基咪唑为催化剂,0.2 mL乙酸酐为乙酰化试剂,30 ℃水浴,振荡、搅拌10 min,加1.0 mL蒸馏水终止反应。以0.5 mL二氯甲烷萃取2次,将下层有机层提取、合并后用无水硫酸钠除去残留水分,过0.22 μm滤膜,备用。
1.6 方法学考察
1.6.1 精密度试验 取CT-01号样品溶液,按“1.5.1”项下方法制备供试品溶液,按“1.3”项色谱条件连续进样5次,记录峰面积,分别计算相对标准偏差(relative standard deviation, RSD)。
1.6.2 重复性试验 取同一批党参样品5份,按“1.5.1”项下方法制备供试品溶液,按“1.3”项色谱条件进行分析测定,分别计算RSD。
1.6.3 稳定性试验 取同一份置于4 ℃冰箱内的供试品溶液,按“1.3”项色谱条件在0、2、4、8、12、24 h分别进行测定,分别记录峰面积,分别计算RSD。
1.7 GC-MS测定党参中的游离糖的含量
按“1.5.1”项下方法制备标准品供试溶液,以核糖醇标准品为内标试样,分别进样0.1、0.5、1.0、2.0、4.0、8.0 ?滋L分别计算核糖醇的标准曲线以及各标准品与核糖醇的相对校正因子。
按“1.5.2”项下方法制备样品供试溶液,取2.0 ?滋L供试溶液注入气相色谱质谱联用分析系统。根据单糖及糖醇标准品的气相色谱质谱的色谱图进行分辨,对样品中的糖类化合物进行定量分析。
糖类化合物含量计算公式:
mi=f×(Ai×ms)/As
mi、ms分别表示待测糖以及内标试样的质量,Ai、AS分别表示待测糖以及内标试样的峰面积,f表示待测糖和内标的相对校正因子。
2 结果
2.1 党参游离糖组成及含量
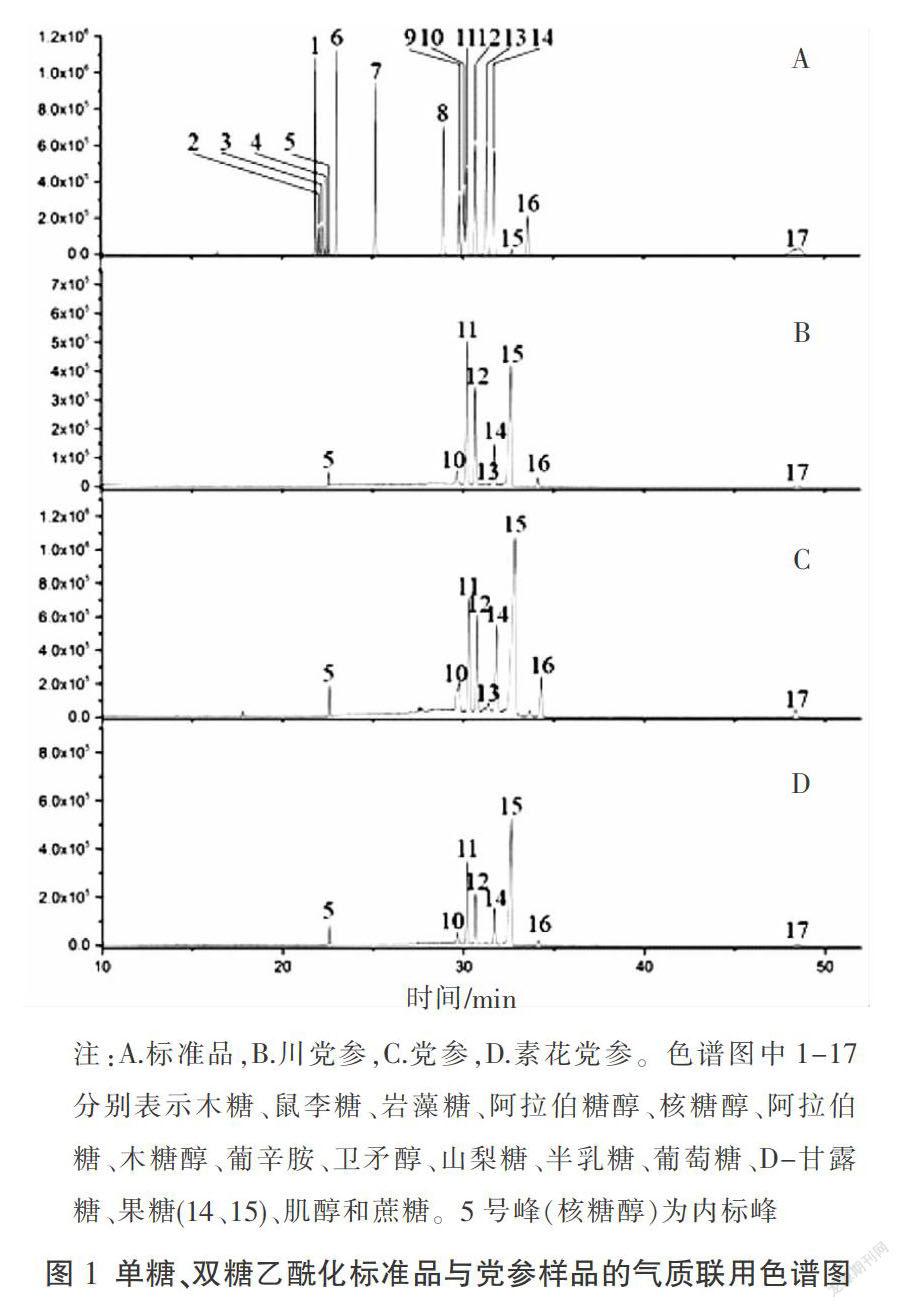
17个标准物质的混合样品,经过气相色谱-质谱联用色谱分析所得色谱图见图1(A),不同党参的样品中游离糖衍生物经过气相色谱-质谱联用色谱分析所得色谱图见图1。
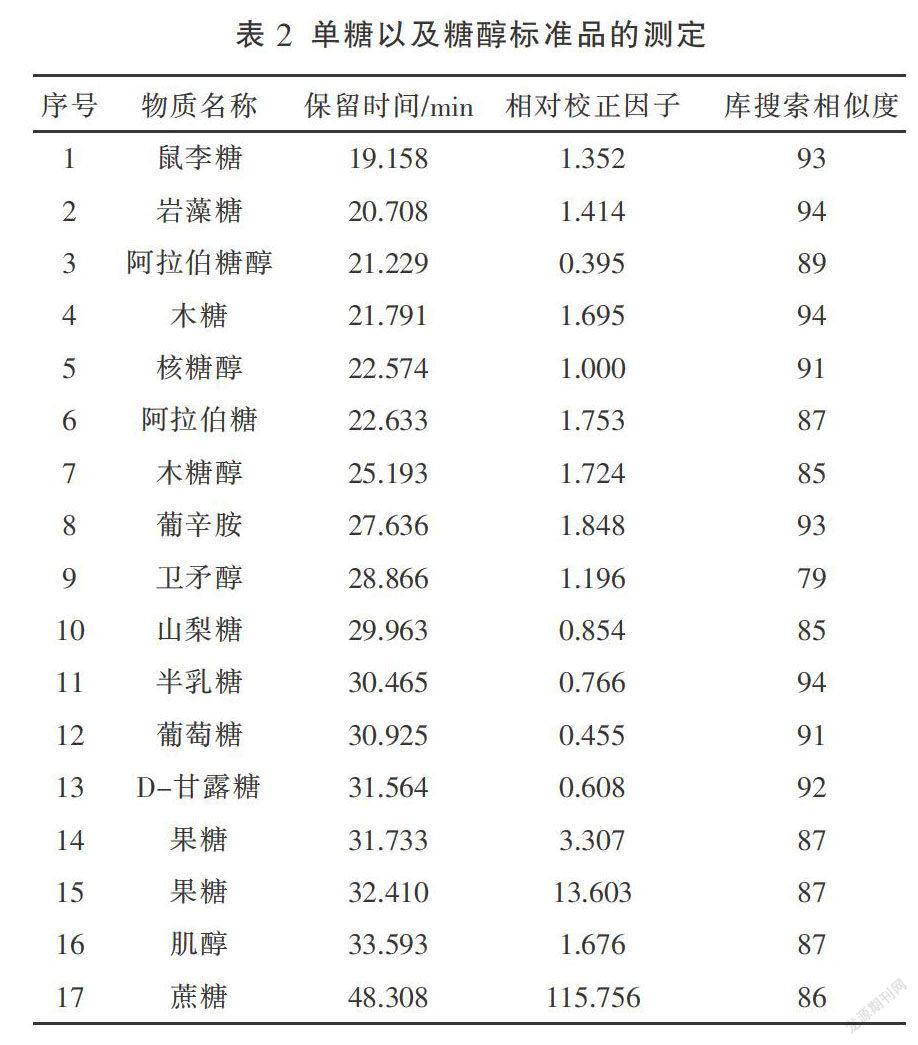
进一步利用NIST05库进行搜索与匹配,对17种标准物质进行鉴定,所得结果如表2所示。其中,内标核糖醇的标准方程为
ms=2.0×10-7As+7.7×10-3,r=0.999 0
2.2 方法学考察
精密度:山梨糖、半乳糖、葡萄糖、D-甘露糖、果糖、肌醇、蔗糖的RSD分別为0.20%、0.13%、0.16%、0.21%、0.19%、0.22%、0.22%,表明仪器精密度较好。
重复性:山梨糖、半乳糖、葡萄糖、D-甘露糖、果糖、肌醇、蔗糖的RSD分别为0.23%、0.17%、0.18%、0.25%、0.23%、0.22%、0.24%,表明方法的重复性较好。
稳定性:山梨糖、半乳糖、葡萄糖、D-甘露糖、果糖、肌醇、蔗糖的RSD分别为0.19%、0.15%、0.18%、0.22%、0.21%、0.22%、0.23%,表明供试品溶液在4 ℃条件下,24 h内稳定性良好。
2.3 不同党参样品的游离糖组成及含量分析
对党参样品采用相同的预处理并对党参中的糖及糖醇类成分采用相同分析条件进行定量分析,不同品种党参游离糖组成及含量见表3。党参主要包括山梨糖、半乳糖、葡萄糖、D-甘露糖、果糖、肌醇、蔗糖,且这7种糖及糖醇成分的含量在不同党参中存在差异。
3 讨论
研究系首次通过GC-MS联用技术分析2015版《中华人民共和国药典》中收录的3种党参游离糖的含量,发现不同品种的党参游离糖有相同点及差异性。相同点为不同党参所含游离糖种类基本相同,均包括山梨糖、半乳糖、葡萄糖、果糖、肌醇、蔗糖在内的6种游离糖。差异性则表现在不同品种党参游离糖的百分含量有显著差异性;桔梗科植物党参的干燥根中可检出D-甘露糖,而素花党参及川党参的干燥根中未检出D-甘露糖。D-甘露糖可作为辨别桔梗科植物党参的标志性单糖成分。3种党参中最主要的游离糖成分均为果糖和葡萄糖。在对党参甜度的贡献上,果糖对甜度的影响最大,其次为蔗糖,这两种糖类成分在党参中的含量较高,占游离糖成分90%以上,对党参的甜味的影响相较于其他糖明显。山梨糖、半乳糖、葡萄糖、D-甘露糖、肌醇等糖类成分,由于在党参中的含量较低,对党参的甜度影响作用较小。
本研究通过GC-MS分析结合标准品数据以及相关文献,在保留时间、分子式等方面对党参游离糖成分进行定性及定量分析。建立了一种准确、快速的中药党参游离糖分析方法,此方法可为党参品质分析提供游离糖成分方面的参考,并为党参干燥加工提供指导。
参考文献:
[1] 国家药典委员会.中华人民共和国药典[S].一部.北京:化学工业出版社,2015:264.
[2] 杨鹏飞,楚世峰,陈乃宏.党参的药理学研究进展及其抗脑缺血再灌注损伤的机制[J].湖南中医药大学学报,2015,35(12):5-10.
[3] 焦红军.党参的药理作用及其临床应用[J].中国中医药现代远程教育,2012,25(19):92-92.
[4] 邹荫甲.党参的本草学考证[J].中草药,2000,31(6):466-467.
[5] BELITZ H D, GROSCH W, SCHIEBERLE P.食品化学:第3版[M].中国农业大学出版社,2008.
[6] 陈晓水,侯宏卫,边照阳,等.气相色谱-串联质谱(GC-MS/MS)的应用研究进展[J].质谱学报,2013,34(5):308-320.
[7] DIMITRA J D, BASIL N Z, MOSCHOS G P, et al. GC-MS analysis of essential oils from some greek aromatic plants and their fungitoxicity on penicillium digitatum[J]. Journal of Agricultural & Food Chemistry, 2000, 48(6):2576-2581.
[8] LUEDEMANN A, STRASSBURG K, ERBAN A, et al. TagFinder for the quantitative analysis of gas chromatography-mass spectrometry (GC-MS)-based metabolite profiling experiments[J]. Bioinformatics, 2008, 24(5):732-737.
[9] 高凡茸.黄芪药材甜味与品质关联性研究及黄芪糖谱分析方法的建立[D].太原:山西大学,2015.
[10] 廖洪梅,戴 玲,魏晓飞,等.单糖乙酰化条件的优化[J].理化检验·化学分册,2008,44(5):441-443.
