Cry2A毒素抗独特型单链抗体库的构建
2018-09-10刘媛刘敏张霄徐重新林曼曼胡晓丹仲建锋谢雅晶罗楚平张存政刘贤金
刘媛 刘敏 张霄 徐重新 林曼曼 胡晓丹 仲建锋 谢雅晶 罗楚平 张存政 刘贤金

摘要:为了降低苏云金杆菌Cry2A毒素的免疫检测成本,开发廉价、无毒试剂盒,采用整体抗体免疫和噬菌体展示技术的路线,设计和构建了Cry2A抗独特型单链抗体库。以Protein A纯化的Cry2A兔多克隆抗体为免疫原,对雌性Balb/e系小鼠进行了免疫。在优化的包被原浓度下,用ELISA法测定小鼠血清效价及抗独特型抗体组分。选取效价最高的小鼠,取脾脏提取总RNA,RT-PCR法合成cDNA第一链。设计简并引物,利用PCR法扩增小鼠VH、VK基因,再用SOE-PCR法进行单链抗体基因的拼接。SOE-PCR产物和pIT2载体经双酶切后连接,电转入感受态E.Coli、TG1完成建库,并用多克隆噬菌体ELISA对抗体库与免疫原的结合能力进行了鉴定。结果表明,免疫鼠血清的效价在1:1.6xl05到1:6.4x l05倍之间。免疫鼠血清可对Cry2A与其兔多克隆抗体的结合最高可产生17. 6%的抑制,证明Ab2B和Ab2y型抗独特型抗体的存在。最终构建了庫容为1.2xl07的Cry2A抗独特型单链抗体库,该抗体库与免疫原的结合信号/背景比值为6. 04。
关键词:Cry2A毒素;抗独特型抗体;单链抗体;噬菌体展示
中图分类号:X836
文献标识码: A
文章编号: 1000-4440(2018) 05-1174-09
苏云金杆菌Cry毒素是全球应用最为成功的杀虫蛋白资源,对多种鳞翅目、双翅目、鞘翅目等昆虫存在毒性,也对线形动物门和原生动物门的某些种类存在毒性。随着转Cry毒素基因作物的广泛种植和在农药制剂中的大量使用Cry毒素,Cry毒素可能存在的生态安全风险和对非靶标生物的安全隐患也广受关注。为加强转基因作物监管,保障消费者的知情权,国内外各实验室也陆续开展了Cry毒素检测方法的研。其中免疫学检测以其检测灵敏度高、检测通量大等优势成为一种主流的检测方法。Cry毒素标准品作为免疫学检测的必备试剂,目前主要由美国Envirologix公司提供,价格较高,这导致Cry毒素免疫学检测成本的增加。因此,有必要寻找Cry毒素的廉价、无毒、安全替代蛋白质,创制具有自主知识产权的生物制剂。
抗独特型抗体作为一种有效的生物模拟材料,可以模拟多种毒素的特征表位,作为毒素标准品的替代物应用于免疫检测试剂盒以降低检测成本,而且不具毒性。目前已在黄曲霉毒素、微囊藻毒素、呕吐毒素、富马毒素、T2毒素等生物毒素的抗独特型抗体制备和应用中取得成功。但是抗独特型抗体技术的发展也存在一些制约因素,其中之一是抗独特型抗体的制备难度大。以抗独特型抗体制备的主流方法单克隆抗体技术为例,首先是抗独特型抗体的阳性克隆率低,一般制备成功率是常规抗体的几百分之一。其次,抗体分离纯化困难。由于抗独特型抗体形成过程中,同时产生针对不同决定簇的α、β、y、δ4种类型抗独特型抗体,要筛选获得建立检测技术所需的β或γ型,难度较大。20世纪90年代兴起的抗体库技术,为抗独特型抗体的制备提供了新契机。但是由于从天然抗体库中筛选获得抗独特型抗体的几率较低且亲和力不高,因此先通过动物免疫增加抗独特型抗体丰度,再构建免疫抗体库用于筛选,可以大大增加筛选阳性率和抗体的亲和力。
虽然Cry毒素存在较大的检测需求,但是国内外尚无Cry毒素抗独特型单链抗体库构建的报道。本研究拟联合采用整体抗体免疫和噬菌体展示的技术路线,构建Cry2A毒素抗独特型单链抗体库,为其独特型单链抗体的筛选和无毒检测试剂盒的构建奠定基础。
1 材料与方法
1.1 材料
Cry2A多抗血清由本实验室免疫新西兰大白兔自制获得。HiTrap Protein A HP柱、辣根过氧化物酶(HRP)标记的抗M13单抗购自美国GE Health-care公司。BCA蛋白定量试剂盒购自康为世纪有限公司。弗氏完全佐剂、弗氏不完全佐剂、四甲基联苯胺(TMB)购自美国Sigma公司。6~8周龄雌性BALB/c系小鼠购自扬州大学比较医学研究中心。Cry2A毒素标准品购自美国Envirologix公司。TR-Izol购自美国Thermo Fisher公司。SuperScriptTMⅢ试剂盒购自美国Invitrogen公司。T4 DNA连接酶、限制性内切酶Nco I和NotI、辅助噬菌体M13K07购自美国NEB公司。2xtaq PCR master mix和2xpfuPCR master mix分别购自德国DBI公司和东盛生物有限公司。半合成人源Tomlinson I库、含有牛血清白蛋白(BSA)单链抗体基因的pIT2载体、E.Coli.TG1购自英国Source Bioscience有限公司。HRP标记的羊抗鼠IgG和HRP标记的羊抗兔IgG购自美国KPL公司。DNA凝胶回收试剂盒、PCR产物纯化试剂盒、96孔酶标板购自美国Coming公司。四甲基联苯胺(TMB)购自美国Sigma公司。脱脂奶粉购自索莱宝生物科技有限公司。试验所用其他化学试剂及有机溶剂均为国产分析纯。
1.2 Cry2A兔多克隆抗体的纯化与鉴定
参照HiTrap Protein A HP说明书,将实验室自制的Cry2A兔多抗血清进行亲和纯化。纯化抗体用SDS-PAGE检测纯度,银染显色。并以BSA为参照蛋白质,用蛋白质定量试剂盒测定纯化抗体浓度,分装后于-80℃保存。
1.3 动物免疫
以Protein A柱纯化的Cry2A兔多克隆抗体作为免疫原,免疫3只6~8周龄雌性Balb/c系小鼠,免疫前l周采集阴性血清。具体免疫程序如下:首免采用每只100μg/ml用50 mmol/L pH7.4的磷酸盐缓冲液(PBS)溶解的免疫原与等体积弗氏完全佐剂混和,乳化成油包水结构后进行腹腔注射。14 d后用同样剂量的免疫原与等体积不完全弗氏佐剂混合乳化后进行加强免疫。此后每隔14 d加强免疫1次。共计免疫4次。从第2次加强免疫开始,每次免疫后7d,断尾取血,制备鼠抗血清,用于效价监测。
1.4 包被原工作浓度优化、抗血清效价及抗独特型抗体组分的测定
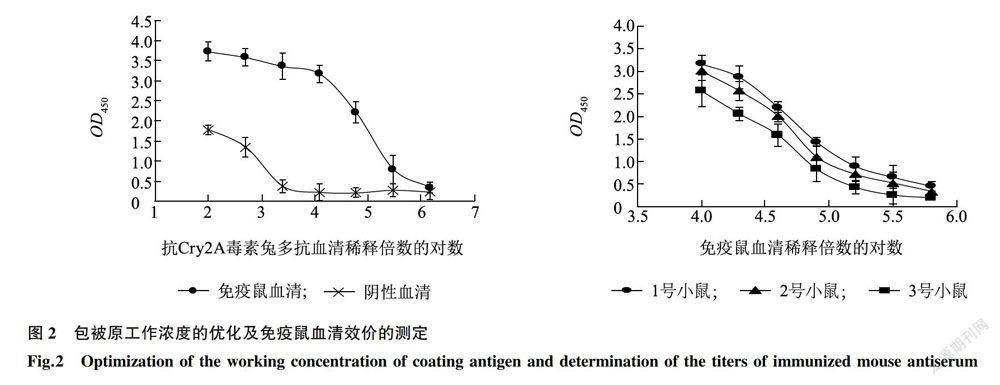
用间接非竞争ELISA法优化包被原浓度并测定小鼠抗血清效价。具体步骤如下:(1)包被:用50mmol/L pH9.6的碳酸盐缓冲液(CBS)对Cry2A兔多抗血清从100倍开始进行5倍稀释,每孔100μl加入96孔酶标板,4℃包被过夜。(2)封闭:含0.05% Tween 20的PBS缓冲液(PBST)洗板3次后,每孔200μl加入PBS溶解的2%脱脂奶粉(MPBS),37℃孵育th。(3)加样:PBST洗板3次后,将最后一次采血得到的l号鼠抗血清和对应的阴性血清,用PBS稀释10000倍,每孔100μl加入酶标板,37℃孵育th。(4)加酶标二抗:PBST洗板3次后,每孔100μl加入5000倍PBS稀释的HRP标记的羊抗鼠IgG,37℃孵育lh。(5)显色:PBST洗板3次后,每孔100μl加入现配的底物溶液(100μl 10mg/ml=甲亚砜溶解的TMB和25μ1 0.65%H202溶于9.875ml 100 mmol/L pH 5.5的柠檬酸缓冲液),37℃显色15min。(6)终止反应:每孔50μl加入2mol/L H2S04,用酶标仪在450nm波长下读数。小鼠抗血清效价测定在优化的包被原浓度下进行,具体操作同包被原优化方法,以吸光值大于阴性孔2.1倍时的鼠抗血清的最大稀释倍数作为效价。
采用间接竞争ELISA法测定鼠抗血清中抗独特型组分。具体操作同包被原优化方法,但在以下操作中有改动:(1)包被:用2μg/ml Cry2A毒素包被酶标板。(2)加样:每孔加入50μl 250—16000倍PBS稀释的最后一次采血得到的l号鼠抗血清与50μ1 10000倍稀释的Cry2A兔多抗血清,另外以同样稀释倍数的鼠阴性血清与Cry2A兔多抗血清混合,作为阴性对照。(3)二抗:加入5000倍PBS稀释的HRP标记的羊抗兔IgG。其余ELISA步骤同包被原优化方法。
1.5 鼠抗体VH和VK基因的扩增和拼接
l号小鼠拉颈处死后取脾脏,参照TRIzol试剂说明书提取总RNA。再采用SuperScriptTMⅢ试剂盒将RNA反转录为cDNA第一链。参考Clackson等和Orlandi等的报道,设计VH和VK扩增引物(表1)。以cDNA第一链为模板,用VHIBACK-Ncol和VHIFOR-2为引物扩增VH基因,以Vk2BACK 和 Vk4FOR-Not I(Vk4FORl-Not I、Vk4FOR2-Not I、Vk4FOR3-Not I、Vk4FOR4-Not I等比例混合)为引物扩增VK基因,反应体系在lxPFUPCR master mix中进行。Linker则以pSW2scDl.3基因为模板,LINKBACK和LINKFOR为引物,lxPFUPCR master mix中进行扩增。PCR反应条件均为94℃5min;94℃ 45s,55℃45s,72℃1min,30个循环,72℃ 10 min。产物胶回收后用于下一步scFv基因的拼接。
参考Pasello等的方法进行scFv基因拼接。具体为取等摩尔的VH、VK和Linker基因混合后,在lxtaq PCR master mix体系中,进行第一步SOE-PCR,PCR反应条件为94℃1 min,65℃1mm,72℃ lmin,30个循环,72℃ 7min。第一步拼接产物用无菌水稀释1000倍后,加入含有引物VHIBACK-Ncol和Vk4FORl-Notl的lxtaq PCR master mix体系。PCR条件设置为94℃ 40s,55℃40 s,72℃2min,5个循环:94℃ 40 s,50℃40s,72℃ 2 min,5个循环;94℃ 40 s,45℃ 40 s,72℃2 mm,5个循环:94℃40 s,40℃ 40 s,72℃ 2 min,15个循环;72℃7min,产物胶回收后用于酶切。
1.6 Cry2A毒素抗独特型单链抗体库的构建
分别对lμg胶回收纯化的SOE-PCR产物及lμg带有BSA单链抗体基因的pIT2质粒,采用NotI和Noc I双酶切。37℃酶切过夜后,80℃灭活10min。酶切产物及质粒用T4连接酶16℃连接过夜,65℃灭活10 min,PCR产物纯化试剂盒纯化,去除连接酶及缓冲液中的盐离子成分,再用无菌水溶解备用。将50μl TG1电转感受态和2μl纯化后的连接产物加入预冷的lmm电转杯(共设置10组反应),调节电压为1.25 kV,用Biorad电转仪进行电转。电转产物快速加入lml SOC培养基,37℃,100r/min缓慢振荡培养1h。取适当稀释后的培养液涂布1块含有1%葡萄糖和100μg/ml氨苄青霉素的TYE平板(TYE-AG),其余培養液涂布10块TYE-AG平板,37℃倒置培养过夜。次日对稀释液涂布板计数,计算抗体库库容。抗体库的扩增、辅助噬菌体救援方法参考De Wildt等的报道。
1.7 多克隆噬菌体ELISA
采用CBS缓冲液稀释的10μg/ml Cry2A纯化兔多克隆抗体及同样质量浓度的脱脂奶粉以每孔100μl加入酶标板,4℃包被过夜。次日PBST洗板3次后,每孔200μ1加入2%MPBS,室温孵育2h。PBST洗板3次后,每孔100μl将从Cry2A抗独特型单链抗体库中救援的噬菌体分别加入Cry2A纯化兔多克隆抗体及脱脂奶粉包被孔,同样数量的未经筛选的人源Tomlinson I库救援噬菌体作为阴性对照,室温孵育l h。PBST洗板3次,每孔100μl加入5000倍PBS稀释的HRP标记的抗M13单抗,室温孵育th。其余显色步骤同方法1.4中的ELISA操作。读取Cry2A抗独特型单链抗体库和TomlisonI库分别在Cry2A纯化兔多克隆抗体和脱脂奶粉包被孔产生的吸光值,计算信号/背景比值(S/B)。
2 结果与分析
2.1 Protein A纯化的抗Cry2A毒素兔多克隆抗体
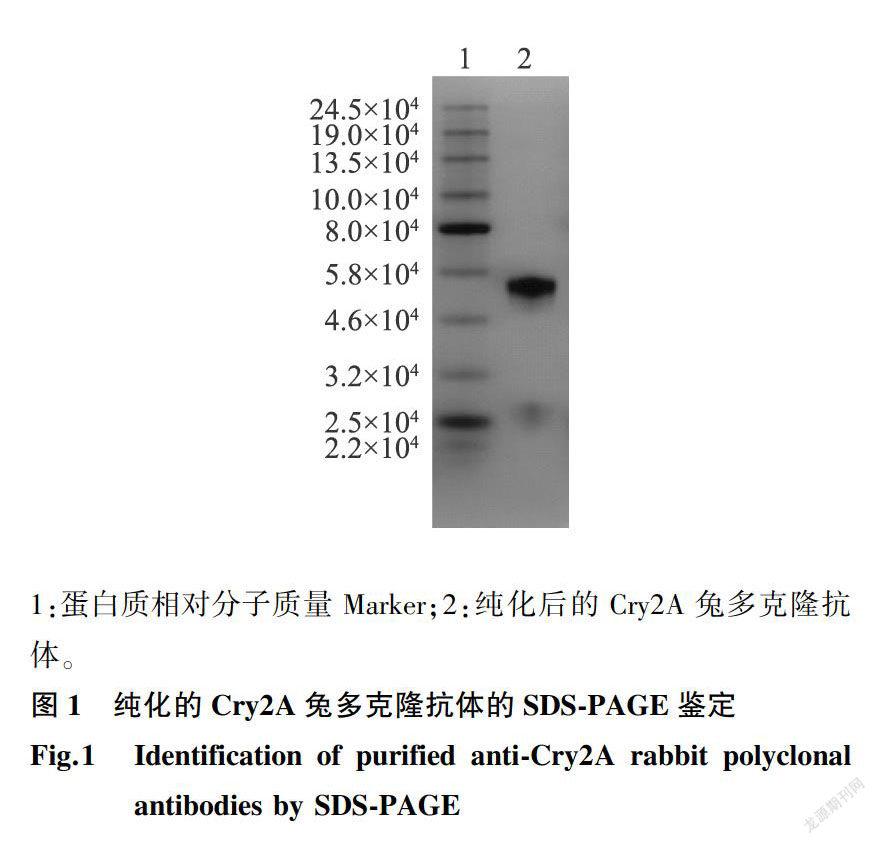
免疫原的纯度是获得高质量免疫应答效果的重要影响因素之一。除了免疫球蛋白(γ球蛋白)之外,抗血清中还存在大量的白蛋白、α球蛋白、β球蛋白等组分。前期制备的Cry2A兔多克隆抗血清,成分较为混杂,因此采用对兔多克隆抗体Fc片段有强烈结合能力的Protein A柱对抗血清进行了亲和纯化。经过Protein A纯化的抗Cry2A毒素兔多克隆抗体的SDS-PAGE鉴定结果(图1)显示,分别在相对分子质量5.5×l04和2.6xl04左右有2个条带,这是由于抗体经过SDS的变性处理后,抗体重链和轻链之间的二硫键打开形成的2条链。凝胶上未见其他杂带,纯化效果较好,可以用于下一步的小鼠免疫试验。
2.2 包被原工作浓度的优化及免疫鼠血清效价和抗独特型组分的测定
由于本试验所用的二抗HRP标记的羊抗鼠IgG对包被原Cry2A兔多抗血清存在较高的交叉识别,因此在测定免疫鼠血清效价前,需对Cry2A兔多抗血清的包被浓度进行优化。优化试验结果(图2)表明,包被原在100倍到2500倍稀释范围内,鼠阴性血清的吸光值从1.70左右的高背景值,快速下降为0.37,从1.25×104倍到1.50x106稀释范围内,吸光值趋于平衡维持在本底水平(0.30以下)。而1.25×104倍稀释的免疫鼠血清可以产生3.00以上的吸光值。在保证阴性鼠血清低背景和免疫鼠血清高信号值以及稀释操作简便性的综合考虑下,最终选择1x104倍稀释的Cry2A兔多抗血清作为优化的包被原浓度,测定免疫鼠血清效价。
在优化的包被原工作浓度下,以信号值大于背景值2.1倍计,3只免疫小鼠抗血清效价在1∶1.6x105到1∶6.4xl05倍之间(图2)。图3显示1号免疫鼠血清在250倍到16000倍稀释范围内,可对Cry2A兔多抗和Cry2A毒素的结合产生最高17.6%的抑制。而该浓度范围的阴性鼠血清对其结合没有抑制作用。说明l号免疫鼠血清中有部分组分能够替代Cry2A与兔多克隆抗体结合,为Ab2β型或Ab2γ型抗独特型抗体。因此,选用效价最高的l号小鼠取脾脏,提取总RNA用于Cry2A抗独特型单链抗体库的构建。
2.3 Cry2A抗独特型单链抗体库的构建
采用3片段法对单链抗体基因进行拼接(图4)。首先引物VHIBACK-Nco I和VK2BACK分别与VH和VK基因的N端恒定区互补,引物VHIFOR-2和VK4FOR-Not1分别与VH和VK基因的J片段互补,扩增小鼠的VH、VK基因,同时在VH的5端和VK的3端引入Nco I和NotI 2个酶切位点。另外合成与VH基因、VK基因具有重叠序列的linker片段,最后采用SOE-PCR法完成3个异源片段的连接,并克隆至pIT2載体。
VH、VK和linker基因的PCR扩增结果(图SA)显示,VH基因、VK基因分子大小在250 bp至500 bp之间,linker基因位于100bp偏下位置,符合预期分子大小。图SB显示pIT2载体通过Nco I和NotI双酶切,释放出735bp左右的能识别BSA的人源单链抗体基因片段。SOE-PCR反应条件优化结果(图SC)表明,在pfu PCR master mix体系下,scFv基因的扩增条带均较为模糊:在Taq PCR master mix体系下,采用1000倍稀释的第1步SOE-PCR产物作为模板,获得的800bp左右的目的片段最为明亮。最后选用Taq PCR master mix和1000倍稀释的第1步拼接产物作为模板,对scFv基因进行大量扩增,获得了较为清晰的800bp左右目的条带(图SD)。
scFv基因转入pIT2载体后,电转入感受态TG1,构建的抗体库库容为1.2x107。随机挑取了10个克隆测序,除了1个克隆存在终止密码子和1个克隆为模板序列外(人源BSA单链抗体基因),其余8条均可以翻译出不同的鼠scFv单链抗体基因。图6为1个从库中随机挑取的scFv克隆的DNA碱基序列及其编码的氨基酸序列,标注了酶切位点、引物、CDR区及linker位置。在Nco I和NotI 2个酶切位点间单链抗体基因共有702 bp,其中VH基因336 bp,VK基因321 bp,linker基因45 bp。
2.4 Cry2A抗独特型单链抗体库的多克隆噬菌体ELISA分析
Cry2A抗独特型单链抗体库经辅助噬菌体救援后,用多克隆噬菌体ELISA测定抗体库对Cry2A兔多克隆抗体的整体结合能力。结果(图7)显示,1x107CFU的噬菌体抗体对免疫原结合信号与背景的比值(S/B)为6.04,而未经筛选的半合成人源Tomlinson I库的S/B值为1.33。说明未经筛选的Cry2A抗独特型单链抗体库对免疫原具有较高的结合能力,下一步将用于Cry2A抗独特型单链抗体的筛选。
3 讨论
通常抗独特型抗体制备有2种方案。第1种方案是将整体抗体消化为5.Ox104左右的Fab片段后与载体蛋白连接用于动物免疫。这样可以避免整体抗体中的Fc段产生抗体,让抗独特型抗体的丰度提高。但是由于该方法需要对整体抗体进行酶切和纯化,Fab片段得率较低,对抗体的消耗量较大。消化后的抗体片段免疫原性也会减弱。酶解、纯化、载体蛋白偶联等步骤,也可能对抗体独特位的空间构象造成影响。第2种方案是直接将整体抗体作为免疫原用于抗独特型抗体制备。该方法的优点是较为简单,抗原需求量小,有利于独特位原始空间结构的维持,但也存在由于抗独特位较小,导致抗独特型抗体产生比例较低等问题。考虑到后续试验采用的是建立单链抗体库的形式来筛选抗独特型抗体,在筛选过程中可以采用阴性血清负筛选和抗原竞争性洗脱等方法来去除与Fc片段结合的噬菌体抗体的干扰,我们最终选用了整体抗体免疫的方案。从实际效果看,整体兔多克隆抗体免疫小鼠,最高效价在1∶6.4xl05左右,小鼠的免疫应答效果良好。而且通过免疫鼠血清对Cry2A毒素与其兔多克隆抗体的抑制试验分析发现,免疫鼠血清对Cry2A与兔多克隆抗体的结合最高可产生约17.6%的抑制,这证明了鼠血清中存在能模拟Cry2A特征结构的Ab2β和Ab2γ型抗独特型抗体的存在,且比例超过预期值。因此该小鼠的抗体基因可以用于下一步Cry2A抗独特型单链抗体库的构建。
单链抗体库的构建主要包括抗体重轻链可变区基因的扩增,载体构建和转化宿主菌等步骤。其中全套抗体重轻链可变区基因的扩增及拼接是抗体库构建的难点和主要限速步骤。本研究以小鼠作为免疫动物,构建鼠源免疫抗体库。小鼠轻链有K链和λ链2种类型,其中K链在成年个体中出现的频率占95%。因此大部分鼠源抗体库的构建只扩增VK基因。目前国际上已发表了多套用于小鼠抗体重轻链可变区扩增引物,本研究引物参考了Clarkson等和Olandi等的报道。用Kabat数据库比对成熟抗体VH和VK基因序列,发现成熟抗体的VH和VK基因的N端相对保守区,另外V和VK基因3端的J片段也较为保守区,本研究用于扩增全套抗体基因的引物正是依据这些区域设计。另外,本试验设计的scFv拼接为2步法,第1步SOE-PCR中,在没有引物加入的情况下将VH、VK和linker基因等摩尔混合进行循环扩增。在这一反应中VH基因通过lirtker与VK基因随机连接起来形成少量的scFv基因。接着将随机连接的scFv基因稀释后与引物VH的5 端引物和VK的3端引物混合,在Taq酶的作用下进行第2步SOE-PCR扩增。但是由于第1步SOE-PCR中随机产生的scFv基因难以定量,而PCR反应的模板浓度也是决定第2步SOE-PCR拼接效果的关键因素,因此对第1步SOE-PCR的产物稀释倍数进行了优化。试验中還同时考察了pfuPCR master mix和Taq PCR master mix体系对SOE-PCR拼接效果的影响。结果表明1000倍稀释的第1步拼接产物在Taq PCR master mix体系作用下产生的目的片段最为明亮。因此本试验最终选择了1 000倍稀释的第1步SOE-PCR产物用作第2步拼接的模板。
库容和多样性是评价抗体库质量的关键。从抗体库中随机挑取的10个克隆测序结果看,其中l条为模板序列,这可能是噬菌体载体pIT2酶切不完全导致的,由于该模板序列为识别BSA的单链抗体基因,在后期的库筛选中应注意避免使用BSA作为封闭蛋白而导致模板克隆的富集;另有一条序列在scFv基因中存在终止密码子。其余8条序列均可翻译为不同的鼠scFv序列,证明抗体库具有较好的多样性。另外,由于本试验构建的是鼠免疫抗体库,其抗体可变区基因高度倾向于能识别的免疫原抗体,因此免疫抗体库的库容无需达到天然抗体库的大库容水平(lxl08左右)即可筛选到高亲和力的目标抗体。有研究者报道lxl06左右的免疫抗体库即可成功筛选到目标抗体。因此本试验构建的库容为1.2x l07Cry2A抗独特型单链抗体库可以应用于后期的筛选。抗体库的多克隆噬菌体ELISA分析结果表明,未经筛选的Cry2A抗独特型单链抗体库对免疫原的结合信号大大高于未经筛选的天然抗体库,直接证明了Cry2A抗独特型单链抗体库的有效性。
本研究采用整体抗体免疫和噬菌体展示技术的路线,成功构建了库容为1.2×l07的鼠免疫Cry2A抗独特型单链抗体库,为Cry2A毒素的抗独特型单链抗体的筛选及无毒免疫检测试剂盒的研制奠定了基础。
