掺锶对磷酸锶钙骨支架体外细胞毒性的影响研究*
2018-09-08邝冠明李晓吴隽黄德民吕维加
邝冠明李晓吴隽黄德民,吕维加
(1.深圳市创伤骨科新技术重点实验室,香港大学深圳医院骨科,广东深圳 518053;2.香港大学矫形及创伤外科学系,香港 999077)
以磷酸钙盐(羟基磷灰石)为主要成分的骨水泥或骨支架材料,具有良好的生物相容性和骨传导性,在骨科和牙科作为骨替代物,获得了认可[1-3]。但是,这类材料缺乏骨诱导性,不能诱导周围组织成骨。因此,近年来研究者通过多种方法改良,使其获得骨诱导性。其中一种策略就是在材料中整合具有一定成骨能力的有机或无机因子。
通过化学或物理的方法,将具有一定成骨活性的金属离子,部分置换磷酸钙盐里的钙离子,以改善这类骨支架材料的成骨诱导活性。由于锶离子和钙离子处于元素周期表的同一族,因此,两种离子互相置换在化学上是可行的。另外,锶离子是人体的微量元素,具有独一无二的双重作用,不仅能增加成骨细胞相关的基因表达以及碱性磷酸酶活性,同时也能抑制破骨细胞的分化[4-6]。
目前,在磷酸钙材料中掺锶的方法主要有两大类:一种是通过高温结晶的方法,将锶离子掺入磷酸钙反应体系,生成掺锶的羟基磷灰石。这类方法制作出来的材料结晶度高,溶解度低,几乎不降解,锶离子释放有限[7];另外,这类掺锶材料常以块状,颗粒状成型。如果需要加工成可塑形的骨水泥材料,则要将其研磨成粉状,然后通过聚合反应来达到固化塑形的目的;但聚合反应有发热、释放有毒单体等不良反应[8]。另一种是通过类似传统磷酸钙骨水泥的水化/沉淀法,将有一定溶解度的锶盐(如氯化锶、碳酸氢锶、硫酸氢锶等)与磷酸盐混合,形成粉体相,然后再与液体相(水或者磷酸盐溶液等)混合,形成超饱和溶液,最终沉淀生成热力学最稳定状态的羟基磷灰石。由于锶离子和钙离子处于元素周期表的同一族,有相似的化学特性,在离子沉淀过程中,锶离子与钙离子会竞争位点,形成掺锶的羟基磷灰石该方法在常温下进行,但沉淀速度慢,固化时间长不能完全满足临床要求[9]。
既往研究[10]提示,在磷酸钙骨水泥体系中添加柠檬酸能加快骨水泥的固化反应,这是因为在反应过程中,柠檬酸的羧基能与钙离子或化学性质类似的二价金属离子螯合,形成螯合产物。因此,本研究将尝试在液体相中添加柠檬酸,在粉体相中添加锶盐通过离子螯合的方法,制备出不同锶/钙比例的磷酸锶钙骨支架。考虑到这种方法制备出来的骨支架的细胞毒性尚未明确,因此本研究将检测掺锶对磷酸锶钙骨支架体外细胞毒性的影响。
1 材料与方法
1.1 材料准备
骨支架原始反应物分为粉体相和液体相。其中液体相为20wt%的柠檬酸和12wt%的聚乙烯吡咯烷酮(PVP K-30)的混合液,溶液pH调整为4。粉体相有3种成分:磷酸四钙(tetracalcium phosphate,TTCP,Wako),无水磷酸二钙(dicalcium phosphate anhy⁃drous,DCPA,Alfa Aesar)和磷酸氢锶(strontium hydro⁃gen phosphate,DSPA,Sigma)。本研究按锶/(锶+钙)[Sr/(Sr+Ca)]离子摩尔百分比0、5%、10%和20%,分为4组:Sr-0组、Sr-5组、Sr-10组和Sr-20组。Sr-0组不含锶离子,粉体相仅包含磷酸四钙和无水磷酸二钙。在Sr-5组、Sr-10组和Sr-20组的粉体相中,用磷酸氢锶置换部分的无水磷酸二钙,使粉体相最终的锶/(锶+钙)离子摩尔百分比分别为5%、10%和20%。以2 g/ml的比例将粉体相和液体混合,粉体相的磷酸钙盐和磷酸锶盐溶解,释放出锶、钙离子和磷酸根离子,形成超饱和溶液,其中的锶、钙离子与柠檬酸根的羟基螯合。锶和钙离子处于元素周期表的同一族,可以竞争螯合位点,生成掺锶的螯合产物[10]。
1.2 细胞毒性实验
细胞毒性实验根据国际标准化组织ISO10993-12标准进行。细胞培养液的成分主要是在DMEM培养液的基础上添加10%的胎牛血清、100 U/L的青霉素和100 mg/ml的链霉素。首先制作浸提液。将标本按照0.1 g/ml的重量/体积百分比浸入细胞培养液里,然后在37℃,100%湿度,5%CO2的培养箱里孵育24 h。阳性对照为0.02%的苯酚磷酸盐缓冲溶液。阴性对照是纯钛合金的浸提液。细胞的成分为L929成纤维细胞。将1×104个L929细胞混悬在100 μl细胞培养液中,然后置入96孔细胞培养板的培养孔中,培养24 h后,弃上清,加入浸提液,然后继续培养24 h。用WST-1试剂盒计算细胞的相对生长率。
1.3 细胞增殖实验
细胞增殖实验使用类成骨细胞MG-63(ATCC)来进行。首先制作直径6 mm、厚度2 mm的骨支架标本,然后应用剂量25 kGy的铯-137对标本进行消毒(MDS Nordion Gammacell 3000 ElanⅡ)。将消毒后的标本放置于96孔板。将100 μl培养液的悬浮MG-63细胞(1×103)接种在96孔板上,然后在37℃和100%相对湿度,5%CO2条件下培养。培养液每天更换,培养1、3、7、14 d后,应用WST-1试剂盒来测定细胞的增殖率。
1.4 碱性磷酸酶活力
将直径12 mm、厚度2 mm的骨支架标本放置于24孔板内,将2×104个MG-63细胞稀释到1 ml的培养液中,然后种植在培养孔。培养1、3、7和14 d后,仔细移除培养液,用PBS冲洗标本,然后用200 μl的细胞裂解液裂解细胞。对细胞施加2个循环的冻结与解冻过程,充分裂解细胞。然后收集细胞裂解液,离心,取50 μl细胞悬液,转移到96孔板,与200 μl含对硝基苯磷酸盐(pNPP,Sigma)的反应液混合。待充分反应后,应用50 μl 3 N NaOH溶液终止反应。然后,使用分光光度仪(SpectraMax 340,Molecular Devices)在波长405区间测定碱性磷酸酶的活性。所测得的吸收值将和标准的吸收曲线相比较,并用总蛋白的量来标准化碱性磷酸酶的活性数。每组样本5个。
1.5 细胞形态学
含2×104个MG-63细胞的培养液1 ml滴加在直径12 mm、厚度2 mm的骨支架标本上,分别培养1 d和14 d后,去除上清,用PBS仔细清洗标本的表面,然后依次用50%、60%、70%、80%、90%及100%的梯度酒精脱水。脱水充分后在标本表面镀上20 nm厚的金,使用扫描电子显微镜(LEO 1530 FESEM,Oxford,UK)观察细胞在骨支架表面的形态及贴附情况。
1.6 统计学分析
采用SPSS 17.0进行统计分析。所获数据均以均数±标准差表述。应用one-way ANOVA对组间数据进行比较,如果差异有统计学意义,进一步应用Tukey's multiple comparison tests进行post hoc分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞毒性测试
所有组别100%细胞浸提液的相对细胞活力均超过阴性对照组的70%,提示所有浸提液均没有细胞毒性(图1)。
2.2 细胞增殖实验
培养1 d,细胞增殖的组间比较无显著性差异。培养3 d,Sr-10组和Sr-20组的细胞增殖率较Sr-0组高。培养7 d和14 d,细胞增殖率与培养3 d的结果相似。培养7 d,所有掺锶组OD值均比非掺锶组高,提示掺锶对细胞增殖有促进作用。但是,所有掺锶组的组间差异无统计学意义。培养14 d,Sr-10组和Sr-20组的细胞增殖率最高,而Sr-0组最低(图2)。
2.3 碱性磷酸酶活性
培养1 d,所有组的碱性磷酸酶活性水平相对较低。培养3 d,碱性磷酸酶活性均有明显提高。与Sr-0组比较,Sr-10组和Sr-20组碱性磷酸酶活性较高。培养7 d,碱性磷酸酶活性进一步增高,培养14 d,碱性磷酸酶活性水平较为平稳,甚至有轻微下降,与Sr-0组比较,Sr-10组和Sr-20组碱性磷酸酶活性较高(图3)。
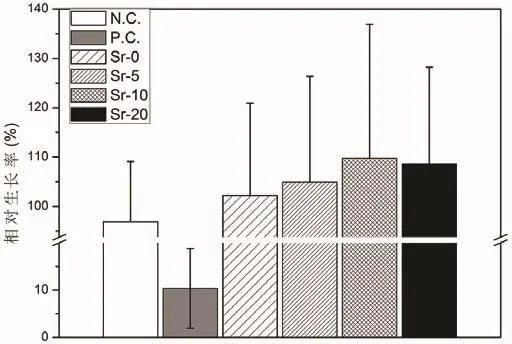
图1 细胞毒性测试的结果
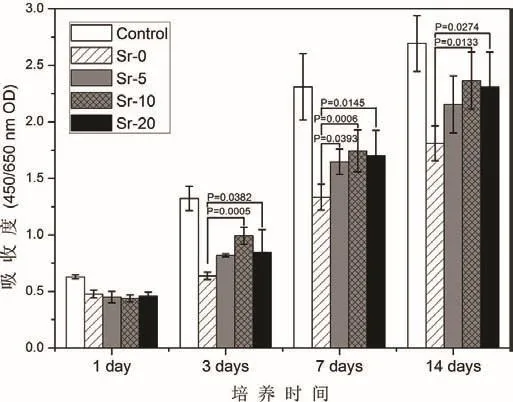
图2 细胞增殖实验的结果
2.4 细胞形态学
培养1 d,MG-63细胞在骨支架表面呈扁平状,通过较长的突触与骨支架表面连接(图4A,C,E,G)。培养14 d,所有标本的表面均被细胞覆盖,细胞间紧密接触(图4B,D,F,H)。培养1 d,细胞表面无明显的沉淀物,而培养14 d,细胞表面可见颗粒状的沉淀物。
3 讨论
临床上修复形状不规则的骨缺损,常需要一种可塑形的骨支架材料,以达到充分填充和全面修复的目的。以磷酸钙盐为主要成分的骨支架材料,可以利用其类似传统骨水泥固化反应过程中的可塑形期来达到充分填充的目的。通过将液体和粉体按一定比例混合,数分钟内反应物即可形成可塑形的糊状物,然后填充在缺损部位,最后固化成型,形成支架材料。磷酸钙盐支架材料因其成分与骨的无机成分类似,因此具有良好的生物相容性和骨传导性以及生物安全性。但是,该类材料不具有骨诱导能力,无法促进骨缺损在合理的时间愈合,延缓了患者的康复。
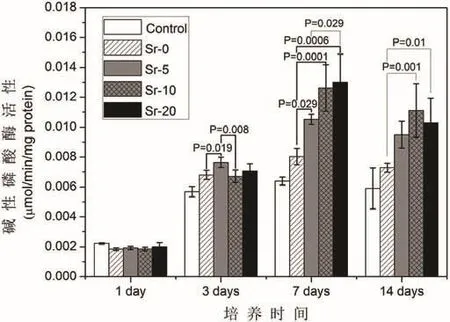
图3 碱性磷酸酶的实验结果

图4 细胞贴附实验结果
为了提高骨支架材料的骨诱导能力,目前主要有两大研究策略:一是通过优化支架材料的表面特性和内部空间孔隙结构,以此改善支架材料的骨传导性,利于骨组织在支架材料的表面贴附和内部长入;另一策略就是在材料内部整合具有一定生物活性的因子,通过活性因子的局部释放,诱导材料周围骨组织生长,从而使支架材料获得一定的骨诱导性。目前已经报道的成骨活性因子包括骨形态发生蛋白2(BMP-2),血管内皮生长因子(VEGF)等[11-13]。但是这些生长因子主要成分是蛋白质,在材料反应的过程中有可能被局部的化学环境灭活。另外,这些蛋白质在体内有一定的半衰期,降解后将无法持续发挥作用。近年来,具有生物活性的金属离子受到越来越多的关注。既往研究指出,锶离子对骨骼系统有双效的作用:促进成骨和抑制破骨作用。体外细胞实验[14-16]证明,锶离子能增加成骨细胞标志物,如碱性磷酸酶、骨形态发生蛋白、骨钙蛋白等的分泌,提示了锶离子对骨代谢的正性作用。另外,锶离子可以抑制碳酸酐酶Ⅱ玻璃粘连蛋白受体的分泌,抑制破骨细胞的分化,降低破骨细胞的骨吸收活性[4,5,14]。动物实验[17-19]结果显示,锶离子能刺激正常大鼠、骨质疏松大鼠模型和骨质疏松山羊模型的骨小梁和新骨生成,以及通过抑制骨吸收的机制来防止大鼠骨丢失,且不影响大鼠骨的生成。由于磷酸钙盐本身与骨的无机成分接近,可参与骨组织的钙磷代谢,且磷酸钙盐可与锶离子构建金属离子的螯合体系[20],实现锶离子的局部释放,从而诱导支架材料周围的新骨生成,促进缺损部位的骨修复。因此,本研究以磷酸钙盐为基础,用锶离子置换部分钙离子,制备掺锶的骨支架材料。
本研究在液体相添加了具有羧基的柠檬酸,通过柠檬酸的羧基与钙锶离子进行螯合反应。由于锶离子和钙离子位于元素周期表的同一族,化学特性类似,因此在螯合过程中锶和钙能竞争螯合位点,生成掺锶的螯合产物。另外,本研究也在掺锶的反应体系中使用PVP K-30,这是一种具有良好生物相容性的生物胶体,用于改善反应体系的黏稠度[21,22]。因此,本研究具有一定的创新和先进性。
本研究证实了添加不同剂量的锶离子后,所有标本均没有细胞毒性。在细胞贴附实验中,在电子显微镜上可观察到细胞开始以较长的突触贴附在支架材料表面。在细胞增殖和碱性磷酸酶活性实验中,可以观察到细胞在材料表面增殖,并分泌碱性磷酸酶。细胞增殖的数量也随培养时间的增加而逐渐增加。掺锶组细胞增殖更好,这结果与其他研究[14,23]结果相似。培养14 d,细胞增殖达最高水平,但此时各组碱性磷酸酶水平较为平稳,没有进一步增加,甚至个别组出现较上个时间点降低的现象。根据St-Pierre等[24]和Kim等[25]的研究结果,细胞的增殖伴随碱性磷酸酶活性的降低,提示成骨细胞矿化过程的开始。这一点在本研究细胞表面贴附的形貌学观察中得到了进一步的支持。培养14 d,细胞表面有大量的颗粒结节状沉淀物,提示细胞的早期矿化,与既往一个研究小组的观点相呼应[26]。他们认为,评估生物材料的表面活性不能仅观察材料表面是否有羟基磷灰石的生成,因为这仅是材料表面的钙和磷离子过度饱而形成的沉淀,不能反映材料表面对细胞增殖或细胞成骨活性的生物学影响。而更值得观察的是,成骨性细胞在材料表面的增殖活性及矿化能力。因此,评估材料表面的生物活性,不仅需要评估细胞在材料表面增殖,而且需要评估细胞能否在材料表面获得矿化。
综上所述,本研究结果表明,添加了锶离子的骨支架材料没有细胞毒性,而骨支架材料具有更好的表面活性,体现在掺锶组有更好的细胞增殖活性,并且细胞表面可观察到早期的矿化。
