神经导航与术中磁共振辅助手术治疗岛叶高级别胶质瘤的预后比较
2018-09-07马晓东
朱 巍,崔 萌,张 猛,马晓东
解放军总医院 神经外科,北京 100853
岛叶位置深在,完全被额叶、颞叶及顶叶覆盖,周围毗邻大脑中动脉、基底核等重要血管神经结构[1]。由于岛叶独特的种系发生关系,岛叶胶质瘤中以低级别胶质瘤为主,高级别胶质瘤较少见,约占颅内高级别胶质瘤的10%[2]。由于岛叶部位深在且与周围血管神经关系密切,使得岛叶高级别胶质瘤的治疗颇为困难[3]。本文回顾性分析了于我院就诊的56例岛叶高级别胶质瘤患者的不同手术方式的治疗效果及预后,总结报道如下。
资料和方法
1 资料 2013年1月- 2016年12月于我院就诊病理证实为WHOⅢ~Ⅳ级的高级别胶质瘤患者56例,纳入标准:1)影像学示肿瘤主体累及岛叶;2)术后组织病理证实为WHOⅢ~Ⅳ级胶质瘤;3)临床资料齐全,包括术前临床表现、影像学资料、术后病理、治疗措施等。
2 方法 根据手术方式分为神经导航辅助手术组(n=16)和术中磁共振辅助手术组(n=40),本研究所有病例的手术方式均为经翼点入路,经皮质造瘘或分离外侧裂后,从中心逐步分离切除肿瘤。高级别胶质瘤的术后辅助治疗方案采用标准的Stupp方案,既术后同步放化疗+ 5/23周期性替莫唑胺化疗。两组肿瘤切除程度(extent of resection,EOR)通过术后3个月复查时的核磁影像与术前影像对比确定,分为完全切除、部分切除两类。比较两组间无进展生存期和总体生存期,无进展生存期(progression-free survival,PFS)定义为接受手术到患者复发的时间;总体生存期(overall survival,OS)定义为接受手术到患者死亡的时间。
3 影像学检查及随访 患者均在我院行磁共振检查,包括术前以及术后每3个月随访影像资料,每3个月在我院胶质瘤门诊对患者进行随访,包括影像学分析及身体状况检查。
4 统计学处理 采用SPSS20.0统计软件,计量资料以±s表示,组间比较采用t检验;计数资料以例数、百分数表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier法、Log-rank法检验,有统计学意义的因素行COX比例风险模型分析,探讨这些因素对患者生存时间的影响,P<0.05为差异有统计学意义。
结 果
1 两组一般资料比较 导航组男性9例(56.3%),女性7例(42.7%),平均年龄(47.0±5.3)岁;磁共振辅助组男性29例(72.5%),女性11例(27.5%),平均年龄(51.0±7.1)岁;组间性别与年龄差异无统计学意义。导航组WHOⅢ级胶质瘤7例,Ⅳ级胶质瘤9例,磁共振辅助组WHOⅢ级胶质瘤25例,Ⅳ级胶质瘤15例;两组间各型组织病理无统计学差异。两组间术前肿瘤侧别、肿瘤最大径及术前患者KPS评分均无统计学差异。见表1。
2 两组手术效果比较 术后核磁影像证实导航组全切10例(62.5%),磁共振组37例(92.5%),两组间差异有统计学意义(P=0.001)。无手术死亡病例。术后56例患者均行同步放、化疗加周期性替莫唑胺(temozolomide,TMZ)化疗。对于完成同步放化疗及6周期替莫唑胺周期性化疗的患者,若在随访时影像证实无肿瘤复发,且患者自身对替莫唑胺有较好的耐受性,推荐长周期替莫唑胺化疗。见表1。
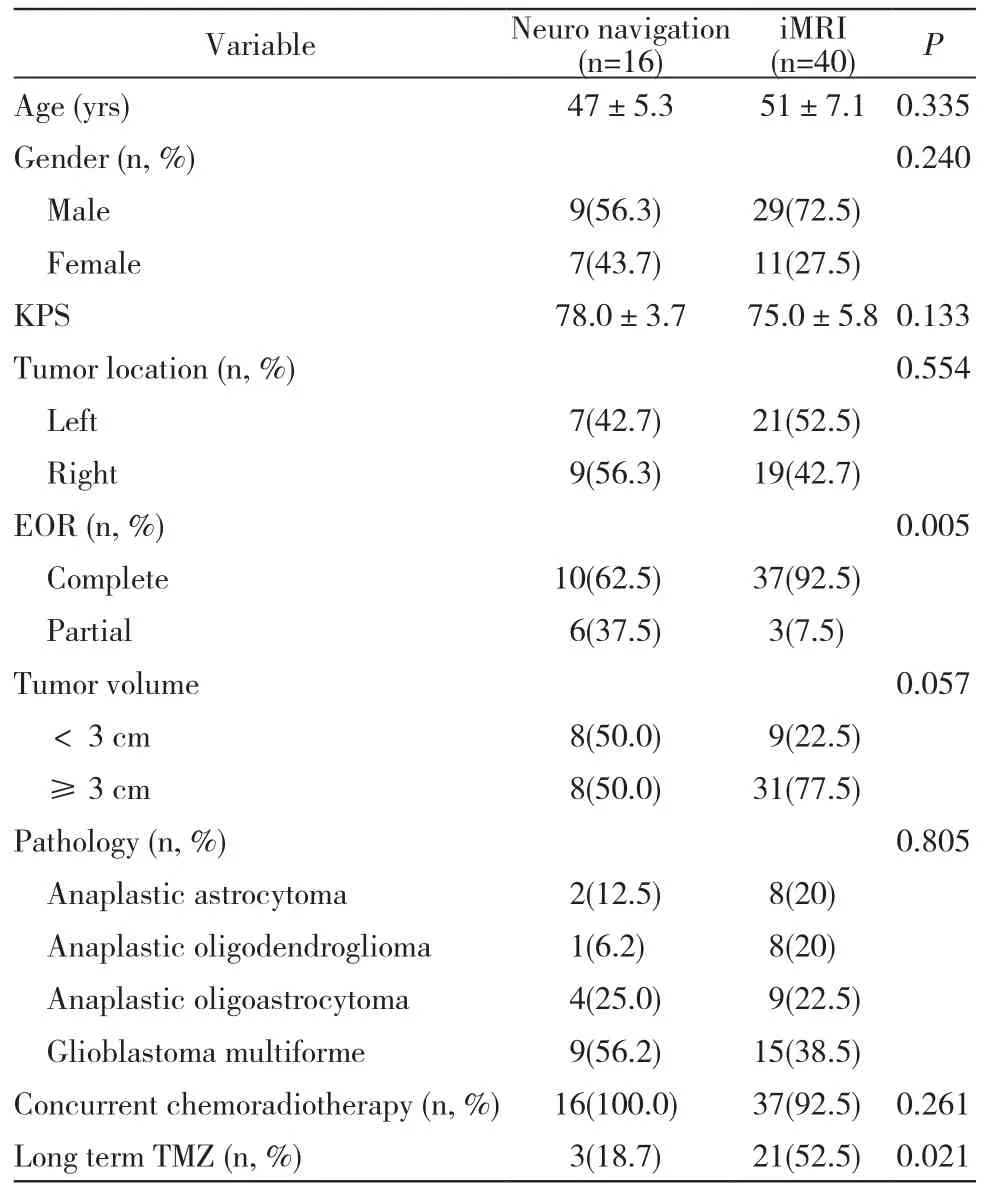
表1 岛叶高级别胶质瘤患者两种辅助手术方式临床资料比较Tab. 1 Demographic and characteristics of insular highgrade glioma patients

表2 岛叶高级别胶质瘤患者预后因素的COX回归分析Tab. 2 COX regression analysis for prognostic factor of insular high-grade gliomas
3 两组生存结果比较 患者术后随访12 ~ 54个月,平均随访28个月。生存分析显示,术中磁共振辅助组患者较神经导航辅助组患者具有更长的PFS(39.4个月vs 28.5个月;P=0.049)和OS(43.0个月vs 31.0个月;P=0.026)。见图1。
4 两组患者COX回归分析结果 两组间肿瘤患者的手术方式、切除程度和是否应用长周期化疗方案为影响患者总生存时间的独立影响因素(P均<0.05)。见表2。
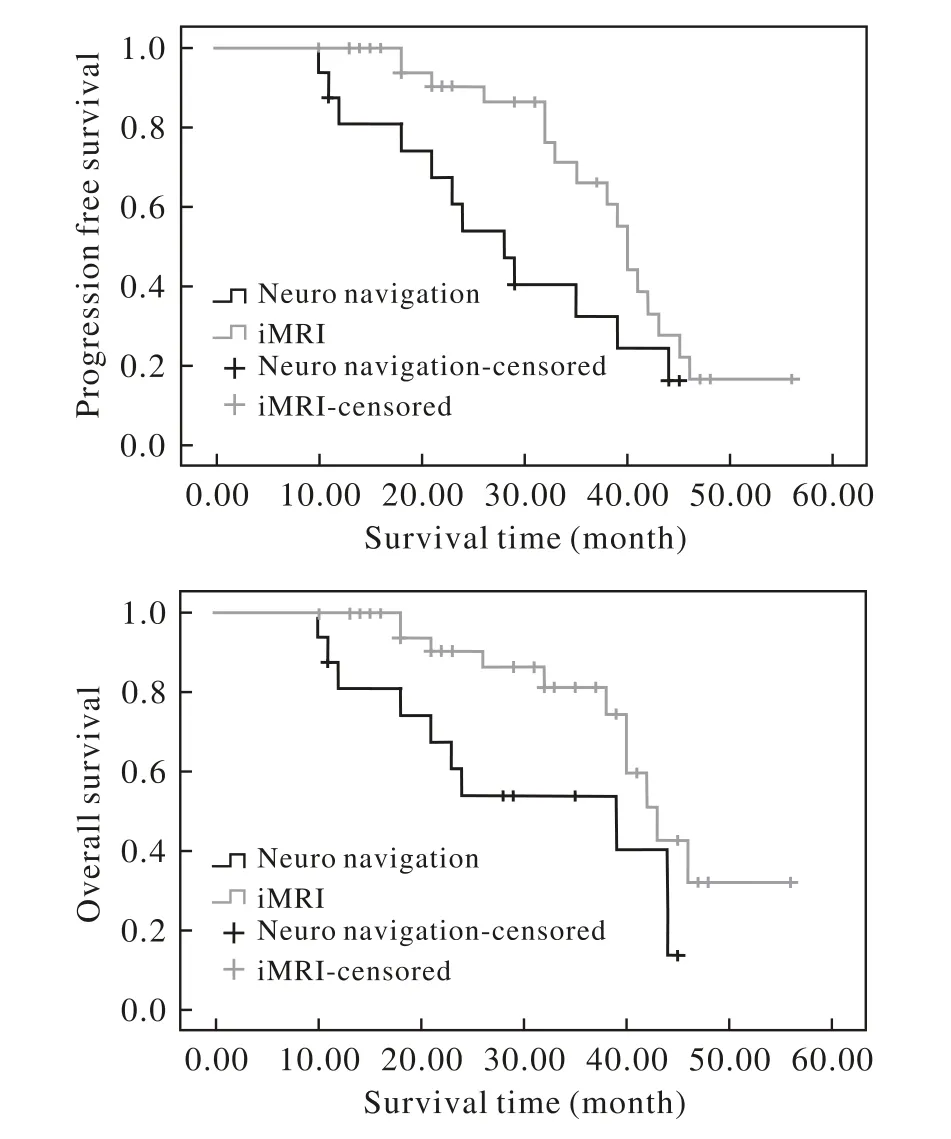
图1 两组胶质瘤患者的无进展生存期(PFS)和总生存期(OS)比较Fig. 1 PFS and OS of insular high-grade glioma patients between two different groups
讨 论
岛叶属于旁边缘系统,是连接边缘系统与大脑半球的重要部分[4]。岛叶位于额、颞、顶叶形成的岛盖下方,外侧裂深部,不仅与大脑中动脉主干及其各级分支、锥体束等重要结构毗邻,还与运动区、语言区等脑功能区关系密切[5-6]。Duffau和Capelle[7]研究报道侵及岛叶的胶质瘤分别占颅内低级别胶质瘤的25%和高级别胶质瘤的10%,尽管岛叶起源胶质瘤有以低级别胶质瘤为主的倾向[8-9],但是由于高级别胶质瘤的侵袭性更强,恶性程度高,浸润破坏岛叶周围的内囊、基底核及其相应的白质纤维束,术前即可造成严重的神经功能缺陷;加之岛叶的位置特殊,使得岛叶高级别胶质瘤的外科治疗更加困难[10-11]。
近年来术中磁共振、电生理检测、术中唤醒等技术的应用,为神经外科医生在最大限度切除胶质瘤的同时保护神经功能提供了可靠的技术支持。术中磁共振技术对岛叶胶质瘤的切除作用明显,术后可以实现实时对肿瘤切除程度及重要毗邻结构的判断,指导医师安全切除肿瘤。本研究56例岛叶高级别胶质瘤患者中40例于术中磁共振辅助下完成手术,全切率达92.5%,明显优于应用神经导航技术辅助组的62.5%全切率。
对于任何高级别胶质瘤,手术治疗是最重要也是最基本的治疗手段,也是关系胶质瘤患者预后的重要因素[12]。经皮质造瘘和经侧裂入路都是岛叶肿瘤切除的经典术式,应根据术者经验及肿瘤部位大小等因素个体化选择。术中须特别注意对大脑中动脉及其分支的保护,大脑中动脉M1段及标志肿瘤切除内侧界的豆纹动脉位于岛叶前下部深面,大脑中动脉M2段及细小的穿支分布于岛叶的侧面,这些血管及分支供应内囊、放射冠等结构,术中损伤常导致术后偏瘫等神经功能障碍的出现[13-14]。
目前WHOⅢ~Ⅳ级的高级别胶质瘤患者建议术后进行同步放化疗及周期性替莫唑胺化疗的Stupp方案,该方案一经提出就成为了胶质母细胞瘤、间变性星形细胞瘤等高级别胶质瘤的标准放化疗方案。对于肿瘤全切的患者或为了保护神经功能而肿瘤部分切除的患者,均行Stupp方案治疗。对于对替莫唑胺耐受较好的高级别肿瘤患者,建议继续周期性服用TMZ进行长周期TMZ化疗。国外Khasraw等[15]及Barbagarllo等[16]分别报道了GBM患者服用98个周期和101个周期的TMZ长周期治疗结果。国内徐维林等[17]报道TMZ>6周期可以提高高级别胶质瘤患者PFS和OS。本研究中核磁组共21例行长周期TMZ化疗,神经导航组共3例行长周期TMZ化疗,两组差异有统计学意义,这也可能是核磁组患者PFS和OS较导航组更长的原因。
本研究中,对于岛叶高级别胶质瘤患者,术中核磁辅助手术组较神经导航辅助手术组具有更长的PFS(39.4个月vs 28.5个月)和OS(43.0个月vs 31.0个月),两组有统计学差异。Sanai等[12]报道的45例岛叶高级别胶质瘤肿瘤切除率在90%以上者2年总生存率为91%。本研究的生存分析结果显示术中磁共振技术的应用可以提高岛叶肿瘤的全切率,从而改善患者的预后。iMRI应用的优势主要在两个方面:首先可以术中实时进行影像扫描指导肿瘤切除的边界;其次可以修正神经导航易出现脑漂移的缺陷,保护重要神经结构[18]。关于岛叶高级别胶质瘤预后的病例资料有限,本研究病例数量及随访时间仍需继续完善。
综上,由于岛叶高级别胶质瘤侵袭性强、恶性程度高、位置深在等特点,临床上建议进行手术为主、术后放化疗为辅助的综合治疗。随着术中磁共振设备技术的临床应用,术中磁共振辅助手术治疗岛叶高级别胶质瘤效果更佳,可以使患者获得较好的预后。
