角蛋白降解菌Keratinibaculum paraultunense对废弃羽毛的发酵特性研究
2018-09-07廖学品
羊 希,李 霞,余 康,廖学品,2,3*,石 碧,2,3
(1.四川大学 轻纺与食品学院,四川 成都 610065;2.四川大学 皮革化学与工程教育部重点实验室,四川 成都 610065;3.四川大学 制革清洁技术国家工程实验室,四川成都 610065)
羽毛是一种丰富的可再生生物质资源。据报道,中国的家禽加工厂每年大约产生几百万t的羽毛副产物[1]。羽毛中含有大量的蛋白质,其中角蛋白是广泛存在于羽毛中的一种硬性蛋白,该蛋白富含色氨酸、谷氨酸、甘氨酸、异亮氨酸、甲硫氨酸和半胱氨酸等[2],营养十分丰富。然而,目前羽毛资源并未得到合理有效的利用,大部分作为废弃物,不仅浪费资源,而且有可能造成环境污染。
传统的物理、化学方法降解羽毛会破坏角蛋白中一些必需氨基酸,如甲硫氨酸、赖氨酸和色氨酸等,这类方法不仅生产成本高,而且还会带来一系列环境污染问题[3]。相对而言,生物降解废弃羽毛更加绿色环保。但羽毛的组成结构特殊,主要由α-角蛋白(α-螺旋)或β-角蛋白(β-折叠)中的多肽链紧密堆积而成,其内部的半胱氨酸二硫键可作为连接桥形成复杂的交联网[4]。因此,羽毛难以被木瓜蛋白酶、中性蛋白酶、碱性蛋白酶等常见的蛋白酶所降解[5]。有研究报道,利用微生物降解羽毛后可以增强羽毛的消化率和可溶性,提高羽毛的利用价值[6]。自然界中可以降解羽毛角蛋白的微生物较多,主要包括细菌类的芽孢杆菌属(Bacillussp.)[7-8]、真菌类的曲霉属(Aspergillussp.)[9]、放线菌的链霉菌属(Streptomycessp.)[10]。但是采用微生物降解羽毛通常会面临蛋白酶酶活低和降解羽毛时间长等问题,使得羽毛的利用程度较低,不能得到有效地资源化应用。因此,需要寻找和开发能高效降解羽毛废弃物的降解菌。
目前,我国对羽毛降解的研究基本停留在角蛋白酶菌的分离、筛选及角蛋白酶作用机制的初步研究上,而角蛋白酶具有广阔的应用前景使得角蛋白酶倍受关注。利用羽毛角蛋白酶降解羽毛转化为可溶性蛋白、多肽和氨基酸来丰富饲料的营养[11];角蛋白酶应用于皮革脱毛[12-13];洗涤剂工业中添加角蛋白酶[14],达到快速清除血迹的作用;利用角蛋白酶降解羽毛,将有机氮输入农业土壤作为重要化肥原料等[15]。
Keratinibaculum paraultunens是从养鸡场附近土壤中分离得到的一株厌氧细菌,具有高效降解角蛋白的能力,可有效打破好氧细菌降解角蛋白时溶解氧的局限。本研究利用角蛋白降解菌K.paraultunense发酵鸡羽毛,考察了菌株对羽轴、羽枝和羽片的降解特性;探究了不同培养基对该菌发酵产物的影响;此外,还研究了在羽毛底物不同添加量的情况下该菌的发酵性能。为进一步掌握K.paraultunense对鸡羽毛的降解特性及产角蛋白酶、可溶性蛋白特性,以及鸡羽毛的综合利用提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
角蛋白降解菌株Keratinibaculum paraultunense:绵阳禾本生物工程有限公司。
1.1.2 鸡毛
在当地大型家禽屠宰场收集鸡毛,经过洗涤剂清洗,自来水反复冲洗后121℃灭菌30 min,80℃烘干至恒质量后,将羽片(the whole feather,C)分为羽轴(feather rachis,A)和羽枝(feather barblues,B)(见图1),将三者分别用切割研磨机进行粉碎并过25目筛子,密封保存备用。

图1 羽毛的构成部分Fig.1 Composition of feathers
1.1.3 化学试剂
氯化钠、磷酸二氢钾、磷酸氢二钾、尿素(均为分析纯):成都金山化学试剂有限公司;硫酸镁(分析纯)、L-半胱氨酸盐酸盐(分析纯):成都市科龙化工试剂厂;茚三酮(分析纯)、考马斯亮蓝(分析纯):成都市科隆化学品有限公司;牛血清蛋白(纯度≥98%):上海伯奥生物科技有限公司。
1.1.4 培养基
全培养基(I)、无机盐培养基(II)和纯水培养基(III)的组分浓度如表1所示,初始pH值为8.0,培养基分装到厌氧瓶,厌氧瓶装液量为100 mL/250 mL。121℃灭菌30 min。
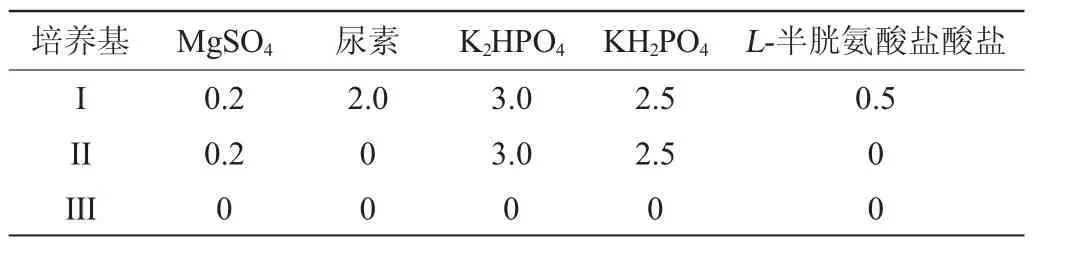
表1 实验所用发酵培养基配方Table 1 Formula of fermentation medium used in the research g/L
1.2 仪器与设备
SM100切割研磨机:德国莱驰公司;UV-1800PC紫外可见分光光度计:上海美谱达仪器有限公司;SW-CJ-2F型双人双面净化工作台:苏州净化设备有限公司;A300型自动氨基酸分析仪:德国MembraPure GmbH公司;HYQX-II厌氧培养箱、HH·B11-BS-II电热恒温培养箱:上海跃进医疗器械有限公司。
1.3 方法
1.3.1 角蛋白降解菌发酵废弃羽毛
将活化好的角蛋白降解菌以1%的接种量接入含有1%羽片的全培养基中,通过预实验确定较佳的pH值为8.0,温度为55℃,厌氧培养72 h,在此条件下进行发酵并观察羽片的降解过程。
1.3.2 羽片降解特性分析
将粉碎后的羽轴、羽枝和羽片分别加入1%于全培养基中,活化好的菌液添加量为1%,55℃培养72 h,每间隔12 h取适量的发酵液,并将其离心(12 000 r/min、10 min),取上清液,分别测定其游离氨基酸总量、角蛋白酶的酶活力、pH和可溶性蛋白含量,并分析发酵过程中羽毛降解率的变化。
(1)游离氨基酸的测定
取适量的发酵液离心,将上清液与10%的磺基水杨酸按4∶1混合均匀,经0.22 μm微孔膜过滤后,将过滤液放置于4℃的冰箱冷藏1 h,离心取上清液,用样品稀释液稀释适当倍数,最后由0.22μm过滤器再次过滤后上氨基酸分析仪进行测定[16]。
(2)角蛋白酶酶活的测定
按照文献[17]方法略有改进:以酪蛋白为底物,实验组取1.5 mL酪蛋白底物(10.0 g/L,pH 7.5)于离心管中,加入1.0 mL粗酶液(发酵液经8 000 r/min离心5 min,上清液即为粗酶液),80℃条件下恒温水浴反应10 min,加10%三氯乙酸1.0 mL终止反应;对照组取1.0 mL粗酶液于试管中,加入1.0mL10%三氯乙酸,80℃条件下恒温水浴反应10min,反应终止时加1.5mL酪蛋白底物。将反应产物于12000r/min条件下离心10min,取上清液测定其波长280nm处的吸光度值。
角蛋白酶酶活定义:在pH值为7.5,温度为80℃的条件下,每1.0 mL酶液反应10 min后,A280nm每增加0.01为一个酶活单位(U/mL)。
(3)可溶性蛋白含量的测定
采用考马斯亮蓝G-250染色法测定发酵过程中可溶性蛋白的含量[18],以牛血清蛋白为标准蛋白制作标准曲线:准确配制0.01 mg/mL、0.02 mg/mL、0.03 mg/mL、0.04 mg/mL、0.05 mg/mL、0.06 mg/mL、0.08 mg/mL、0.1 mg/mL的牛血清蛋白标准溶液,将5 mL考马斯亮蓝G-250染液与上述牛血清蛋白标准溶液充分混合,室温下反应5 min后,测定其在波长595nm处的吸光度值,每组做三个平行实验。以牛血清蛋白质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制出牛血清蛋白标准曲线。得到标准曲线回归方程y=6.7960x+0.0119 5(相关系数R2为0.998),根据回归方程,计算样品中可溶性蛋白含量。
(4)羽毛降解率的计算
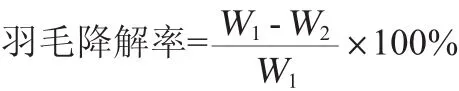
式中:W1为发酵前添加的干羽毛质量,g;W2为发酵后未降解羽毛干燥至恒质量的残渣质量,g。
1.3.3 不同培养基对羽片降解过程的影响
将10 g/L粉碎的羽片分别加入全培养基、无机盐培养基和纯水培养基中,55℃培养72 h,每间隔12 h取发酵液离心,测定上清液中游离氨基酸总量、酶活、pH和可溶性蛋白含量,并分析发酵过程中羽片降解率的变化。
1.3.4 羽片添加量对角蛋白降解菌发酵性能的影响
将活化好的角蛋白降解菌以5%的接种量分别加入含有10 g/L、50 g/L、100 g/L、150 g/L和200 g/L羽片底物的全培养基中,于55℃条件下培养48 h,测定各发酵液的角蛋白酶酶活和可溶性蛋白含量,以考察羽片底物的添加量对角蛋白降解菌发酵性能的影响。
此外,选取含有100 g/L羽片的全培养基为研究对象,接入5%活化好的角蛋白降解菌,于55℃培养84 h,从24 h开始,每12 h取10 mL发酵液离心,测定上清液中角蛋白酶酶活和可溶性蛋白含量。
1.3.5 数据统计与分析
每组实验重复操作3次,采用SSPS 18软件进行数据分析,使用Origin Pro 8.5绘图,实验结果以“平均值±标准差”表示,显著性差异P<0.05。
2 结果与分析
2.1 角蛋白降解菌对羽片的降解
羽片添加量为10 g/L,活化好的角蛋白降解菌接种量为1%,培养基为表1中的I号培养基,发酵条件如1.3.1所述。角蛋白降解菌对羽片的降解过程如图2所示。
由图2可知,一根完整的羽片在发酵24 h后,羽枝被完全降解,而羽轴经过48 h才被降解完全,可见,羽轴的降解要比羽枝难一些,主要是因为羽枝和羽轴的本身的化学特性存在一定的差异,而且羽轴的比表面积较羽枝小,因此与角蛋白降解菌的接触面积更少,从而增大了降解的难度[19]。

图2 Keratinibaculum paraultunense在全培养基中降解羽片的过程Fig.2 Degradation process of pinna byKeratinibaculum paraultunensein the whole medium
2.2 羽毛不同部位的降解特性
TESFAYE T等[20]对羽轴和羽枝的形态结构和物理性质进行研究,发现羽轴和羽枝属于一种蛋白纤维,具有低密度、高柔韧和中空蜂窝结构等特性。将培养基中的羽毛底物设置为羽轴、羽枝和羽片,这三者的添加量均为10g/L,活化好的角蛋白降解菌接种量为1%,培养基为表1中I号培养基,发酵条件如1.3.2所述,对羽毛不同部位的降解特性进行研究,结果如图3所示。羽轴、羽枝和羽片在被K.paraultunense降解时的降解率随时间的变化如图3a所示。由图3a可知,菌株在全培养基中对三者的降解率,羽轴、羽枝和羽片在24 h时就可达到95%,而三者在36 h羽毛的降解率达到98%,与未粉碎的羽片(见图2,36 h时还残留较多的羽轴)相比,发酵效率明显提高。可见,将羽片进行粉碎后,可以在一定的程度上加速羽片的降解,同时,粉碎羽片后,可以减小羽轴和羽枝在降解率上的差距。
角蛋白酶的酶活随时间的变化结果如图3b所示。由图3b可知,从整体上看,发酵过程中角蛋白酶的酶活均呈现先升高后降低的趋势,0~12 h角蛋白酶酶活升高缓慢,这可能是此阶段的角蛋白降解菌处于适应期,从而使得菌株产角蛋白酶较少;在48h时,该菌发酵羽轴、羽枝和羽片所产的角蛋白酶的酶活均达到最高,分别为羽轴5174U/mL、羽枝6 776U/mL和羽片5456U/mL。可见,该菌株不仅对羽片降解率高,所产的角蛋白酶的酶活也可达到较高的水平,是一种能高效降解羽片的微生物[21]。
由图3c和3d可知,可溶性蛋白含量和游离氨基酸含量随着发酵时间增加在不断积累,在24 h时,含量已达到最大,随着发酵过程的进行,24 h至48 h可溶性蛋白含量基本维持一个稳定值,48 h后可溶性蛋白含量开始逐渐下降,而游离氨基酸总量在24 h后逐渐下降。这可能是因为菌株在24 h时羽片的降解率接近95%,羽片基本被降解完全,而菌株为维持自身生长代谢需要消耗大量的可溶性蛋白和游离氨基酸,可溶性蛋白的分子量较游离氨基酸大,因此游离氨基酸更易、更快被菌体利用[22]。其中,羽轴在全培养基中产生的游离氨基酸总量最多,而产生的可溶性蛋白含量最低,这可能是由于在羽轴作为底物的培养基中,角蛋白降解菌进一步将可溶性蛋白转化为游离氨基酸。这表明,该菌在发酵羽轴和羽枝产可溶性蛋白和游离氨基酸上是有区别的,而从整体上看,粉碎后的羽片具备羽枝和羽轴的优点。实验结果表明羽片经过粉碎后,可有效解决羽轴较羽枝难降解这一问题,并且菌株可产生大量的可溶性蛋白和游离氨基酸。

图3 Keratinibaculum paraultunense在全培养基中对降解羽轴(A)、羽枝(B)和羽片(C)的影响Fig.3 Effect ofKeratinibaculum paraultunenseon the degradation of pinna rachis(A),barbs(B)and pinna(C)over time in the whole medium
2.3 不同培养基对羽片降解过程的影响
采用表1中的I、II和III三种培养基,选定羽片为发酵底物,活化好的角蛋白降解菌接种量为1%,其他发酵条件如1.3.3所述,研究了不同培养基对羽片降解过程的影响,结果如图4所示。由图4a可知,培养基I、II和III中的酶活大小有明显的差别。其中,III为纯水培养基,羽片是微生物发酵唯一的碳和氮来源,而整个培养阶段III中的酶活保持在50U/mL左右,这进一步表明该菌株是可以产生角蛋白酶的。但是,与I和II培养基相比,培养基III中的角蛋白酶的酶活是最低的,可见纯水培养基不利于该菌株产角蛋白酶。与培养基II相比,培养基I中K.paraultunense所产的角蛋白酶的酶活较高,且达到最高酶活时间比II所需时间少,在48 h时,培养基I中K.paraultunense所产的角蛋白酶的酶活可达到最大值5 449 U/mL,而II中前24 h酶活都非常低,这可能是因为培养基II中,只含无机盐和羽片,因此菌株生长迟缓,需要较长的时间适应外部环境。而培养基I中,除了培养基II所包含的成分外,还添加了L-半胱氨酸盐酸盐和尿素这两种有机氮源,可以促进这株厌氧型角蛋白降解菌快速生长,增强该菌产角蛋白酶的能力,从而提高该菌的发酵效率[25]。该菌株接种在培养基I、II和III的产酶能力的顺序是培养基I>II>III。
发酵过程中菌株所产的角蛋白酶的酶活会直接影响羽片降解率[26]。由图4b可知,自发酵开始至24 h,菌株在培养基I和II中羽片降解率不断增大,24 h以后基本降解,最终羽片降解率在98%左右。但前24h,培养基I中的羽片降解率比II中的高,很可能是菌株在培养基I中有可直接利用碳源和氮源,所以在培养基I中菌株降解羽片比培养基II更快。而在培养基III中菌株降解羽片的最终降解率非常低,在72 h,只有30%的羽片被降解,这表明这株厌氧菌能在纯水做培养基的条件下,产生酶和降解部分羽片,进一步验证了该菌株具备产角蛋白酶的能力。三种培养基中的羽片降解率由大到小依次为培养基I>II>III。
发酵过程中可溶性蛋白含量和游离氨基酸总量随发酵时间的延长而变化,结果见图4c和4d。由图4c和4d可知,培养基III中的游离氨基酸总量非常少,而I中的游离氨基酸总量在24h达到最大值1.06mg/mL,培养基II中的游离氨基酸总量在48 h达到峰值0.85 mg/mL。由表1可知,培养基II的成本明显低于I。值得注意的是,虽然培养基I中角蛋白酶的酶活和游离氨基酸的总量整体上要比培养基II中的高,但培养基II中可溶性蛋白达到的最大含量明显比I中高,在36 h时,培养基II中可溶性蛋白的含量高达0.93 mg/mL,而培养基I中最大可溶性蛋白含量是0.69 mg/mL。这可能是在培养基I中,主要以产角蛋白酶为主,其酶活较高,且培养基I中游离氨基酸含量较高;而在培养基II中,主要是以产可溶性蛋白为主,其可溶性蛋白含量高。可见,降解羽片的过程中,培养基的种类对该菌的发酵性能影响较大,全培养基更适合产角蛋白酶,而无机盐培养基更有利于得到高浓度的可溶性蛋白。
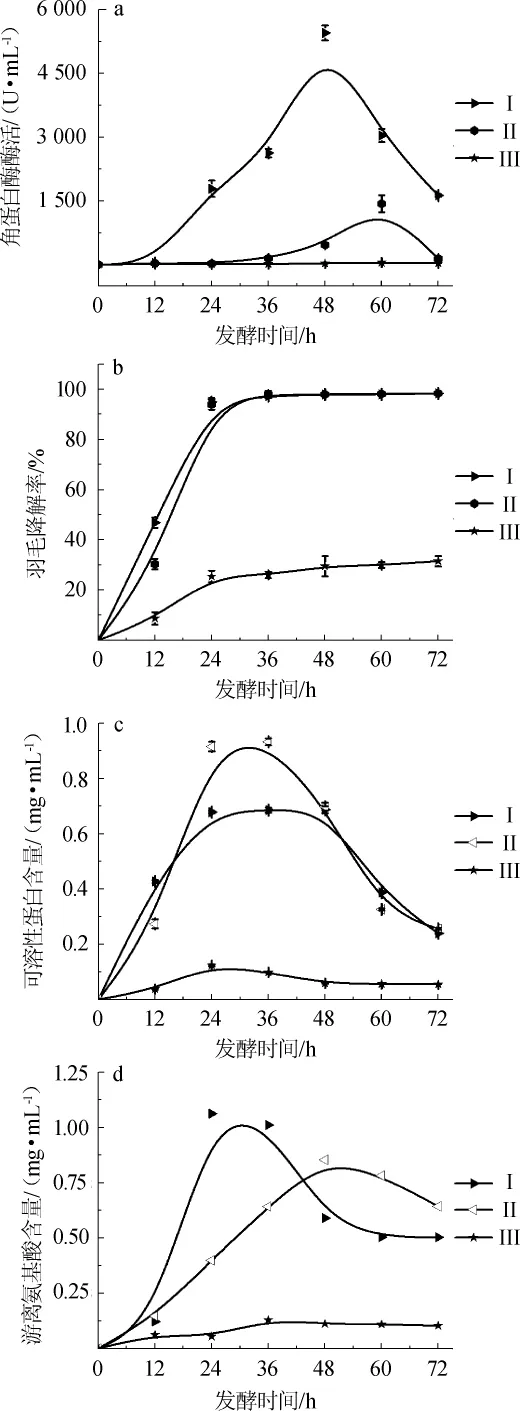
图4 在不同种类的培养基对废弃羽片降解过程的影响Fig.4 Effect of different medium on degradation process of waste feathers
2.4 羽片添加量对角蛋白降解菌发酵性能的影响
基于以上的研究,可以发现该菌株具有高效降解羽片的能力。因此本文考察了羽片底物的添加量对角蛋白降解菌发酵性能的影响。当羽片添加量为10 g/L,活化好的菌液添加量为1%,选择表1中的I号培养基,其他发酵条件如1.3.4所述,结果如图5所示。

图5 Keratinibaculum paraultunense在全培养基中发酵48 h时羽片添加量对角蛋白酶酶活和可溶性蛋白含量的影响Fig.5 Effect of feathers addition on keratinase activity and soluble protein contents byKeratinibaculum paraultunense fermented for 48 h in the whole medium
由图5可知,角蛋白酶的相对酶活力和可溶性蛋白含量随羽片底物质量浓度在0~200 g/L范围内的增加而先增大后降低。其中当羽片添加量为50 g/L,酶活达到最大,为11 520 U/mL;而当羽片添加量为100 g/L,可溶性蛋白含量达到最高为1.58 mg/mL。而当羽片底物添加量过高时,角蛋白酶的酶活和可溶性蛋白的含量反而降低。这可能是因为培养基中羽片浓度过高,会使得发酵液变得黏稠,影响微生物与营养物质之间的传质过程,从而影响角蛋白酶和可溶性蛋白的生成。
当羽片添加量为100 g/L时,角蛋白酶酶活和可溶性蛋白含量随发酵时间的变化如图6所示。

图6 Keratinibaculum paraultunense在全培养基中发酵84 h时角蛋白酶酶活和可溶性蛋白含量(a)及降解羽片的过程(b)Fig.6 Keratinase activity and soluble protein content(a),the degradation process of feathers(b)byKeratinibaculum paraultunensefermented for 84 h in the whole medium
由图6a可知,发酵48 h得到最大酶活为11 179 U/mL,而发酵36h得到最大可溶性蛋白含量为1.83mg/mL。与图4a和4b相比,发现羽片的添加量和菌种接种量提高到100 g/L和5%时,菌株所产角蛋白酶的酶活和产可溶性蛋白的浓度都提高了两倍左右。可见,该菌可以利用高浓度的羽片废弃物,并产生大量的可溶性蛋白和角蛋白酶。此外,不同发酵时间段的羽片降解情况如图6b所示。由图6b可知,即使在羽片浓度较高的条件下,该菌株仍然可以对其高效降解,这表明该菌株可以达到较大的发酵负荷。
3 结论
角蛋白降解菌(Keratinibaculum paraultunense)在厌氧条件下通过微生物发酵对废弃羽片的不同部位进行了降解分析,研究发现,羽轴比羽枝更难被降解,羽轴经粉碎后,降解效果较好。采用无机盐培养基发酵时,主要降解产物是可溶性蛋白,含量可达0.93 mg/mL。采用全培养基发酵时,主要发酵产物是角蛋白酶和游离氨基酸,当羽片底物量提高到100 g/L,角蛋白酶的酶活高达11 179 U/mL。角蛋白降解菌能快速高效地降解高浓度的废弃羽片,可生产大量的可溶性蛋白和高活力的角蛋白酶。本研究具有较好的应用前景。可溶性蛋白和游离氨基酸可丰富饲料营养,同时可溶性蛋白作为填充剂应用到皮革,能赋予皮革较好的柔软性和丰满性,而高活力的角蛋白酶可应用到皮革脱毛以及医药等行业。
