草甘膦对转基因抗草甘膦大豆的安全性研究
2018-09-07陈银竹刘胜男MuhammadShahidkhan
陈银竹, 丁 伟, 刘胜男, Muhammad Shahid khan,2
(1.东北农业大学农学院,黑龙江哈尔滨 150000; 2.白沙瓦农业大学,巴基斯坦白沙瓦 1599107)
近年来,基因工程技术发展势头迅猛,种植业中以转基因抗草甘膦大豆的发展最为迅速。而大豆为我国重要的粮食作物,杂草防除一直是大豆种植过程中的重点问题。化学除草是大豆田防除杂草的重要手段,近几年大豆田化学除草面积已达其播种面积的90%以上[1]。转基因抗草甘膦大豆的出现便为人们提供了一种能有效控制杂草的新途径,不仅大大降低了除草成本和劳动强度,并且有效延缓了大豆田抗性杂草的出现,除草剂药害的发生也明显降低,已成为美洲地区大豆田杂草防除的重要方法之一。草甘膦由美国孟山都公司研制开发,目前是世界上除草剂使用量最大的品种之一[2]。草甘膦通过抑制莽草酸途径中的5-烯醇式丙酮莽草酸-3- 磷酸合成酶(EPSPS),使微生物和植物不能合成生存必需的芳香族氨基酸而导致死亡[3-4]。其特点是杀草谱广、传导性好、残效低,在转基因抗草甘膦大豆整个生育期都可以使用。国内外普遍将草甘膦应用于茎叶处理,而对应用草甘膦进行种子处理的安全性和杂草防除效果鲜有研究。本试验通过草甘膦种子处理和茎叶处理研究草甘膦的安全性,为减少草甘膦的用量和我国当前自主研发的转基因抗草甘膦大豆的安全应用提供理论依据。
已有的研究表明,一定浓度的草甘膦会造成转基因大豆叶片的叶绿素含量降低、叶绿体结构变化和光合速率下降,叶绿素恢复过程需要2周左右,莽草酸含量几乎没有变化[5-11]。Bellaoui等研究表明,草甘膦会影响转基因抗草甘膦大豆的碳代谢和氮代谢[12]。种子用草甘膦溶液浸泡后播于土壤中,敏感的大豆种子浸泡4 h后不能发芽,而转基因种子均能顺利发芽生长[13-14]。草甘膦茎叶处理能有效控制杂草,但喷施超过推荐剂量1.23~2.46 kg a.i./hm2会降低成熟期的单株粒数和单株产量[15]。美国研究证明,在田间无草的条件下,抗草甘膦大豆平均减产5%~10%,但由于杂草防效提高,最终抗草甘膦大豆产量增加[16]。本研究通过对草甘膦种子处理和茎叶处理来研究转基因抗草甘膦大豆的安全性,期望降低草甘膦用量的同时获得理想的田间杂草防除效果,从而为草甘膦的合理应用及我国自主研发转基因大豆在生产中的安全应用提供基础数据。
1 材料与方法
1.1 试验材料与设计
供试大豆为转基因抗草甘膦大豆呼交06-698,供试除草剂为41%草甘膦异丙胺盐水剂(美国孟山都公司)。
试验于2015年于5—10月在东北农业大学转基因试验地进行。采用随机区组试验设计,41%草甘膦异丙胺盐水剂设4个处理水平,每个处理4次重复(表1)。茎叶处理在大豆第1张复叶完全展开后施药(此时为种子处理后33 d),出苗后按照常规方式进行田间管理,在茎叶处理后7、14、21、28 d(DAT)记录各处理内杂草数,同时取样测定大豆生理指标,连续4次取样完毕后对各处理内杂草进行称质量。

表1 草甘膦用量
1.2 测定指标与方法
1.2.1 除草效果的计算 草甘膦茎叶处理后7 d和草甘膦种子处理播种后40 d,每隔7 d监测各处理杂草数量,计算杂草株防效及鲜质量防效。计算公式如下:


1.2.2 生理指标的测定 草甘膦茎叶处理后7 d和种子处理播种后40 d,取样测定各处理单株大豆株高、鲜质量、干质量、叶绿素含量、光合速率和莽草酸含量。
参照丁伟等提出的分光光度比色法测定大豆叶绿素含量[17]。量取5 mL二甲基亚砜(DMSO)加入到干净的血清瓶中,称质量,将大豆叶片新鲜组织加入血清瓶中,再称质量,放入暗室浸提。浸提24 h后,移取1 mL浸提液加入到5 mL的DMSO中混匀。在波长645、663 nm下用空白做对照测定吸光度,计算叶绿素含量:

式中:D1为645 nm处吸光度;D2为663 nm处吸光度;V1为样品提取液总体积(mL);K为样品显色稀释倍数;m为样品质量(g)。
光合速率采用美国LI-6400XT便携式光合速率测定仪测定。Li-6400XT叶室CO2浓度设定为 400 μmol/mol,温度为22.5 ℃,空气相对湿度为40%~50%。选择晴天09:00—11:00,测定各处理大豆的光合速率。
莽草酸含量的测定参照Cromartie等的方法[18],通过分光光度计进行测定。取样放于冰盒中带回进行测定。测定时,取0.1 g样品剪成碎片放入小瓶中,然后加 0.25 mol/L HCl溶液到2 mL,浸泡90 min,期间每隔30 min晃动1次。向试管中加2 mL氧化剂溶液(0.25%高碘酸溶液与0.25%偏高碘酸钾溶液配制而成),然后加入0.5 mL培养后的待测液,室温下反应60 min,再加入2 mL的显色溶液(0.6 mol/L NaOH和0.22 mol/L Na2SO3溶液配制而成),在380 nm下测定吸光度,每个样品重复3次。
标准曲线的制作:加已知量的莽草酸到未喷药前的提取液中,以每25 μL提取液中所含的莽草酸量(mg)为横坐标,以吸光度为纵坐标,作标准曲线。

式中:C为提取液莽草酸含量(μg/mL);V为提取液的总体积(mL);m为样品质量(g)。
1.3 数据统计分析
将试验所得的数据通过Excel进行整理,并采用 DPS 7.05 数据统计软件对试验数据进行5%差异显著水平检测分析。
2 结果与分析
2.1 草甘膦对转基因大豆的杂草防除效果
应用草甘膦处理过的转基因大豆杂草防除效果明显,并且不同剂量处理间差异显著。根据施药组与未施药组的杂草数,可以计算出3组草甘膦处理的株防效与鲜质量防效,由于茎叶处理为大豆三叶期施药,药后7 d开始调查,因此茎叶处理的防除效果最为明显。在2组种子处理中,草甘膦剂量为562.5 g a.i./hm2的处理组防除效果较好,从种子处理后 40 d 开始的株防效为73.25%,直至三叶期后28 d,其株防效仍在50%以上,并且整个测定周期与112.5 g a.i./hm2的低剂量种子处理相比均存在显著差异(表2)。

表2 转基因抗草甘膦大豆的株防效和鲜质量防效
注:不同小写字母表示不同处理相同处理时间在0.05水平上差异显著。下表同。
2.2 草甘膦对转基因大豆株高及鲜质量、干质量的影响
在茎叶处理21 d后、种子处理54 d后,草甘膦处理组与对照组的大豆鲜质量、干质量以及株高均无显著差异(表3)。
2.3 草甘膦对转基因大豆叶绿素含量及光合速率的影响
由表4可知,应用草甘膦的处理组转基因大豆叶绿素含量均低于未使用草甘膦的对照组,说明草甘膦的应用对大豆叶绿素含量起到了抑制作用。其中,562.5 g a.i./hm2种子处理组的叶绿素含量在种子处理后40 d时与未施药组相比显著降低,在47 d时种子处理组叶绿素含量恢复正常。而茎叶处理方面,叶绿素抑制率在施用后14 d达到最大,随后草甘膦对叶绿素的抑制作用减弱,从茎叶处理后21 d开始,叶绿素含量恢复正常。
光合速率方面,草甘膦各个处理组的转基因大豆光合速率均低于未使用草甘膦的对照组,说明草甘膦的应用抑制了大豆光合速率。其中,562.5 g a.i./hm2种子处理组的光合速率在种子处理后40 d时与未施药组和112.5 g a.i./hm2的低剂量种子处理组相比显著降低,在47 d时种子处理组光合速率恢复正常。而施用1 125 g a.i./hm2草甘膦的茎叶处理组光合速率抑制率在施用后14 d达到最大,随后草甘膦对光合速率的抑制作用降低,从茎叶处理后21 d开始光合速率恢复正常。

表3 转基因抗草甘膦大豆的株高和鲜质量、干质量
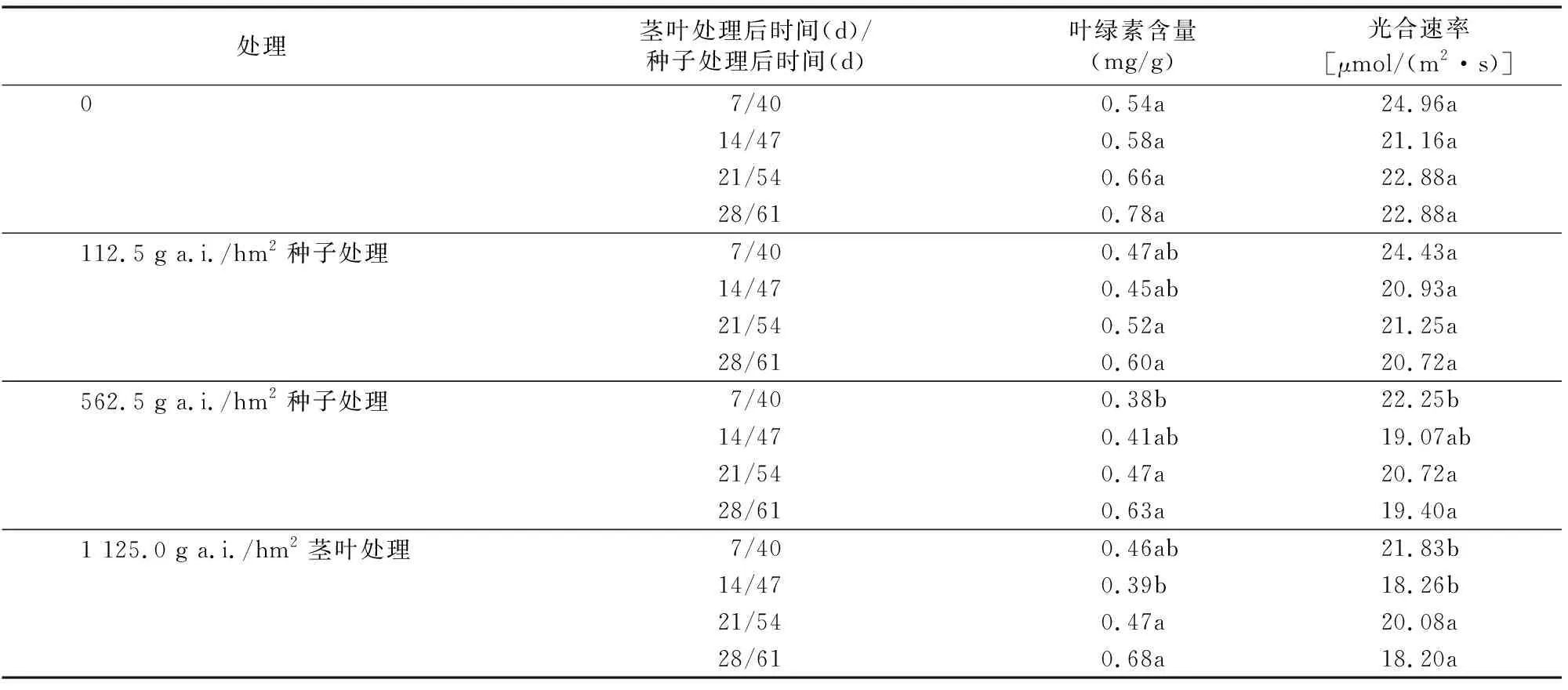
表4 转基因抗草甘膦大豆的叶绿素含量及光合速率
2.4 草甘膦对转基因大豆莽草酸含量的影响
从表5中可以看出各处理间莽草酸含量差异不显著,可见应用草甘膦处理的转基因抗草甘膦大豆莽草酸含量受草甘膦影响不明显。
3 讨论与结论
大豆是我国重要的粮食作物。除草剂的大量使用导致抗药性杂草出现。长残留除草剂的使用及除草剂施用前后环境条件的影响也使作物药害频发,如在东北地区大豆田,咪唑乙烟酸、氯嘧磺隆等除草剂施用后长期残留在土壤中,对后茬敏感作物造成严重药害,损失巨大[19]。近年来,转基因抗除草剂大豆已成为北美和南美洲地区大豆田杂草防除的重要而有效的途径。已有研究表明,草甘膦在922.5~2 460.0 g a.i./hm2剂量范围内,对转基因抗草甘膦大豆的安全性较好[20]。本试验采用草甘膦种子和茎叶处理对我国目前研发的转基因大豆呼交06-698的安全性进行了研究,表明草甘膦对该大豆品种安全。
应用草甘膦处理的转基因大豆田间杂草防除效果显著,草甘膦种子处理对杂草也有较明显的防除效果,相对于茎叶处理的优势在于可在一定时期内明显控制大豆植株周围杂草发生,有效降低草甘膦的用量,减少除草剂对农田环境污染,此外采用草甘膦种子处理可以在室内快速测定草甘膦对转基因抗草甘膦大豆的安全性。
施用草甘膦后,转基因大豆叶绿素含量、植株生长量、根瘤生物量和根瘤固氮作用均降低[21-23]。草甘膦可抑制叶绿体RNA、 叶绿体核糖体以及色素的形成。叶绿素含量作为植物生理性状的一个重要指标,反映了光合能力的大小,通过喷施草甘膦后叶绿素变化,可了解草甘膦对光合作用的影响。从试验结果可以看出,叶绿素含量和光合速率变化趋势大致相同,表明草甘膦施用后对这2项指标的抑制作用明显,但随着时间的延长抑制作用开始降低,草甘膦茎叶处理后28 d、种子处理后61 d叶绿素含量和光合速率恢复到正常水平。植株生长方面,在茎叶处理后21 d、种子处理后54 d,草甘膦处理与对照大豆鲜质量、干质量以及株高均恢复正常水平。

表5 转基因抗草甘膦大豆的莽草酸含量
草甘膦对植物体内EPSPS有专一抑制作用[24]。通常处理后1 d,莽草酸便开始积累,4~7 d达高峰,测定叶片内莽草酸含量可反映草甘膦所造成的药害的程度[25]。本研究结果表明草甘膦对中国目前研发的转基因大豆呼交06-698安全,可用于转基因抗草甘膦大豆田杂草防除,可通过草甘膦种子处理快速检测草甘膦对转基因大豆的安全性。
