炎症性肠病并发耶氏肺孢子菌肺炎的临床特点
2018-09-06孟祥辰董旭旸韩慧侨伍东升钱家鸣李景南
孟祥辰,李 骥,吴 东,徐 蕙,董旭旸,韩慧侨,伍东升,钱家鸣,李景南
中国医学科学院 北京协和医学院 北京协和医院消化内科,北京 100730
过去几十年来,我国炎症性肠病(inflammatory bowel disease,IBD)的发病率有所增加,免疫抑制治疗患者数量相应增加,包括糖皮质激素、免疫抑制剂和生物制剂。免疫抑制药物大大改善了炎症性肠病患者的治疗疗效,但同时也增加了耶氏肺孢子菌肺炎(Pneumocystis jiroveci pneumonia,PJP)等严重机会性感染的风险[1- 2]。尽管IBD患者合并PJP的绝对风险仍然较低[3],然而,一旦发生就可能是致命的机会性感染[4- 5]。PJP是较罕见的机会性感染,其在免疫功能缺陷患者中更常见,如获得性免疫缺陷综合征(human immunodeficiency virus,HIV)、器官移植后、接受免疫抑制剂或生物制剂治疗等。既往国外研究显示,免疫抑制治疗、CD4+淋巴细胞计数减少和年龄大于55岁均是发生PJP的危险因素[6- 10]。然而,目前国际上尚无基于循证医学证据的关于IBD患者PJP预防性治疗的指南,亦无临床经验性共识[11]。国内关于IBD并发PJP的研究甚少,仅见个案报道[12- 13]。本研究旨在通过回顾性分析北京协和医院IBD并发PJP肺炎患者的临床特征,探讨我国IBD患者并发PJP肺炎的危险因素。
对象和方法
对象通过检索北京协和医院出院患者登记系统及炎症性肠病临床数据库,共回顾性纳入2012年1月至2017年7月于北京协和医院住院治疗的IBD且确诊罹患PJP肺炎的患者5例。IBD的诊断参考2012年我国IBD的诊断标准[14],PJP的确诊基于患者痰液或支气管灌洗液PJP-DNA阳性并结合患者临床表现及影像学改变做出。
方法对上述患者进行详细的病历回顾,采集患者的人口学特点(年龄、性别)、临床表现(IBD的类型、病变范围、疾病活动度、发病至PJP感染时间)、辅助检查、既往药物治疗及诊断PJP后治疗转归等资料,进行描述性分析。溃疡性结肠炎的病情严重程度用改良Mayo评分评价,克罗恩病的病情严重程度用Best的克罗恩病活动指数评分评价。活动性巨细胞病毒感染是指患者血清中IgM抗体阳性、巨细胞病毒(cytomegalovirus,CMV)DNA拷贝数大于500拷贝/ml或肠道病理组织学CMV免疫组织化学染色阳性。(1,3)-β-D葡聚糖浓度(G试验)<100.5 pg/ml为阴性,>151.5 pg/ml为阳性。
统计学处理应用SPSS 19.0统计学软件进行分析。正态分布计量资料采用均数±标准差表示,非正态分布计量资料采用中位数(最小值,最大值)表示。
结 果
炎症性肠病5例患者中4例诊断为溃疡性结肠炎、1例诊断为克罗恩病。所有患者均为男性,年龄59~64岁,平均(61.8±1.9)岁,从发病至罹患PJP肺炎的中位时间为46(2,288)个月。所有患者均处于疾病活动期,3例患者为重度活动、2例为中度活动。4例溃疡性结肠炎中3例为全结肠型、1例为左半结肠型。
感染前相关检验结果及接受治疗情况5例患者确诊为PJP肺炎前都存在低白蛋白血症,其中3例外周血淋巴细胞计数小于0.6×109/L。4例行CD4+T细胞计数检测的患者中2例CD4+T细胞小于200×106/L,平均计数为292×106/L。4例患者存在血清巨细胞病毒DNA拷贝数升高和/或血清巨细胞病毒IgM阳性。所有患者感染PJP前使用大剂量糖皮质激素,其中3例联合免疫抑制剂治疗。2例患者PJP感染发生在结直肠切除术后1个月内。
诊断及转归PJP肺炎方面,所有患者均有咳嗽、憋气,其中3例存在明显低氧血症、2例达Ⅰ型呼吸衰竭。所有患者胸部CT均可见双肺弥漫性磨玻璃样影(图1)。5例患者痰或支气管灌洗液PJP-DNA阳性,其中4例(1,3)-β-D葡聚糖检测(G试验)阳性,结果均值为1135.86 pg/ml。2例Ⅰ型呼吸衰竭患者收入重症监护病房并需有创机械通气。所有患者均接受足量复方磺胺甲噁唑及甲基泼尼松龙治疗,4例康复出院、1例病情加重自动出院后死亡。
5例患者临床资料见表1。

PJP:耶氏肺孢子菌肺炎
PJP:Pneumocystis jiroveci pneumonia
A.诊断PJP时肺部CT,气管分叉层面;B. 诊断PJP时肺部CT,右肺中叶开口层面;C.接受磺胺甲噁唑及甲基泼尼松龙治疗3周后肺部CT(与A图相同层面);D.接受磺胺甲噁唑及甲基泼尼松龙治疗3周后肺部CT(与B图相同层面)
A. chest CT upon diagnosis of PJP,tracheal bifurcation level;B. chest CT upon diagnosis of PJP,right middle lobe opening level;C. chest CT after 3 weeks of trimethoprim-sulfamethoxazole and methylprednisolone (same level as figure A);D. chest CT after 3 weeks of trimethoprim-sulfamethoxazole and methylprednisolone treatment (same level as figure B)
图1病例4 抗PJP治疗前后肺部CT
Fig1Chest CT before and after anti-PJP treatment in Case 4
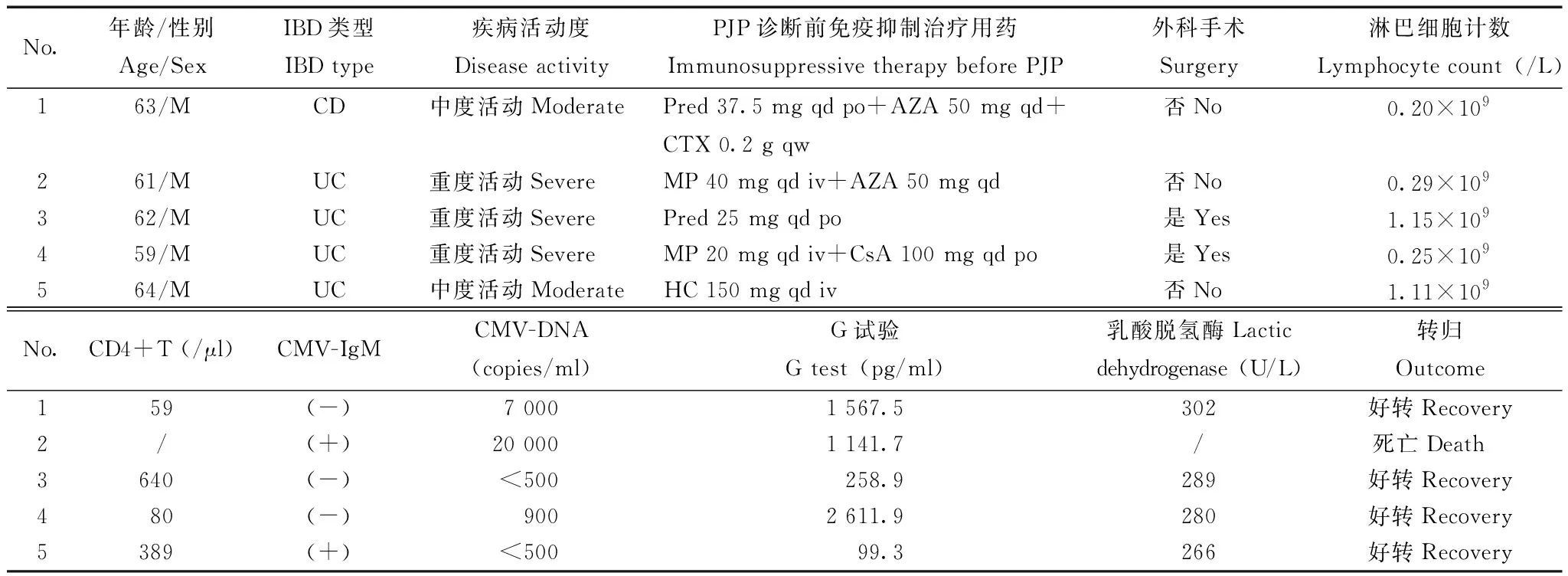
表 1 IBD合并PJP感染的5例患者临床资料Table 1 Clinical data of 5 IBD patients with PJP
IBD:炎症性肠病;M:男;CD:克罗恩病;UC:溃疡性结肠炎;Pred:泼尼松;qd:每日1次;po:口服;AZA:硫唑嘌呤;CTX:环磷酰胺;qw:每周1次;MP:甲基泼尼松龙;iv:静脉注射;CsA:环孢素;HC:氢化可的松;CMV:巨细胞病毒;/:未查
IBD:inflammatory bowel disease;M:male;CD:Crohn’s disease;UC:ulcerative colitis;Pred:prednisone;qd:once daily;po:by mouth;AZA:azathioprine;CTX:cyclophosphamide;qw:once a week;MP:methylprednisolone;iv:intravenous injection;CsA:cyclosporine;HC:hydrocortisone;CMV:cytomegalovirus;/:not examined
讨 论
国外大样本队列研究发现非IBD患者并发PJP的发病率为每年3/10万,IBD患者并发PJP的发病率是非IBD患者的3倍以上,而接受免疫抑制剂治疗的IBD患者并发PJP的发病率甚至高出10倍以上,约为32/10万[2]。在接受免疫抑制剂治疗中发生PJP感染的患者死亡率非常高,有研究报道接受英夫利昔单抗治疗发生PJP感染患者的死亡率高达30%[7]。因此,临床医师应重视IBD并发PJP感染,争取积极预防、早期诊断、早期规范治疗,改善患者预后。本研究通过回顾性分析5例IBD并发PJP的患者,发现所有患者年龄均大于55岁,疾病处于活动期,接受免疫抑制治疗;2例患者出现致死性的呼吸衰竭,需机械通气;早期痰液病原学检查、积极治疗PJP有助于改善患者预后。
IBD并发PJP的早期诊断早期诊断和治疗对PJP感染患者的生存至关重要[5]。对于接受免疫治疗的IBD患者,如出现进行性加重的呼吸困难,咳嗽、无痰或少痰,伴发热等典型症状,胸部CT表现为双侧对称性、靠近顶端的磨玻璃样改变,以及沿肺门分布的马赛克征改变,应警惕PJP感染[15]。无论是在HIV患者还是非HIV患者,(1,3)-β-D-葡聚糖(G试验)均是较好的非侵入性PJP感染预测指标[16- 18]。有研究表明,对于诊断PJP,G试验灵敏度可达90%~95%,特异性为78%~86%。因此,G试验、胸部影像学检查及PJP特异性检测有助于PJP的早期诊断[19]。在Damiani等[20]的研究中,17例PJP患者G试验浓度的中位数为1945 pg/ml(122,8000),其中10例浓度>500 pg/ml,14例浓度>300 pg/ml,对照组和肺孢子菌定植组患者的G试验浓度低于90 pg/ml。有报道乳酸脱氢酶可作为HIV患者PJP感染的标记物[4,21],但本研究IBD合并PJP感染的5例患者的乳酸脱氢酶均未见升高。PJP的诊断仍主要依靠病原学检查,因非HIV 的患者肺孢子菌负荷量较少,采用染色的显微镜检查的敏感性显著低于HIV感染者,因此更推荐对非HIV患者的呼吸系统样本(诱导痰或支气管肺泡灌洗液)行PCR核酸检测。如高度怀疑PJP感染,需积极联系进行病原学检查。
IBD罹患PJP感染的危险因素什么样的IBD患者罹患PJP的风险增加?首先,接受免疫抑制治疗的患者(包括糖皮质激素、免疫抑制剂和生物制剂)发生PJP的风险增加,并且免疫抑制剂数量与发生机会感染的风险呈正相关,尤其是合并使用生物制剂时[8]。其次,同IBD并发其他感染的危险因素一样,PJP的发病率也随年龄的增加而增加,目前并没有基于循证医学的临床指南明确好发PJP感染的年龄界限,有报道年龄大于55岁应经验性的作为PJP感染的危险因素[10],本研究所有患者年龄均大于55岁佐证了这一观点。再次,外周血淋巴细胞低于0.6×109/L,特别是CD4+T淋巴细胞数量小于0.3×109/L也是发生PJP的高危因素[6]。此外,肺部的并发症、营养不良、近期CMV感染均增加PJP感染的风险[10,22- 23]。在对肾移植患者罹患PJP的研究中发现,CMV感染与PJP的发生之间存在独立相关性,研究者认为CMV感染本身具有免疫抑制作用,可导致细胞介导免疫的明显损伤,从而增加PJP感染的风险[23- 24]。另有研究显示,在接受免疫抑制治疗罹患PJP感染的患者中有超过一半合并有CMV感染,但合并CMV感染并不明显增加患者的死亡率[25]。本研究2例患者PJP感染发生在腹腔镜回肠/全结肠切除术后1个月内,提示外科术后亦应警惕PJP感染。
IBD并发PJP感染的预防对于非HIV患者的PJP预防治疗,已有指南明确指出实体器官移植受者、造血干血胞移植受者是PJP预防治疗的适应证,对于接受免疫抑制药物的风湿性疾病患者,专家也提倡进行预防治疗[26- 28]。但IBD患者中发生PJP的绝对风险依然很低[3],并且PJP预防治疗有白细胞减少、血小板减少、严重的皮肤病等不良反应[29],因此,并不是所有IBD患者均需要预防PJP。国外大型问卷调查显示临床医生未予PJP预防治疗的最常见原因包括缺乏PJP相关的临床经验以及缺乏IBD患者联合免疫抑制剂治疗需要预防PJP的知识[30]。因此,加强医生对IBD合并PJP感染的了解是迫切的。
本研究是国内首个关于IBD并发PJP的回顾性队列研究,有助于临床医师(特别是IBD专科医师)增加对PJP的认识。诚然,本研究尚有不足之处,主要是作为回顾性单中心小样本研究,会有明显的选择偏倚,存在明显的数据资料不完善,缺乏长期的随访,无法得出IBD罹患PJP的流行病学数据,更难以评价其卫生经济学价值。希望将来开展全国多中心的前瞻性或回顾性研究,更系统准确地评价IBD并发PJP的危险因素、治疗特别是预防的时机及手段,为减少甚至避免IBD患者出现致死性的PJP感染给出指导性意见。
综上,消化内科医师应正确认识IBD罹患PJP的危险因素,包括免疫抑制治疗、高龄、外周血CD4+T淋巴细胞计数减低及并发CMV感染,对于存在上述危险因素的患者,一旦出现咳嗽、憋气,需高度警惕PJP感染,积极行病原学、胸部影像学检查;预防IBD患者罹患PJP的给药时机,是借鉴HIV患者或其他免疫系统疾病的资料,还是有IBD患者的独特之处,将是未来研究的一个方向。
