陆地棉中赤霉素合成途径关键酶基因的时空表达变化
2018-09-06石建兵许庆华乔文青严根土
石建兵,王 宁,周 红,许庆华,乔文青,严根土
( 中国农业科学院棉花研究所,棉花生物学国家重点实验室,河南安阳455000)
赤霉素(Gibberellins,GAs)作为一种重要的植物激素,由日本学者于1938 年从赤霉菌中分离到而得名[1],其在植物的整个生长发育周期中起调节作用,参与控制多种多样的植物发育过程。并且植物对环境的适应性也与GA生物合成的调控有着或多或少的关系,目前,通过GA矮化突变体的研究已经基本阐明了高等植物赤霉素代谢途径[2]。赤霉素合成过程较为复杂,其中古巴焦磷酸合成酶(Copalyl pyrophosphate synthase,CPS)、内根-贝壳杉烯合成酶(Ent-kaurene synthase,KS)、内根-贝壳杉烯氧化酶(Ent-kaurene oxidase,KO)、GA-20氧化酶(GA-20 oxidase)、GA-2氧化酶(GA-2 oxidase)和GA-3氧化酶(GA-3 oxidase)是GA合成途径中起关键作用的酶[3]。
CPS位于前质体,牻牛儿基牻牛儿焦磷酸(Geranylpyrophosphate,GGPP)在其催化作用下生成古巴焦磷酸(Copalyl pyrophosphate,CPP),进一步在KS的催化作用下形成GA前身,即内根-贝壳杉烯,CPS与KS的催化反应均发生在原生质体内。在内质网内,内根-贝壳杉烯经由KO的三步氧化反应,形成内根-贝壳杉烯酸。在GA合成的最后阶段,GA-20 oxidase、GA-3 oxidase和GA-2 oxidase起着重要的调控作用,也是目前研究最多的赤霉素合成酶基因[4]。GA-20 oxidase是一个多基因家族,是植株体内GA合成过程中重要的限速酶,不仅受反馈调节,又受光周期调控,其参与一系列的氧化反应过程,包括从GA12到GA9以及从GA53到GA20等过程,最后形成具有生物活性的GAs[5]。GA-3 oxidase同GA-20 oxidase一样,可以将非生物活性的GAs转变为有生物活性的GAs。GA-2 oxidase主要起钝化GAs的作用,通过使有生物活性的GA1和GA4羟基化转变成无活性的GA8和GA34,从而降低植株内活性GAs的含量[6]。赤霉素受体GID1(Gibberellin insensitive dwarf 1)可感知并结合游离的GAs,通过诱导下游DELLA蛋白,从而释放下游基因的表达,在植物体上产生赤霉素效应[7]。由于GAs对农作物生长发育的调控作用,其直接或间接地影响着农作物的产量和质量,水稻和小麦育种进程的快速发展均与GAs密切相关[8-9]。目前,对于植物激素的研究已由生理水平转向了分子水平[10-11]。
本研究选用陆地棉品种中棉所49为研究材料,利用实时荧光定量PCR方法,对赤霉素合成途径关键酶基因在棉花植株生长发育的关键时期及各组织内的表达模式进行了检测与分析,为合理利用赤霉素调控棉花生长发育提供了理论基础。
1 材料和方法
1.1 试验材料
中棉所49(CCRI49)由中国农业科学院棉花研究所提供,为遗传育种室抗逆育种课题培育的常规品种。
主要仪器包括超净工作台、微量移液枪(Eppendorf)、低温离心机、实时荧光定量PCR仪(Bio-Rad)、蛋白核酸测定仪。主要试剂包括植物总RNA提取试剂盒、96孔PCR板(TaKaRa)、cDNA反转录试剂盒、荧光染料2×SYBR Green I Mix(TaKaRa)。
1.2 试验方法
1.2.1 材料准备 取CCRI49种子,在播种期种植于中国农业科学院棉花研究所东场九区试验田。分别于2017年5月31日(苗期)、7月12日(开花期)、8月20日(吐絮期)取植株的根、茎、叶部位组织,-80 ℃保存。
1.2.2 棉花总RNA提取与质量检测 取保存的各样品,在液氮中研磨,RNA的提取按提取试剂盒说明书操作,用蛋白核酸测定仪对提取的棉花总RNA的浓度和质量进行检测,计算并用ddH2O调整各样品RNA到合适的浓度,-80 ℃保存。
1.2.3 反转录合成cDNA链 以提取的RNA为模板,进行逆转录反应,体系为20 μL,包含Total RNA 30 ng、5×gDNA Buffer 2 μL,最后用RNase-Free ddH2O补足后振荡并离心,在PCR仪中进行42 ℃ 3 min,4 ℃ 2 min。之后在体系中加入FQ-RT Primer Mix 2 μL、10×Fast RT Buffer 2 μL、RT Enzyme Mix 1 μL和RNase-Free ddH2O 5 μL,混匀后置于PCR仪中进行42 ℃ 15 min,95 ℃ 3 min,4 ℃保存。
1.2.4 设计引物 在NCBI查找CPS1、KS、KO、GA20ox、GA3ox、GA2ox和GID1的EST序列并参考水稻、葡萄、番茄等植物赤霉素代谢关键酶基因序列[12-14],利用Primer Premier 5引物设计软件设计用于荧光定量PCR的特异性引物,内参基因选用棉花内源持家基因UBQ7(GenBank:DQ116441)[15],引物序列见表1。

表1 引物序列Tab.1 Primers used in Real-time PCR assays
1.2.5 荧光定量PCR(Real-time PCR)分析 以cDNA为模板进行Real-time PCR扩增。反应中,分别扩增不同生长阶段各材料样品中根、茎、叶组织内的GA相关基因和UBQ7基因,设3次重复。反应条件为95 ℃预热10 min;95 ℃ 变性10 s,60 ℃ 退火30 s,40个循环,从65~95 ℃收集熔解曲线。数据由IQ5荧光定量PCR仪全程采集、分析,用2-(ΔΔCT)法计算目的基因表达量。
2 结果与分析
2.1 CCRI49棉花植株取样与Real-time PCR
在田间分别于幼苗期、 开花期和吐絮期采集棉花植株的根、茎、叶组织,用蒸馏水冲洗干净,经吸水纸吸干多余水分后,-80 ℃保存。总RNA的提取参照RNA提取试剂盒说明书操作进行,经1.2%的琼脂糖凝胶电泳检测RNA,条带清晰无降解,可用于下一步的反转录试验和荧光定量试验(图1)。
第一链cDNA的合成参照反转录试剂盒操作进行,并以合成的cDNA为模板,利用特异性引物对CRRI49材料的根、茎、叶组织内赤霉素合成途径各关键酶基因进行实时荧光检测,如图2所示,各目的基因及内参基因的扩增曲线表现较好,由于目的基因不同,熔解曲线为多峰,但同一目的基因的熔解曲线表现为单峰,表明引物的特异性较好,扩增曲线中的荧光值能够准确反映各目的基因的表达变化,可以进行基因相对表达量的计算。
棉花材料CCRI49在不同生长阶段内的CPS1、KS、KO、GA2ox1、GA3ox1、GA20ox1和GID1B基因的表达量采用2-ΔΔCT法,以棉花内源基因UBQ7为参考基因,以苗期CCRI49根组织为对照样品进行计算,结果如表2所示。

A.幼苗期;B.开花期;C.吐絮期;M.Marker;1~3.幼苗期根茎叶组织RNA;4~5.开花期根茎叶组织RNA;6~9.吐絮期根茎叶组织RNA。A.Seedling;B.Full-blooming;C.Boll opening;M.Marker;1-3.RNA of root,stem,leaf in seedling stage;4-5.RNA of root,stem,leaf in fullblooming stage;6-9.RNA of root,stem,leaf in boll opening stage.
2.2 幼苗期不同组织内GAs合成相关酶基因表达分析
从图3可以看出,以幼苗期CCRI49根组织内各目的基因的表达为对照(表达量为1.00),赤霉素合成途径各关键酶基因在CCRI49茎、叶组织内的表达量均有不同。在CCRI49茎中,CPS1、KS、KO、GA3ox1、GA20ox1的表达量较高,表达量分别为16.92,4.64,3.37,14.52,10.63,GA2ox1表达量则低于对照水平,表达量为0.36;在CCRI49叶中,GA3ox1表达量升高,为12.82,其他基因表达量均低于对照。综合来看,CPS1、KS、KO、GA3ox1、GA20ox1在茎中表达量较高(P<0.05);在叶组织中表达量较低(GA3ox1除外,其表达量达显著差异水平,P<0.05)。GA2ox1在各组织内表达量均低于对照水平(P<0.05)。苗期棉花植株生长速率较快,需要充足的养分与激素来满足与调节植株的生长发育,该期间主要以根的生长与茎的伸长为主。
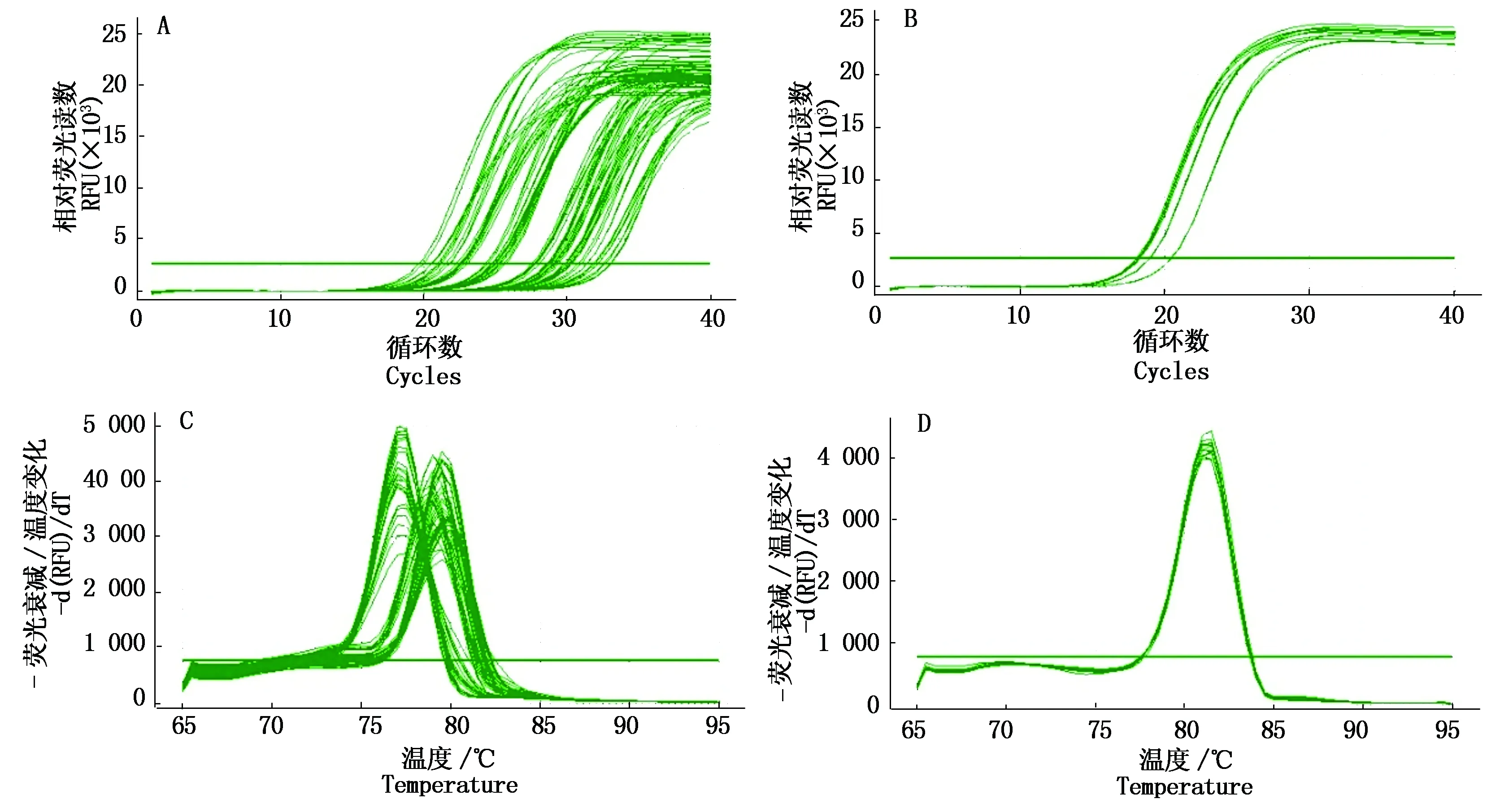
A.目的基因扩增曲线;B.内参基因(UBQ7)扩增曲线;C.目的基因熔解曲线;D.内参基因(UBQ7)熔解曲线。A.Amplification curve of target gene;B.Amplification curve of UBQ7;C.Melt curve of target gene;D.Melt curve of UBQ7.

表2 棉花材料GAs合成途径关键酶基因的表达情况Tab.2 Key enzyme genes expression of GAs synthesis pathway in cotton material
注:ΔCT=CT(Target)-CT(UBQ7);-ΔΔCT=ΔCT(Root)-ΔCT。

不同的小写字母表示相对于幼苗期根组织差异显著(P<0.05)。图4-8同。Different lowercase mean significant difference at 0.05level compared to root of seedling. The same as Fig.4-8.
2.3 开花期不同组织内GAs合成相关酶基因表达分析
与幼苗期根组织内各目的基因表达量(各基因表达量为1.00)相比,开花期内棉花植株各组织中的GAs基因表达量发生较大变化(图4),根组织中,CPS1、KS、GA20ox1的表达量分别为0.36,0.47,0.78,均低于对照水平(1.00),且差异达显著水平(P<0.05);KO基因表达量为1.19,与苗期对照差异不显著;GA2ox1、GA3ox1、GID1B基因表达量分别为7.65,18.46,6.01,较苗期水平(1.00)有较大幅度上调,差异达显著水平(P<0.05)。茎组织中,KS、KO基因表达量分别为0.68和0.80,较对照(1.00)下调0.32和0.20;其他基因表达量均表现为上调,其中以GA20ox1和GA3ox1上调幅度较大,表达量达44.57和32.90,差异达显著水平(P<0.05)。叶组织中,KS、GA2ox1、GA20ox1基因表达量较对照水平(1.00)有所降低,分别为0.16,0.23,0.72,CPS1、KO、GID1B表达量上调幅度不大,GA3ox1基因表达量则上调为对照水平(1.00)的87.48倍(P<0.05)。该阶段内,茎中GA20ox1基因的高表达为植株茎的伸长及果枝发育提供必要的活性赤霉素水平,GA3ox1基因在根茎叶中均表现为上调,可能与开花成铃有关。

图4 开花期GAs合成途径各关键酶基因在棉花各组织内的表达情况Fig.4 The expression of GAs metabolism key enzymegenes in cotton tissues in full-blooming stage
2.4 吐絮期不同组织内GAs合成相关酶基因表达分析
棉花植株生长发育后期,各组织内GAs相关基因表达如图5所示,此时期根组织中GA2ox1和GA3ox1基因表达量分别为7.68,4.81,与对照(1.00)相比表现为上调,差异达显著水平(P<0.05),其余基因均表现为下调。茎组织中各目的基因的表达量均高于根组织(KO、GID1B差异不显著),但与苗期对照水平(1.00)相比,KS、GID1B基因表达量为0.54和0.59,表现为下调,其余基因表达量均上调,其中以GA2ox1上调幅度最大,为8.64,其次为GA3ox1和GA20ox1,表达量分别为5.37,5.71,与对照相比差异达显著水平(P<0.05)。叶组织中除GA2ox1基因表达量较对照(1.00)降低外,其余基因表达量均表现为上调,最高为GA20ox1(17.67),其次为GA3ox1(10.02),均达显著水平(P<0.05)。该生长阶段内,植株的营养生长逐渐降低,表现为根茎GA2ox1基因表达量升高;此时棉桃生长发育至脱水成熟,需要内源GAs的促进与调控,表现为植株叶组织中GA3ox1和GA20ox1基因表达量上调。

图5 吐絮期GAs合成途径各关键酶基因在棉花各组织内的表达情况Fig.5 The expression of GAs metabolism key enzymegenes in cotton tissues in boll opening stage
2.5 GAs合成途径关键酶基因在棉花植株不同生长阶段的表达变化
GAs调控植株生长发育是一个复杂的过程,其相关基因的表达不仅在不同组织内表现不同,在不同的生长阶段也各不相同。根组织内各基因的表达变化趋势如图6所示,以幼苗期根组织为对照,CPS1、KS、GA20ox1基因表达量在开花期和吐絮期均低于对照水平,KO基因在3个时期表达量变化不大,与对照相比,开花期为1.19,吐絮期为0.89,基本趋于稳定。GA2ox1基因的表达量在开花期上调到7.65水平,并维持不变到吐絮期的7.68水平。GA3ox1和GID1B基因表现出先升高后降低的表达趋势,其中,GA3ox1在根的生长过程中逐渐升高到开花期时的18.46,再逐渐降低,但在吐絮期的表达量仍高于幼苗期,为4.81;GID1B在开花期上调为6.01,至吐絮期又表现为下调,且低于对照水平。

图6 CCRI49根组织GAs合成途径各关键酶基因的表达情况Fig.6 The expression of GAs metabolism keyenzyme genes in cotton root
茎组织内各基因的表达变化趋势如图7所示,CPS1、KS基因在幼苗期表达量较高,到开花期和吐絮期呈逐渐下降趋势,且KS基因在开花期和吐絮期的表达水平均低于对照。KO基因在幼苗期表达量为3.37,高于对照,到开花期降低到对照水平以下(0.80),吐絮期又上调至对照水平以上(1.48)。随着植株的生长发育,GA2ox1基因的表达量呈逐渐升高的趋势,到吐絮期,植株由以营养生长为主转为以生殖生长为主,此时茎中活性GAs含量逐渐降低。GA-20氧化酶和GA-3氧化酶是严格调控的酶,在赤霉素合成的后期阶段起重要作用,在幼苗期GA3ox1和GA20ox1基因表达量维持在较高水平,并在开花期达到最大表达量水平,后逐渐降低到吐絮期的5.37,5.71水平,仍高于对照,表明GA3ox1和GA20ox1与植株的开花吐絮有关。

图7 CCRI49茎组织生长发育阶段GAs合成途径各关键酶基因的表达情况Fig.7 The expression of GAs metabolism key stagesof growth and development enzyme genes in cotton stem
叶组织内各基因的表达变化趋势如图8所示,GA3ox1基因表达量变化趋势最为明显,在幼苗期表达量为12.82,到开花期上升为87.48,至吐絮期又降低为10.02。CPS1和KO基因表达量在开花期得到上调,至吐絮期基本稳定。KS基因表达量在幼苗期表达量极低,后逐渐升高。GA2ox1基因在叶片中表达量变化不大。GA20ox1和GID1B基因的表达量呈逐渐升高的趋势,可能与后期棉桃的成熟吐絮有关。

图8 CCRI49叶组织GAs合成途径各关键酶基因的表达情况Fig.8 The expression of GAs metabolism keyenzyme genes in cotton leaf
3 讨论与结论
GAs对植物根系的生长、茎的伸长、叶的展开、种子萌发和花的发育等起着重要的调控作用,近年来,人们对GA合成途径的研究较为完善,在其合成途径起关键作用的酶基因已在许多植物中克隆出来[16-17]。在这些关键酶基因中,CPS、KS和KO在GA的合成早期起作用,被认为是在总体水平上调控GA合成的关键位点[18]。GA20ox、GA3ox和GA2ox在GA合成途径的后期起作用,且参与多步反应,催化具有生物活性赤霉素的合成[19]。李晨晨等[20]认为,若CPS完全突变,植物将不能产生赤霉素,从而严重影响植物的发育。CPS和KS的催化作用在水稻中阻碍KO的催化步骤则会影响活性赤霉素的合成,最终导致植物矮化[21]。GA20ox和GA3ox在GA合成途径中起促进活性GAs合成的作用,过量表达GA20ox会促进植株生长。GA2ox则相反,起着分解活性GA1和GA4变成无生物活性GA8和GA34的作用,而活性GAs的减少必然影响植物的生长发育[22-23]。水稻和玉米中,由于GA3ox基因的突变,导致了植株矮化的发生[24]。赤霉素受体(GID)是赤霉素信号转导途径的重要成员,直接影响着赤霉素对植物体效应的发挥,研究表明,在外源GA3诱导下,MsGID1B基因的表达量较高,可能参与紫花苜蓿的抗逆调控[8]。
本研究相对定量结果表明,不同组织内赤霉素合成途径相关基因的表达量各不相同,且随着植株的生长发育,不同组织内各目的基因的表达变化也各不相同。幼苗期,棉花植株生长速率较快,需要充足的养分与激素来满足与调节植株的生长发育,该期间主要以根的生长与茎的伸长为主,表现为茎中起正向调控的相关酶基因表达量较高,以促进活性GAs的合成。开花期,GAs相关基因表达量发生较大变化,茎中GA20ox1基因的高表达为植株茎的伸长及果枝发育提供必要的活性赤霉素水平,这与Huang等[25]研究结果相一致。另外发现,GA3ox1基因在根茎叶中均表现为上调,GA-3ox同GA-20ox类似,在GAs合成途径中起正向调控作用[26-28],推测可能与开花成铃有关。吐絮期,棉花植株逐渐由营养生长转向生殖生长,根茎组织逐渐衰老,此时根茎组织GA2ox1基因表达量升高,活性GAs合成降低,叶组织中GA3ox1和GA20ox1基因表达量上调,为棉桃生长发育与脱水成熟提供必要的激素水平,与前人研究一致[29]。Yamaguchi等[30]发现,在南瓜生长发育的不同阶段,CPS基因的表达量会发生一定的变化,表现为在幼嫩的组织中表达水平最高,之后随着衰老程度增加而降低,与本研究结果相一致。
本研究通过对陆地棉材料,中棉所49植株体内赤霉素合成相关酶基因的表达量进行检测,发现各目的基因在不同组织内的表达量有所差异。且随着生长发育的进行,棉花植株根茎叶组织内赤霉素合成相关基因的表达量变化趋势存在一定差异。幼苗期茎组织内除GA2ox1基因外,其余各基因表达量相对较高,为植株的生长发育提供了充足的激素水平;开花期GA20ox1基因的高表达为植株茎的伸长及果枝发育提供必要的活性赤霉素水平,GA3ox1基因可能与开花成铃有关;吐絮期,根茎组织GA2ox1基因表达量升高,活性GAs合成降低,叶组织中GA3ox1和GA20ox1基因表达量上调,为棉桃生长发育与脱水成熟提供必要的激素水平。该研究为进一步了解赤霉素调控棉花的生长发育提供了基础,为棉花株型育种工作提供了新思路、新方向。
