12例系统性红斑狼疮并发非肝硬化性门脉高压患者的临床特点
2018-09-06胡蓉蓉张上珠李梦涛张奉春曾小峰
胡蓉蓉,张上珠,李梦涛,赵 岩,张奉春,曾小峰
系统性红斑狼疮(systemic lupus erythematosus,SLE)患者常出现肝功能异常,据报道25%~50% SLE患者存在肝脏病变[1]。患者肝功能异常的原因为SLE本身导致肝脏受累、并发其他自身免疫性疾病所致(如原发性胆汁性肝硬化)、并发非免疫相关性疾病所致(如病毒性肝炎)、药物导致肝脏受损。SLE患者肝脏受累的表现各有不同,如无临床症状的肝酶升高[2]、急性肝炎,甚至是爆发性肝衰竭。还有些SLE患者的肝脏受累表现为门脉高压(portal hypertension,PHT),导致PHT的原因包括各种原发病导致的肝硬化和门静脉系统或下腔静脉血栓形成,部分PHT无法用上述原因解释,即非肝硬化性门脉高压(non- cirrhotic portal hypertension,NCPH)[3]。本研究对SLE并发NCPH患者进行分析,旨在进一步探讨其临床特点和预后。
1 对象与方法
1.1 对象
回顾性分析北京协和医院1996年1月至2013年8月因SLE-NCPH住院患者12例的病历资料,SLE诊断和分类满足1997年美国风湿病学会(American College of Rheumatology,ACR)推荐的SLE分类标准[4]。NCPH患者有典型PHT的临床表现及影像学表现,除外肝硬化和其他原因所致的PHT,如肝静脉或门静脉血栓形成、右心功能不全和肝胆系统寄生虫等[3]。
1.2 方法
1.2.1 检查资料收集:采集SLE-NCPH患者临床资料,包括一般信息和病史;实验室检查包括血常规、血生化、凝血功能、红细胞沉降率、C反应蛋白、免疫球蛋白等炎性指标;相关抗体评估包括嗜肝病毒相关抗体、抗核抗体(antinuclear antibody,ANA)、抗可溶性核抗原(extractable nuclear antigen,ENA)抗体、抗磷脂抗体(antiphospholipid antibody,aPL)等测定;影像学检查包括肝胆胰脾B型超声、门静脉系统彩色超声、心脏彩色超声、肝脏CT、肝脏MRI等;另行肝脏组织病理学检查,并对治疗和临床结局进行总结。SLE活动指标采用SLE疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)进行评估[5]。
1.2.2 分组:12例患者均纳入SLE-NCPH组;另选择同期在北京协和医院住院SLE患者中31例无PHT者作为对照组,对照者性别、年龄配比为1∶3~1∶2。
1.3 统计学方法
采用SPSS 17.0统计学软件进行统计分析。定量资料采用标准偏差的平均数或中位数表示,定性资料用百分比表示。两组定量资料采用t检验,两组定性资料比较采用Fisher精确概率法 。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
12例SLE-NCPH患者临床资料见表1。12例患者中女性11例,男性1例。SLE的发病年龄为20~52岁,平均(27±11)岁;NCPH发病年龄为19~52岁,平均(37.5±12.3)岁。患者病程为0.5~312.0个月。患者确诊SLE后至出现PHT的平均时间为(125±112)个月(表1)。2例患者以NCPH为首发表现。
2.2 临床表现
PHT表现:12例患者无1例以消化道出血起病,9例患者脾脏体积增大,2例患者腹胀伴移动性浊音,1例患者胃镜检查提示食管胃底静脉显露(表2)。6例并发关节炎,5例并发干燥综合征,4例伴有蝶形红斑,4例并发SLE性肾炎,1例并发肺间质病变(表1)。
SLE-NCPH患者神经系统受累例数少于对照组(P<0.05),低补体血症及血小板减少比例显著高于对照组,其他临床表现与对照组比较差异无统计学意义(P>0.05)。两组患者SLEDAI评分差异无统计学意义(P>0.05)(表3)。
2.3 实验室检查结果
12例患者中10例存在至少血两系减少(表1);3例患者谷丙转氨酶(alanine transaminase,ALT)明显升高,检测值超过正常值上限3倍;11例患者谷氨酰转肽酶(gamma-glutamyltransferase,GGT)升高,其中3例超过正常值上限2倍;12例患者总胆红素水平升高,其中2例为(18.1±12.0)μmol/L,超出正常值2倍以上。12例患者均为ANA反应阳性,其中均质型2例,斑点型10例,1例斑点型同时并发胞浆型;2例患者抗ds-DNA反应阳性;3例患者抗-Sm抗体反应阳性;2例患者狼疮抗凝物(lupus anticoagulant,LA)反应阳性,2/10例患者抗心磷脂抗体(anticardiolipin antibody,ACL)反应阳性,7例患者抗β2GP1筛查均为阴性。12例患者中10例自身免疫性肝炎抗体、抗线粒体抗体(antimitochondrial antibody,AMA-M2)和抗平滑肌抗体(antismooth muscle antibidy,SMA)反应均为阴性。
SLE-NCPH患者并发血小板减少的比例明显高于对照组,低补体血症比例明显高于对照组,差异均有统计学意义(P<0.05)。两组患者的抗体反应阳性比例差异无统计学意义,包括aPL(P>0.05)(表3)。
2.4 影像学表现
12例患者B型超声检查或CT影像均发现脾脏肿大,9/9例患者行消化道造影或胃镜检查,发现食管胃底静脉曲张。2例患者B型超声发现腹腔积液(表2)。4例患者B型超声或CT发现肝脏肿大,11例患者B型超声提示肝回声不均匀增强。9/10例患者门脉B型超声检查或增强CT提示门脉增宽,3例患者可见侧枝形成,10例接受血管检查患者均未见海绵样变。
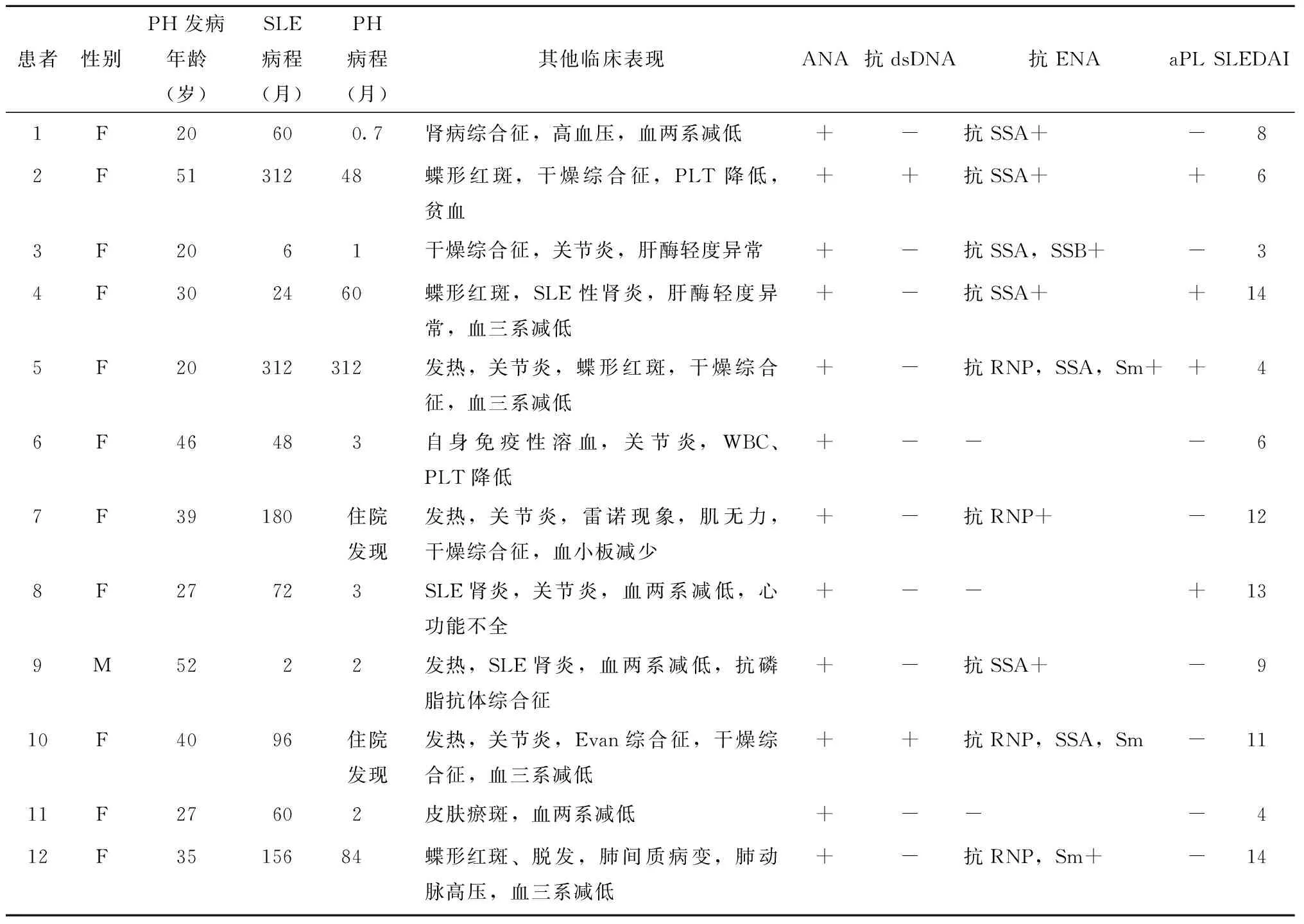
表1 12例SLE-NCPH患者的临床资料Table 1 Clinical data of 12 patients with SLE-NCPH
SLE:系统性红斑狼疮;NCPH:非肝硬化性门脉高压; ANA :抗核抗体;dsDNA :双链DNA;ENA:可溶性核抗原;aPL :抗磷脂抗体;SLEDAI:SLE疾病活动指数;ND :未查;PH:门脉高压;WBC;白细胞;PLT:血小板
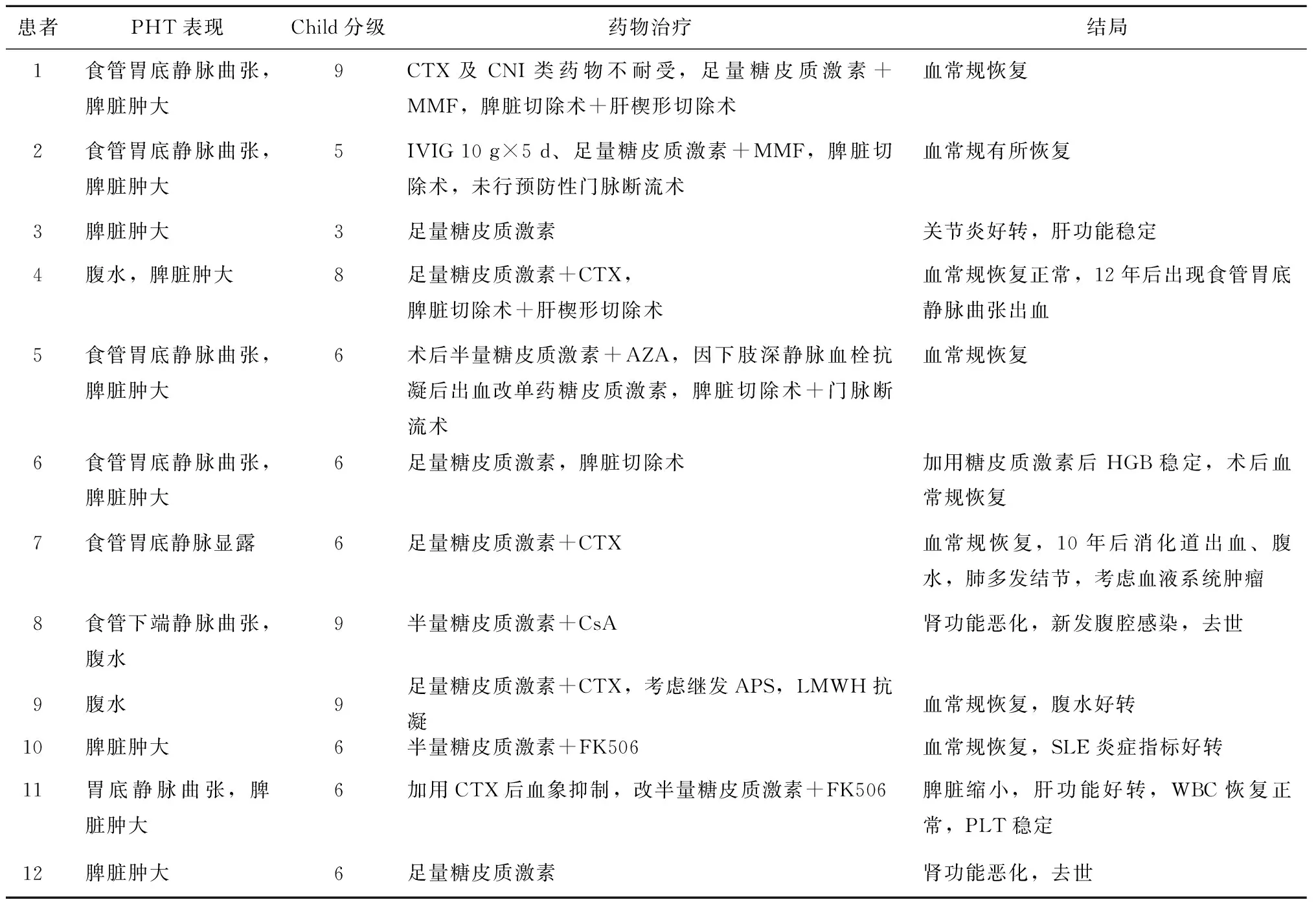
表2 12例SLE-NCPH患者的治疗及结局Table 2 Treatment and outcome of 12 patients with SLE-NCPH
SLE:系统性红斑狼疮; NCPH:非肝硬变性门脉高压; PHT:门脉高压;CTX:环磷酰胺;CNI:钙调磷酸酶抑制剂;IVIG:静脉注射用免疫球蛋白;MMF:吗替麦考酚酯;AZA:硫唑嘌呤;CsA:环孢素A;LMWH:低分子肝素;FK506:他克莫司;HGB:血红蛋白;WBC;白细胞;PLT:血小板
2.5 肝脏病理学表现
6例患者进行了肝脏组织活检,包括CT引导下肝穿刺活检3例,脾切除+肝脏活检手术3例,结果显示为结节性再生性增生者1例,肝小叶结构清楚,肝细胞浊肿;汇管区淋巴细胞浸润者4例,其中2例同时伴肝窦扩张,另1例表现为血窦扩张,部分肝细胞结节状增生,汇管区有淋巴细胞浸润。
2.6 治疗及结局
12例患者采用中剂量或大剂量糖皮质激素治疗,均未进行冲击疗法,其中4例仅用糖皮质激素治疗;8例患者采用糖皮质激素联合免疫抑制剂治疗,其中使用环磷酰胺3例,使用霉酚酸酯者2例,使用FK506者2例,使用环孢素A者1例。5例患者行脾脏切除术,其中2例同时行门脉断流术(表2)。治疗后1例腹水消失,2例肝功能好转,4例脾脏切除术后实验室检查结果恢复正常,5例药物治疗后血常规异常有不同程度的恢复。住院期间死亡患者2例,因腹腔感染、感染性休克死亡者1例,另1例则因肾功能恶化而死亡(表3)。
3 讨论
NCPH于1970年由国外医师发现,认为其属于高度异质性疾病,自身免疫性疾病也可以并发NCPH[6],SLE-NCPH国内外鲜有报道。本研究对SLE-NCPH患者的临床表现和治疗结局进行探讨,旨在临床上能够做到早期发现和早期治疗,以预防严重并发症。
本研究发现,SLE-NCPH患者临床表现多以PH引起的脾脏肿大、食管胃底静脉曲张为首要表现,并发腹水者略少,而黄疸、肝性脑病等临床表现少见[7]。本研究还发现,SLE-NCPH患者B型超声检查显示肝脏可有结节样表现,与肝硬化不易区分。近年来有研究报道瞬时弹性成像测量肝脏硬度可能有助于该病的诊断[8]。此外SLE-NCPH患者的肝脏组织病理学表现与原发性胆汁性硬化(primary biliary cirrhosis, PBC)或自身免疫性胆管炎的主要病理表现有相似之处,但PBC或自身免疫性胆管炎主要为汇管区淋巴细胞浸润和/或纤维化,这些表现均非特异性,故本组患者未诊断PBC或自身免疫性胆管炎。

表3 SLE-NCPH患者与对照组SLE患者临床表现与实验室检查比较Table 3 Comparisons of clinical manifestations and laboratory results between SLE-NCPH group and control group
SLE:系统性红斑狼疮;NCPH:非肝硬变性门脉高压; SLEDAI:系统性红斑狼疮疾病活动指数; ANA :抗核抗体;dsDNA :双链DNA;aPL :抗磷脂抗体;ACL:谷丙转氨酶; LA:狼疮抗凝物
NCPH的发病机制尚未完全阐明,Marra等[9]认为胃肠道来源的反复细菌感染诱发的感染性栓塞会引起PHT。有些慢性砷剂暴露亦可引起NCPH,可能与砷剂破坏上皮细胞,诱导肝细胞氧化应激相关[10]。此外有研究发现NCPH存在特异性T细胞免疫功能异常——外周T细胞和抑制/细胞毒T细胞的减少,Th2细胞的减少,可能与NCPH发病有关[11-12]。研究发现,NCPH患者ADAMTS13活性较肝硬变患者明显降低,Child A级的非肝硬化性PHT患者ADAMTS13的活性仅为肝硬化性PHT的30%,这可能会引起肝窦周围血小板微血栓形成,从而导致PHT[13]。
有文献报道,免疫相关疾病中NCPH可能与aPL有关,研究者发现患者狼疮抗凝物(lupus anticoagulations,LA)反应阳性患者占23%~54%,其可能机制为:(1)血小板的破坏增加血管的黏附性;(2)有抑制前列环素效应,而前列环素能防止血小板的聚集,从而保护血管内皮[14];(3)抑制激肽释放酶原[15];(4)影响抗凝血酶III的活性[16]。但本研究结果并未发现SLE-NCPH患者与对照者aPL阳性率有明显差别。
本研究发现,SLE-NCPH患者肾脏受累和神经系统受累的比例低于对照组,以往文献并无相关报道,目前尚不清楚SLE-NCPH患者其他重要脏器较少受累的原因。推测多数PHT患者起病隐匿,病程较长,如无其他重要脏器受累对于SLE原发病的治疗效率不高,可能导致这类患者肝脏病变缓慢进展,最终出现PHT。
NCPH属于良性疾病,其治疗过程中最重要的是静脉曲张出血急性期的处理及二级预防[17],其他应关注脾脏肿大及脾功能亢进的问题。如果脾功能亢进及食管胃底静脉曲张能得到良好控制,患者5年生存率可达到100%[18],但是针对SLE患者的单纯药物治疗对PHT并发症的控制效果不佳。此外,这些患者多数肝脏合成功能尚好,且与肝硬化引起PHT的机制不同,故单独应用非选择性β受体阻滞剂对这类患者的效果亦不佳[19]。急性期食管胃底静脉曲张出血患者采用内镜下手术治疗多有效,可对疾病的二次出血发挥预防作用[20]。如内镜下治疗静脉曲张效果不佳可采用经颈内静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS),但对NCPH患者的有效性需要进一步观察[20]。本组患者中早期行脾脏切除的1例患者规律用药12年后出现食管胃底静脉曲张,经内镜下注射硬化剂后好转。本研究中共5例患者行脾脏切除手术,对血三系,尤其是血小板的恢复有很大帮助。
本研究仍存在以下局限性:(1)患者病例数少,无法全面概括此类患者的临床及实验室特点;(2)本组仅获取6例患者的肝脏组织标本进行组织病理学检查,因为是回顾性研究,因此对这些患者的肝脏病理改变及其病理机制的认识尚有不足,也未能对病因有提示的一些细胞因子进行检测。
SLE并发NCPH的原因目前尚不清楚,仍需进一步研究。糖皮质激素和免疫抑制剂的应用对改善PHT效果不显著。SLE并发NCPH患者的预后多与PHT并发症有关,积极治疗PHT可改善患者的临床症状。
