肝细胞亲和色谱法体外筛选大黄降脂活性成分研究*
2018-09-05陈艺丹王妮华
陈艺丹,周 律,王妮华,范 辉,2**,郭 姣
(1.广东药科大学中医药研究院,国家中医药管理局高脂血症“调肝降脂”重点研究室/脂代谢三级实验室,广东省代谢性疾病中医药防治重点实验室 广州 510006;2.广东药科大学药学院 广州 510006)
大黄(Rheum officinale Baill.)为蓼科植物大黄的干燥根或者根茎,其归脾、胃、大肠、肝、心包经,功能主治泻下攻积,清热泻火,凉血解毒,逐瘀通经,利湿退黄[1]。现代研究表明,大黄有抗菌、抗肿瘤、抗高脂血症、降低血压、健胃、利胆、保肝、强心、消炎、调节免疫等作用[2]。
据研究[3],大黄中蒽醌类成分主要有芦荟大黄素、大黄酚、大黄素、大黄素甲醚和大黄酸(图1)。王志旺等[4]对不同产地大黄的降脂药效进行研究,均可不同程度地改善高脂血症大鼠血脂代谢、降低血液粘稠度
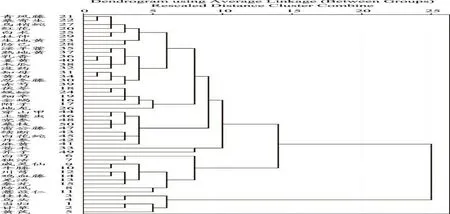
图1 大黄中蒽醌类化合物Fig.1 rhubarb anthraquinones
并提高抗氧化作用。其中大黄酸具有抗氧化、保护肝细胞、调节糖脂代谢等多种药理活性,并且在治疗糖尿病肾病等疾病及协同抗肿瘤方面表现突出,成为研究的热点[5,6]。研究发现[7],大黄酸改善脂肪肝疾病可以进行负能量平衡和肝脂肪生成的调节,这一发现拓展了大黄酸的药理作用。本课题联合体外肝细胞脂肪变性模型和亲和色谱法,以大黄提取液为研究对象,筛选大黄蒽醌类调脂活性成分,寻找大黄酸降脂的科学证据。
1 材料
1.1 主要仪器
Waters Alliance2695高效液相色谱仪,Waters2998二极管阵列检测器,Empower色谱数据处理系统,色谱柱:DIONEX Acclaim120(5 μm,4.6×250 mm);Agilent 1290 InfinityⅡ液相系统联用Agilent 6545 QTOF-MS液质联用仪,色谱柱:ACQUITY UPLC BEH C18色谱柱(2.1×150 mm,1.7 μm);SW-CF-1FD超净台(上海博迅实业有限公司医疗设备厂);CO2培养箱(美国Thermo Scientific公司);倒置显微镜(日本Olympus公司);Mithras LB 940酶联免疫检测仪(德国Berthold Technologies公司);5180R低温高速离心机(德国Eppendorf公司);0.22 μm溶剂过滤器(北京津腾仪器厂);杯式超声波细胞粉碎机(宁波新芝生物股份有限公司,Scientz98);HGC-24A氮吹仪(天津市恒奥科技发展有限公司);KQ5200E型台式机械超声波清洗器(东莞市科桥超声波设备有限公司);PURELAB Ultra GE MK2纯水仪(ELGA,High Wycombe,UK);BT224s型万分之一电子天平(北京赛多利斯科学仪器有限公司)。
1.2 药物与试剂
大黄(批号160101)购自于广州市诚济药业有限公司;芦荟大黄素对照品(批号X0550050)、大黄酸对照品(批号G1110010)、大黄素对照品(批号G1270010)、大黄酚对照品(批号F1390025)、大黄素甲醚对照品(批号H5310010)均购自于上海安谱科学仪器有限公司;DMSO购自于美国Sigma公司;色谱纯甲醇(美国Honeywell公司&德国Merck公司);实验用水为超纯水;其余试剂为分析纯,购自于天津市科密欧化学试剂有限公司。
高糖DMEM培养基购自于美国GIBCO公司(批号129007);胰酶购自于北京鼎国昌盛生物技术有限公司(批号89010440);血清购自于赛默飞世尔;油酸钠、棕榈酸钠购自于美国Sigma公司;三酰甘油(TG)试剂盒购自于南京建成生物工程有限公司;BCA蛋白测定试剂盒购自于北京康为世纪生物科技有限公司。
2 实验方法
2.1 对照品、供试品溶液的制备
2.1.1 对照品溶液配制
取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,精密称定,加DMSO溶解并用甲醇稀释定容至1.0 mL,摇匀,作为对照品贮备液。
2.1.2 供试品溶液配制
称取大黄粉末(过四号筛)适量,精密称定,置具塞锥形瓶中,精密加入适量甲醇,称定重量,加热回流1 h,放冷,在称定重量,用甲醇补足减失的重量,摇匀,滤过。精密量取续滤液,置烧瓶中,挥去溶剂,加8%盐酸溶液适量,超声处理2 min,再加适量三氯甲烷,加热回流1 h,放冷,置分液漏斗中,分取三氯甲烷,酸液再用三氯甲烷提取3次,合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇使溶解,转移10 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得[1]。
2.2 HepG2细胞培养
采用含10%FBS的DEME培养液,将HepG2人肝癌细胞株放置于37℃、5%CO2、饱和湿度培养箱内培养,待细胞生长至约80%,用0.25%胰酶消化细胞,进行传代,每2-3天传代一次。
2.3 大黄蒽醌类成分降脂活性试验
调整HepG2细胞悬液浓度,以每孔2×105的细胞个数接种于6孔板,正常培养48 h,当细胞达到对数生长期,分组给药:正常对照组给予含10%FBS的完全培养基、模型组给予0.5 mmol·L-1FFA培养基(油酸钠/棕榈酸钠,2:1,0.5 mmol·L-1)、给药组给予含不同浓度大黄(25.0,50.0,100.0 μg·mL-1)以及不同浓度芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚(1.0,5.0,25.0 μg·mL-1)的0.5 mmol·L-1FFA培养基,每组做6个平行孔。
24 h后,吸弃孔内培养液,PBS洗涤1-2遍,胰酶消化制成细胞悬液,将各孔细胞悬液平均分成两份(细胞A和细胞B),4℃ PBS洗涤细胞两次,4℃,1 000 r/min离心5 min,弃上清,细胞A管加入100 μL异丙醇,细胞B管中加入100 μLPBS,超声波细胞粉碎机裂解细胞,再以4℃,1 3500 r/min离心10 min,收集A和B管上清液,用三酰甘油(TG)试剂盒测定细胞A管上清中TG含量,用BCA蛋白定量试剂盒测定细胞B管中蛋白含量,换算成TG/蛋白含量的比值。
2.4 高效液相色谱法
2.4.1 色谱条件
色谱柱:DIONEX Acclaim120(5 μm,4.6×250 mm)用十八烷基硅烷键合硅胶为填充剂;流动相:甲醇-0.1%磷酸溶液(85∶15),等度洗脱;流速:1.0 mL·min-1;检测波长:254 nm;柱温:30℃;进样量:10 μL;理论塔板数按大黄素峰计算不低于3000;在此色谱条件下大黄蒽醌类中各成分可以完全分离。
2.5 液质联用LC-Q-TOF-MS法
2.5.1 色谱条件
ACQUITY UPLC BEH C18色谱柱(2.1x150 mm,1.7 μm),流动相0.1%甲酸水(A)-甲醇(B),梯度洗脱(0 min,40%B;0~3 min,40%~100%B;3~5 min,100%B;5~5.1 min,100%~40%B;5.1~8 min,40%B),流速0.3 mL·min-1,柱温30℃,进样量2 μL。
2.5.2 质谱条件
Agilent 6545 LC-Q-TOF-MS液质分析系统,ESI离子源,负离子模式,全扫描一级和二级质谱,质谱扫描质量范围为100-1500 m/z,雾化气压力35 psi,干燥气流速8 L·min-1,干燥气温度320℃,毛细管电压3 500 V。
2.6 大黄蒽醌类与HepG2肝癌细胞株特异性结合试验
取对数生长期细胞(即将长满)6皿,PBS液洗涤2遍,除去细胞代谢物;3皿加入不含药DMEM培养液作为空白对照,另3皿加入100 μg·mL-1大黄蒽醌类溶液,8 mL/皿,37℃,CO2培养箱孵育24 h。24 h后,细胞形态良好,收集上清液,过0.22 μm滤膜,按2.4项下色谱条件进行HPLC分析,PBS液洗涤2遍,胰蛋白酶消化,收集细胞。
用5 mLPBS液/次洗涤细胞,离心1 000 r/min×5 min,共洗涤5次,留末次洗涤液,过0.22 μm滤膜,所得滤液按2.4项下色谱条件进行分析。
将收集得到的细胞转移至1.5 mL离心管中,加入1 mL75%乙醇吹打均匀,超声波细胞粉碎机裂解细胞,高速离心(10 000 r/min×l0 min),取上清液,氮气吹干,0.5 mL甲醇复溶,高速离心(10 000 r/min×l0 min),取上清液,按2.4项下色谱条件进行HPLC分析。
2.7 大黄酸、大黄素对照品与HepG2肝癌细胞株特异性结合试验
空白组、100 μM大黄酸组和100 μM大黄素组,各平行3份,按2.6项进行特异性结合试验,按2.5项下条件进行液质分析。
3 实验结果
3.1 大黄蒽醌类成分降脂活性验证试验
不同浓度的大黄提取液(12.5,25.0,50.0,100.0 μg·mL-1),不同浓度芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚(0.2,1.0,5.0,25.0 μg·mL-1)与FFA共同作用于HepG2细胞24 h。在不同浓度范围内,细胞内TG含量随浓度的增加呈剂量依赖性减少,与模型组比较,各给药组均有显著性差异(P<0.05)(图2),且呈剂量依赖性,具有统计学意义。
3.1 大黄蒽醌类成分与HepG2细胞株的特异性结合的HPLC分析
采用HPLC法分别分析大黄原液、大黄加药培养基、大黄作用后的HepG2细胞提取液、最后一次洗脱液和空白对照,在254 nm检测波长处,通过比较大黄作用细胞提取液和大黄原液,发现细胞提取液中大黄与细胞特异性结合成分主要有4个,分别为芦荟大黄素、大黄素、大黄酚、大黄素甲醚四个化合物,而大黄酸未检测到。在254 nm检测波长下,空白对照和最后一次洗脱液并无响应,证明方法专属性较好,在最后一次洗涤细胞的洗脱液中已无任何可积分成分,说明已排除非特异性结合成分的影响(图3)。
3.2 大黄酸和大黄素成分与HepG2细胞株的特异性结合的液质分析
采用液质联用方法分析大黄酸和大黄素成分与HepG2细胞株的特异性结合,大黄酸和大黄素的检测离子对分别是283.0/239.0,269.0/225.0 m/z(图4B、图4C)。通过LC-MS全扫描分析大黄酸和大黄素的对照品、细胞上清以及细胞提取液,发现大黄素细胞给药后的细胞提取液中含有大黄素,而大黄酸细胞给药后细胞提取液中没有大黄酸,但发现含有269.0 m/z的碎片离子(图4A),与标准品比较,发现不是大黄素,可能是芦荟大黄素。
4 讨论
本研究采用HepG2细胞系,以游离脂肪酸(油酸钠/棕榈酸钠,2∶1,0.5 mmol·L-1)诱导肝细胞脂肪变性模型评价大黄五种蒽醌类成分的降脂效应[8]。模型组三酰甘油含量较正常组的高5倍,成功建立体外肝细胞脂肪变性模型。大黄及五种蒽醌类成分均具有显著体外降脂活性,与文献报道一致[9-11]。
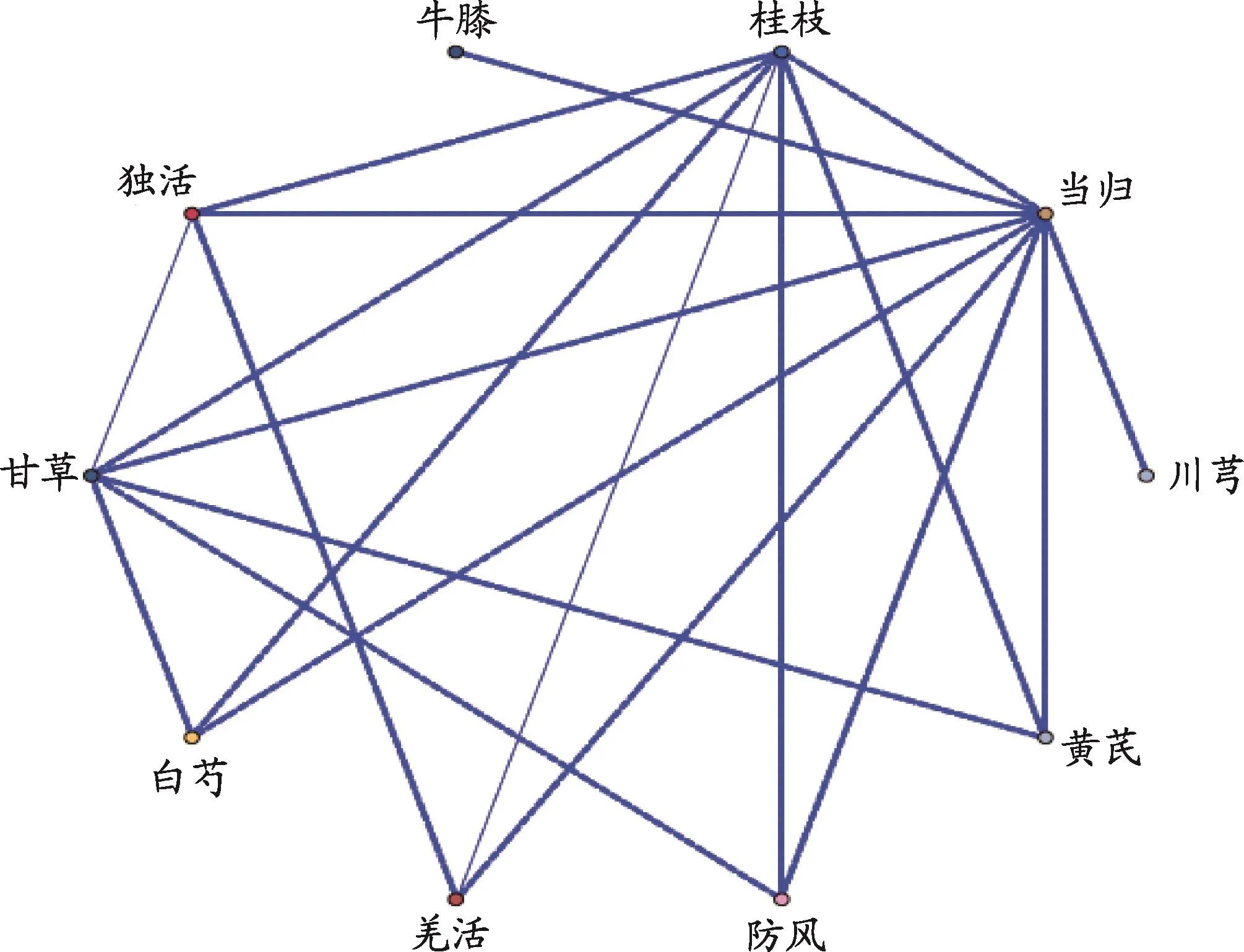
图2 大黄提取液(A)、芦荟大黄素(B)、大黄酸(C)、大黄素(D)、大黄酚(E)和大黄素甲醚(F)对肝细胞三酰甘油蓄积的影响Fig.2 The effect of rhubarb(A),aloe-emodin(B),rhein(C),emodin(D),chrysophanol(E)and physcion(F)on TG accumulation in HepG2 cells
本实验室已建立肝细胞亲和色谱法用于筛选肝细胞为靶细胞的调脂中药药效物质基础[8,12],利用该模型对大黄蒽醌类成分进行亲和筛选。结果表明,与大黄原液、标准品保留时间和光谱特征比较,细胞亲和液中检测到四种肝细胞特异性亲和成分,分别为芦荟大黄素、大黄素、大黄酚、大黄素甲醚,未检测出大黄酸。因大黄酸体外降脂活性显著,分析大黄酸的降脂途径可能与其他蒽醌类成分不同。
为了观察大黄酸的体外细胞作用特点,采用高灵敏度和高分辨率的LC-Q-TOF-MS进行分析,以大黄酸和大黄素标准品细胞给药后分别验证,液质中检测离子对分别是大黄酸283.0/239.0和大黄素的269.0/225.0 m/z,结果发现大黄素标准品细胞亲和液中能检测到大黄素(269.0/225.0 m/z),表明大黄素可能是原型形式与细胞亲和。而大黄酸标准品细胞亲和液中大黄酸(283.0/239.0 m/z)仍未检出。但检测到离子碎片(269.0 m/z),因为离子碎片(269.0 m/z)与大黄素和芦荟大黄素一致,通过与大黄素标准品和芦荟大黄素标准品保留时间比较,判断不是大黄素,可能为芦荟大黄素(图4A)。另外,根据结构比对,大黄酸与芦荟大黄素均为蒽醌母核上3位取代基分别为-COOH和-CH2OH,而大黄素为6位甲基取代,3位OH取代(图1)。综上化学结构推测和实验结果分析,大黄酸可能存在体外细胞代谢,经Ⅰ相还原反应转化成芦荟大黄素。
图3 大黄蒽醌类成分与HepG2细胞特异性结合HPLC图Fig.3 Chromatograms of rhubarb anthraquinones treated with HepG2 cells

图4 大黄素和大黄酸LC-MS图Fig.4 Chromatograms of emodin and rhein
目前报道的大黄酸的代谢途径及产物主要是葡萄糖醛酸化,硫酸酯化,甲基化。我们首次在细胞层面发现大黄酸可能具有细胞内转化为芦荟大黄素的细胞亲和代谢行为。大黄酸单体细胞给药24 h后肝细胞亲和液中未检测到大黄酸,但具有显著体外降脂效应,可能的原因是大黄酸转化为芦荟大黄素继续发挥着降脂效应。
总之,本研究通过肝细胞脂肪变性模型联合肝细胞亲和色谱法筛选和评价大黄蒽醌类肝细胞降脂活性成分,发现芦荟大黄素、大黄素、大黄酚、大黄素甲醚以原型的形式体外肝细胞降脂,而大黄酸可能以体外细胞代谢为芦荟大黄素形式降脂,本研究为中药活性成分筛选提供思路,为大黄蒽醌类调脂药物开发提供证据。
