中药标准品对人肺癌耐药细胞A549/DDP的逆转效果研究*
2018-09-05杨新阶王婧筱迟笑怡迟佳琦刘铜华胡凯文
杨新阶,王婧筱,王 琳,迟笑怡,迟佳琦,周 天,刘铜华,胡凯文**
(1.北京中医药大学 北京 100029;2.北京中医药大学肿瘤研究所 北京 100029;3.北京中医药大学东方医院 北京 100078;4.北京中医药大学中医养生学教育部重点实验室 北京 100029)
肺癌是全世界发病率最高的恶性肿瘤,其发病率和死亡率目前仍居高不下[1,2]。尽管以EGFR-TKIs为代表的靶向药物极大地改善了肺癌的治疗和预后,但化疗在临床治疗中仍然占据十分重要的地位,而化疗耐药的发生是导致临床治疗失败、疾病进展和预后不良的主要原因[3,4]。
肿瘤耐药发生的机制复杂,包括ATP结合盒转运体(ATP-Binding Cassette Transporters,ABCs)高表达、肺耐药相关蛋白(Lung resistance-related protein,LRP)表达上调、谷胱甘肽S转移酶(Glutathione-S-transferases,GSTs)作用增强以及DNA拓扑异构酶II(DNA topoisomerase II,Topo II)低表达等[5]。
在上述机制中,ABC的药物泵出作用最为重要,其逆转剂研究最为深入[6,7]。目前,第三代逆转剂Tariquidar专门针对ABC蛋白跨膜片段的半胱氨酸交联区并发挥作用[8]。据报道,A549/DDP耐药的发生可能与ABC家族中ABCB1和MDR1基因的高甲基化有关[9]。其产物为耐药相关的ABC蛋白,均为Tariquidar作用靶点。
Tariquidar开发伊始,因其在体内外试验的中良好耐受性和疗效而被寄予厚望[10]。但其临床试验均以失败告终[11]。肿瘤耐药的逆转药物开发进入了平台期。有数据显示,1999年至2008年的18年间,美国FDA批准上市进入临床的小分子化合物类药物中,36%为天然存在的化合物及其衍生物[12]。中药体系庞大,涵盖物质广泛,逆转肿瘤耐药的有效成也存在于中药之中[13]。
我们挑选既往报道具有逆转肿瘤耐药作用的5种中药标准品:川芎嗪、苦参碱、盐酸小檗碱、北豆根碱(蝙蝠葛碱)和冬凌草甲素等(表1)。这些标准品对白血病耐药细胞、胃癌耐药细胞、乳腺癌耐药细胞等均具有一定的逆转效果,但对于肺癌耐药细胞株的逆转作用尚不明确。本研究以人类肺腺癌耐顺铂细胞株A549/DDP为模型,研究其对肺癌耐药的逆转效果,为解决临床肺癌耐药问题、开发新型耐药逆转剂提供初步依据。
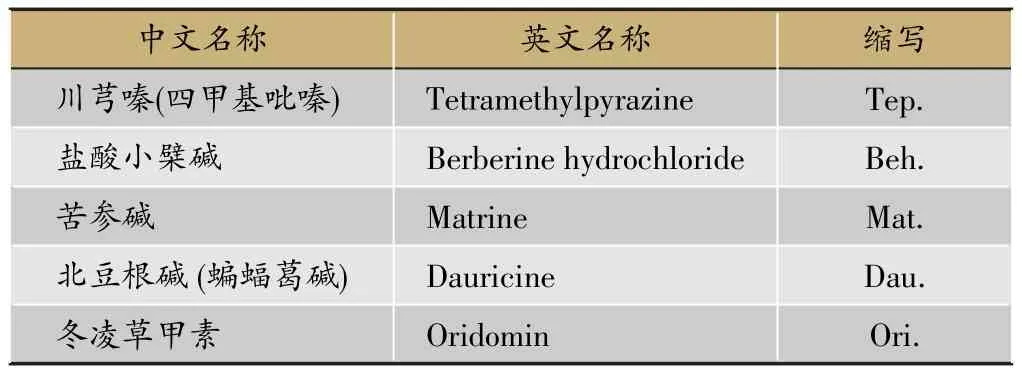
表1 实验选择的中药标准品
1 实验仪器和材料
1.1 实验仪器
HERACell 150i恒温培养箱(Thermo scientific,USA),HDLDL-CJ-2ND I型洁净工作台(北京东联哈尔仪器制造有限公司),Olympus IX7型倒置显微镜(Olympus,Japan),Sigma 3K15型低温高速离心机(Sigma,USA),Promega E9032型酶标仪(Promega,USA),Sartorius R200D 型 分 析 天 平(Sartorius,Germany),DZKW-4型电子恒温水浴锅(北京中兴伟业仪器有限公司)。
1.2 实验材料
RPMI Medium 1640培养基(Invitrogen,USA),胎牛血清(Gibco,USA),TRYPSIN-EDTA 胰酶消化液(Invitrogen),青霉素-链霉素混合液(Invitrogen,USA),磷酸盐缓冲液(PBS,Invitrogen,USA),25cm2细胞培养瓶(Corning,USA),15mL离心管(Corning,USA),Cell Counting Kit 8(CCK-8,Dojindo,Japan,批号:CK04-500)等。
1.3 药物与细胞
顺铂(DDP,Bioruler,USA,批号:RH66694-100 mg),Tariquidar(Selleck,USA,批 号 :S8082),川 芎 嗪(Bioruler,USA,批号:RB14186-20 mg),盐酸小檗碱(Bioruler,USA,批 号 :RB11146-20 mg),苦 参 碱(Bioruler,USA,批号:RB10662-20 mg),蝙蝠葛碱(Bioruler,USA,批号:RB15517-20 mg),冬凌草甲素(Bioruler,USA,批号:RB13949-20 mg)
人肺腺癌细胞株A549,购自ATCC上海细胞库,A549耐顺铂细胞药株(A549/DDP)购自北纳联创生物技术研究院(BeNa Culture Collection,北京),该细胞株为A549细胞通过阶梯诱导法获得,历时12个月。以上细胞均储存于液氮存储系统之中。
2 实验方法
2.1 细胞培养
将储存于液氮中的A549和A549/DDP细胞迅速置于37℃水浴锅中5 min内复苏。立即移入含有10%胎牛血清、1%青霉素-链霉素的1 640完全培养基中,反复吹打混匀,4℃,1 000rpm离心5 min后弃上清,加入5 mL 1 640完全培养基后混匀,移入25 cm2培养瓶,置于37℃,5%CO2恒温培养箱中培养。观察细胞生长情况,待A549细胞融合度达到80%以上时,用PBS清洗2次,加入1 mL胰蛋白酶消化,镜下观察细胞变圆时加入2 mL 1 640完全培养基停止消化,收集细胞置于15 mL离心管中,4℃,1 000 rpm离心5 min后弃上清,培养瓶传代培养。A549/DDP细胞融合度达到80%时,更换含5.67 μM(μ2 g/ml)DDP的完全培养液,部分细胞死亡漂浮,更换培养基继续培养,以维持A549/DDP对顺铂的耐药性。根据细胞生长情况进行传代,取对数期细胞进行实验,A549/DDP细胞实验前用不含DDP的培养基培养3天。
2.2 细胞标准曲线
为确定96孔板每孔细胞接种数量、贴壁孵育时间、加入CCK-8后的O.D.值读数时间等,需制作A549、A549/DDP细胞的增值标准曲线。将2株细胞分别梯度浓度接种于96孔板中(周围一圈孔加入PBS),设计梯度为:10 000、5 000、2 500、1 250、625/孔,贴壁生长24 h后加入CCK-8,间隔读取450 nm处的吸光值,间隔时间设计为15 min。分别以时间(min)为横轴、O.D.(450 nm)为纵轴制作曲线,以细胞浓度为横轴、O.D.(450 nm)为纵轴制作标准曲线,以此确定适宜的细胞接种数量和O.D.值读数时间。
2.3 A549/DDP耐药指数测定
取对数生长期的A549、A549/DDP细胞,按照每孔5 000个接种于96孔板中,培养箱贴壁生长24 h,加入梯度浓度含顺铂的1 640培养基。顺铂设计5个梯度浓度(每个浓度5个复孔):A549细胞100 μM、50 μM、25 μM、12.5 μM、6.25 μM;A549/DDP 细胞 2 560 μM、1 280 μM、640 μM、320 μM、160 μM。培养24 h后,每孔加入10 μL CCK-8,恒温箱孵育60 min,读取450 nm处O.D.值。根据CCK-8试剂盒说明计算细胞的活性及半数抑制浓度(Half inhibitory concentration,IC50)IC50。
耐药指数=IC50(A549/DDP)/IC50(A549)。
2.4 A549/DDP对中药标准品耐受实验
既往研究报道[14],有机溶剂DMSO体积浓度<0.1%或AEA体积浓度<1%时,A549细胞增殖未见明显受益。但A549/DDP细胞对其耐受性并不明朗,本研究取0.001%、0.01%、0.1%、1%、10%五个体积浓度梯度的二甲基亚砜(DMSO)和无水乙醇(AEA),用CCK8法确定A549/DDP对其耐受情况。
将选定的中药标准品溶解于不含血清的1 640培养基中,不溶于水的标准品加入DMSO或AEA助溶。等比梯度浓度配制工作液。取对数期A549/DDP细胞,5 000/孔接种于96孔板中,贴壁生长24 h后给予梯度浓度中药标准品溶液,恒温培养箱孵育24h,加入CCK8溶液,37℃孵育60 min后读取450 nm处吸光值。回归分析计算中药标准品对A549/DDP细胞的5%抑制浓度(5%inhibitory concentration,IC5)、10%抑制浓度(10%inhibitory concentration,IC10)以及 IC50。选取IC5作为逆转A549/DDP细胞耐药的工作浓度。
2.4 中药标准品逆转耐药实验
选取对数期A549/DDP细胞接种于96孔板中,贴壁后加入含有工作浓度中药标准品的1 640完全培养基,37℃恒温孵育24 h,弃去含药培养基,加入含梯度浓度顺铂的1 640培养基,孵育24 h后进行CCK8实验,计算IC50,对比逆转实验前后IC50值,计算逆转指数(Reversal Index)。除中药标准品之外,本研究以Tariquidar为阳性对照药,其工作浓度为1 μM,干预方法及CCK8实验同上。
2.5 数据分析方法
数据处理采用GraphPad Prism 7.0分析并作图,实验数据以平均数加减方差(±s)表示。多组比较采用单因素方差分析,两组间比较采用LSD检验;P<0.05有统计学差异,P<0.01有显著差异。
3 结果
3.1 标准曲线
A549/DDP是在A549细胞系基础上通过阶梯诱导传代获得的细胞株,经过长时间培养,有老化趋向,其代谢较A549细胞略缓慢(图1a)。根据标准曲线及吸光值,确定后续实验中96孔板接种细胞数目为5 000/孔,CCK8实验读数时间为60 min(图1b,c)。
图1 细胞增殖标准曲线
3.2 耐药指数
DDP对A549细胞的IC50为32.71±2.8 μM,DDP对A549/DDP 细胞的 IC50为 1040±30.1 μM,耐药指数(resistance index,RI)为31.79(图2)。
3.3 A549/DDP对中药标准品耐受
实验结果显示,有机溶剂助溶,DMSO的体积百分比<0.1%或者AEA的体积百分比<1%时,A549/DDP细胞增殖未见明显受抑(图3a)。故中药标准品溶液配制时,应将有机助溶剂的体积百分比控制在此范围之类,以免影响实验结果。
研究发现,A549/DDP细胞对川芎嗪(Tep.)和苦参碱(Mat.)耐受良好,高浓度下(500 μM)仍未见明显生长受抑,均选取100 μM作为工作浓度,其余中药标准品对A549/DDP细胞增殖的抑制效果(图3b)及确定的工作浓度见下表2。
3.4 逆转A549/DDP顺铂耐药
工作浓度中药标准品各组IC50与A549/DDP组比较具有显著性差异,说明其对A549/DDP细胞的耐药性具有不同程度的逆转作用。阳性对照药物Tariquidar(Tari.)的逆转效果与既往文献报道相近。(表3、图4)
图2 细胞对DDP的耐受情况

图3 A549/DDP对DMSO、AEA的耐受(a),盐酸小檗碱、北豆根碱(蝙蝠葛碱)和冬凌草甲素对A549/DDP细胞增的抑制作用(b)

表2 A549/DDP对中药标准品的耐受情况
4 讨论
肿瘤耐药的发生是多因素、多机制共同作用的结果[6]。主要包括:增强细胞膜上ATP依赖的泵蛋白(ABC蛋白)的表达,将细胞内的药物泵出;改变肿瘤细胞的药物吸收特性,减少抗肿瘤药物吸收;增加抗肿瘤药物的代谢速度;改变抗肿瘤药物的靶点;通过改变细胞周期检测点和影响凋亡通路阻碍细胞的死亡。Tariquidar能特异性地拮抗ABC转运通道,并在转录后水平下调耐药相关ABC的表达[15]。尽管如此,临床上肿瘤化疗耐药的现状仍旧未能得到丝毫的缓解。本实验中,Tariquidar对A549/DDP具有逆转效果(图4),提示其耐药机制可能与ABC高表达相关。而Tariquidar逆转以后的A549/DDP细胞仍具有一定的顺铂耐受性,说明其耐药性的发生可能是多因素作用的结果。
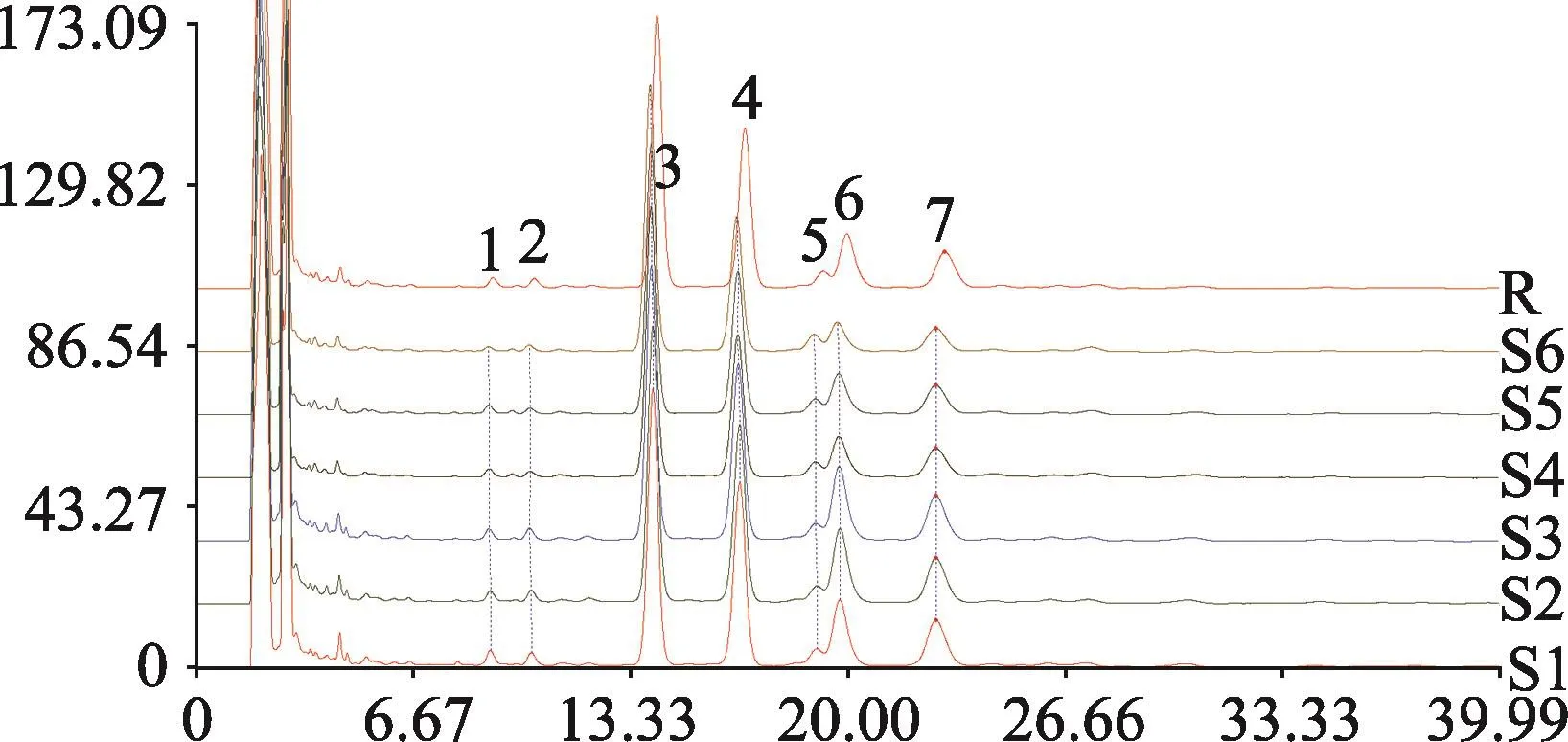
图4 中药标准品及阳性逆转剂对A549/DDP耐药逆转效果对比。
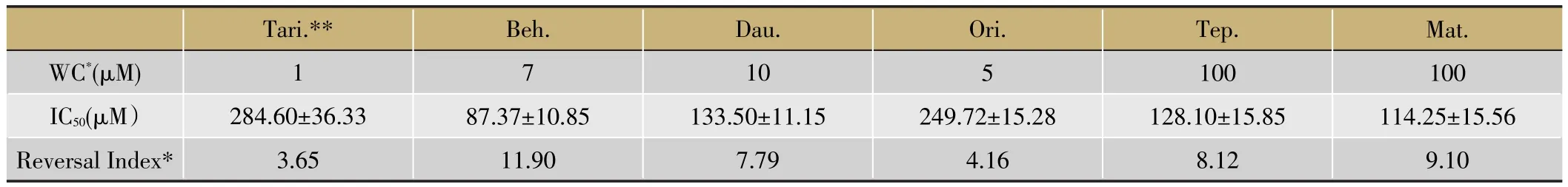
表3 中药标准品及阳性对照药物对A549/DDP耐药性的逆转效果
中药及复方被报道具有逆转肿瘤耐药活性由来已久[13,16]。川芎嗪能逆转血液肿瘤细胞K562和肝癌细胞HepG2对阿霉素的耐药性,其作用机制与川芎嗪下调ABCB1的表达有关[17,18];苦参碱通过抑制P-gp蛋白表达、降低P-gp ATP酶活性来增加阿霉素在细胞内的蓄积,逆转膀胱癌细胞BIU-87和乳腺癌细胞MCF-7对阿霉素的耐受[19,20];盐酸小檗碱不仅能通过下调P-gp的表达逆转血液肿瘤细胞K562的耐药性,而且还能通过下调Pho P和Pho R基因的表达逆转结核杆菌的细菌耐药性[21,22];北豆根碱能通过抑制自噬溶酶体的降解增强Hela细胞对喜树碱的敏感性[23];冬凌草甲素通过下调MDR1基因及P-gp的表达逆转胃癌细胞SGC7901、乳腺癌细胞MCF-7和血液肿瘤细胞K562的耐药性[24-25]。但是,这些药物对肺癌耐药的逆转作用及机制尚不明确。
本实验中所用细胞模型A549/DDP是在A549细胞系基础上,用DDP浓度递增法经过长时间诱导所获得。相比较于亲代细胞,A549/DDP在代谢和增殖速度上呈现出明显的老化趋势(图1)。经过长期的顺铂刺激,A549/DDP的耐药性也明显强于A549细胞系(P>0.01)(图2)。本实验所选中药标准品中,川芎嗪和苦参碱的细胞毒性较弱,其余三种标准品均表现出剂量依赖的细胞毒性。中药标准品作用于A549/DDP的结果显示,所遴选的5种中药标准品均能有效逆转A549/DDP细胞的耐药性(与A549/DDP模型比较,P>0.01)。为今后解决临床肺癌耐药、为开发出新的耐药逆转剂提供线索。efflux pump inhibitor.Expert Rev Anticancer Ther,2007.7(4):p.447-59.
