基于GEO数据库发现促前列腺癌转移基因SERPINE1及其临床意义
2018-09-05岳俊涛孙慧敏雷志杰
岳俊涛, 孙慧敏,雷志杰, 邵 晨,
(1.第四军医大学第一附属医院泌尿外科,陕西西安 710032;2.厦门大学附属翔安医院泌尿外科,福建厦门 361100; 3.第四军医大学西京消化病院,陕西西安 710032)
在全球范围内,前列腺癌发病率位居男性肿瘤第2位[1]。中国是前列腺癌发病率较低的国家,但随着经济水平的发展及社会老龄化程度的加重,其发病率呈逐年上升趋势[2]。对于患原位前列腺癌的患者来说,其5年生存率几乎可达99%,然而一旦其发生远处转移,5年生存率则迅速下降至29%[3]。由于诊疗水平的限制,在我国有80%的患者在初次诊断时就已经发生了远处转移,对我国男性健康造成了很大威胁[4]。因此,探究前列腺癌转移的机制,建立进一步的预防措施,对于提高患者生存率是至关重要的。
上皮间质转换(epithelial-mesenchymal transition,EMT)是正常的生理过程,其在脊椎动物的胚胎发育及维持组织的形态方面意义重大[5],最近的研究表明,EMT在前列腺癌的发生、发展、转移过程中也起到了重要作用[6]。EMT的过程伴随着一些重要的分子标志的改变,主要的如上皮型钙黏蛋白(epithelial cadherin,E-cadherin)的降低,神经型钙黏蛋白(neural cadherin,N-cadherin)、Twist家族转录因子1(twist basic helix-loop-helix transcription factor 1,Twist1)及锌指蛋白E-box结合同源蛋白1(zinc finger e-box binding homeobox 1,ZEB1)的上调等[7]。 在这些分子改变的基础上,肿瘤细胞逐渐改变其形态与极性,转移能力与侵袭能力也发生了变化。在许多前列腺癌细胞系的体内体外实验中已证明,拥有更多间质特征的肿瘤细胞同时也拥有更强的细胞侵袭性及远处转移能力[8]。
在已经构建了前列腺癌细胞系PC3的循环肿瘤细胞(PC3-circulating tumor cell,PC3-CTC)的基础上,本研究主要通过探究EMT相关分子在两种不同转移能力的前列腺癌细胞中的表达差异,并结合美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI) 的高通量基因表达数据库(gene expression omnibus,GEO)分析相关分子与前列腺癌患者疾病特征的相关性,寻找到有潜在研究意义的新分子,为进一步阐明前列腺癌转移机制,寻找新的抗转移靶点奠定基础。
1 材料与方法
1.1材料PC3细胞购自美国模式菌种保藏中心(American Type Culture Collection,ATCC),PC3-CTC的获得参见之前发表过的文章[9]。两种细胞均培养于RPMI-1640培养基(购自Gibco.Life Technologies公司),培养基加入10%胎牛血清(购自杭州四季青公司),置于 37 ℃,5%二氧化碳培养箱中培养。
1.2实时定量聚合酶链式反应(polymerasechainreaction,PCR) 使用RNeasy Plus Mini Kit从PC3及PC3-CTC细胞中提取RNA,并使用RT2 First Strand Kit将RNA反转录为cDNA,以两种细胞的cDNA为模板检测EMT相关基因的表达情况。以上试剂及Human EMT PCR 芯片、 RT2 SYBR Green ROX qPCR Mastermix均购自Qiagen公司,所有的操作步骤按照试剂说明书进行。结果检测使用7 500 Fast 实时定量PCR仪检(购自Applied Biosystems公司),实验重复3次。使用SABioscience网上数据分析工具分析所得到的Ct值,并做图。(www.SABiosciences.com/pcrarraydataanalysis.php)
1.3GEO数据获取及数据分析研究所采用的的数据来自于NCBI的GEO数据库中前列腺癌基因表达数据集GSE16560的series matrix文件,所有281例前列腺癌患者的疾病特征及随访信息也同时包含在同一文件中。该数据集采用的芯片平台是美国illumina公司的GPL5474(Human 6k Transcriptionally Informative Gene Panel for DASL)。该平台包含约6 144个人类蛋白的基因片段。患者按照Gleason评分(6分、7分、8分、≥9分)、肿瘤状态(转移与未转移)分组分别对基因表达进行分析。采取基因表达量的中位数作为截断值来将患者分为低表达组与高表达组进行生存期分析,0表示截止随访时间内存活,1表示死亡。使用Graphpad软件进行作图及统计学分析。
1.4Oncomine数据分析在Oncomine数据库中输入需要查询的基因名Jagged1(JAG1) 以及丝氨酸蛋白酶抑制蛋白E1(serine proteinase inhibitor family e member 1,SERPINE1),参数设定为P<0.05,倍性变化(fold change,FC)为All,基因等级(Gene Rank)为All,数据类型选择信使RNA(messenger RNA,mRNA)。
1.5Kaplan-Meier生存分析从Kaplan-Meierplotter网站中查询卵巢癌、肺癌、胃癌的相关数据并绘制Kaplan-Meier生存曲线(http://kmplot.com/analysis/)。比较JAG1及SERPINE1与此3种肿瘤患者总随访时间的关系。
1.6基因富集分析(genesetsenrichmentanalysis,GSEA) 使用GSEA 3.0 进行基因富集分析。数据集使用的是 c2.cp.kegg.v6.1.symbols.gmt。使用缺省加权富集统计方法进行富集分析,计算错误发现率(false discovery rate,FDR)及名义P值(nominal P value),随机组合次数设置为1 000次。
1.7统计学方法对于同一基因不同分组之间的表达比较采用非配对的t检验。生存分析采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
2.1EMT相关基因在PC3与PC3-CTC细胞中的表达差异分析对比PC3细胞及PC3-CTC细胞在EMT PCR芯片中的表达差异(图1),结果显示84个EMT相关基因中,明显上调的有27个(表1),其中EMT发生过程的标志性分子是上调的,如:N-cadherin(CDH2)、Twist1、ZEB1等。
表127个上调的EMT相关基因

编号基因上调倍数P值A03BMP16.570.000 012A10CDH26.930.037 24B02CTNNB112.530.005 244B07ESR18.50.000 048B10FN17.620.006 106B11FOXC272.050.040 68B12FZD716.260.029 826C03GSK3β5.170.021 302C10JAG16.660.021 083D01KRT79.40.001 764D03MMP23.510.010 251D06MSN15.720.002 302E07SERPINE1575.280.012 187E11SNAI26.490.002 35E12SNAI360.038 189F01SOX1017.290.000 528F02SPARC58.710.039 4F03SPP117.290.028 512F04STAT317.290.013 058F09TGFB110.880.001 427F11TGFB34.380.007 2G04TWIST110.150.011 982G06VIM6.30.036 107G08WNT1128.60.017 362G10WNT5B28.380.022 058G11ZEB19.550.017 728G12ZEB215.080.046 015
上调倍数=PC3-CTC的表达量/PC3的表达量。
2.2上调基因与前列腺癌患者不同分组的关系我们依据281名患者的肿瘤状态分别将患者分为肿瘤转移组与非转移组,依据此分组对上调的27个基因进行分析(图2A)。结果显示:JAG1(P=0.000 1)、TWIST1(P=0.004 6)、转化生长因子β1(transforming growth factor beta 1,TGFB1)(P=0.036 6)、富半胱氨酸分泌蛋白((secreted protein acidic and rich in cyst-eine,SPARC)(P=0.015 1)、SERPINE1(P=0.028 3)5个基因在肿瘤转移的患者中表达高于未发生转移的患者,且具有统计学差异。
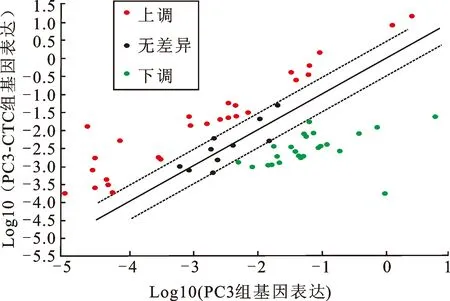
图1 具有不同转移能力前列腺癌细胞系之间EMT相关基因的表达差异分析
我们分析了上调基因与患者前列腺癌Gleason评分的关系(图2B)。结果显示:有7个基因的表达随着Gleason评分的升高而升高,呈正相关性且有统计学意义。取上调基因的中位数作为截断值将281名患者分为高表达组与低表达组,并对其随访时间(月)进行生存分析(图2C)。结果示:JAG1(P=0.000 3)、TWIST1(P=0.001 0)、纤维连接蛋白1(FN1)(P=0.003 3)、WNT家族蛋白11(WNT11)(P=0.023 5)、SERPINE1(P=0.024 5)5个基因低表达组的患者生存时间长于高表达组,且具有统计学差异。
结合以上的分析,我们筛选出TWIST1、JAG1、SERPINE1三个与前列腺癌的转移过程密切相关的EMT相关基因,做进一步研究(图2D)。
2.3SERPINE1以及JAG1在其他肿瘤中的功能分析作为EMT过程的标志性基因,对TWIST1的研究已经非常充分。因此我们把焦点放在JAG1以及SERPINE1上。
为了验证JAG1与SERPINE1是否与肿瘤的转移及不良预后正相关,我们还探究了这两个基因在其他肿瘤中的情况。从Oncomine数据库发现,在近20种肿瘤与相应的正常组织比较中,JAG1在164项肿瘤组织独立分析中高表达,在147项正常组织独立分析中低表达。SERPINE1在152项肿瘤组织独立分析中高表达,在61项正常组织独立分析中低表达(图3A)。
在卵巢癌、肺癌、胃癌3种肿瘤的Kaplan-Meier生存分析中,SERPINE1低表达的患者总生存期长于高表达患者,且具有统计学意义。而JAG1则并未显示有统计学意义(图3B)。
综上所述,SERPINE1可能与肿瘤的转移及不良预后密切相关。可以作为潜在的促肿瘤转移基因来进行进一步的研究。

图2不同肿瘤患者分组中上调基因的表达意义分析
A:按照肿瘤转移、非转移分组;B:按照Gleason评分分组;C:上调基因与前列腺癌患者随访生存期的关系;D:综合分析筛选出TWIST1、JAG1、SERPINE1作为潜在研究对象。

图3 在其他肿瘤中分析SERPINE1和JAG1的功能
A:JAG1与SERPINE1在不同肿瘤及相应正常组织中的表达情况比较;B:JAG1与SERPINE1在卵巢癌、肺癌、胃癌的Kaplan-Meier生存分析。
2.4SERPINE1的功能基因集富集通过GSEA方法对高表达SERPINE1的肿瘤样本进行分析,结果显示高表达SERPINE1与血管生成(P=0.034,FDR=0.014)、细胞粘附分子(P=0.02,FDR=0.053)、细胞外基质分子(P=0.035,FDR=0.316)以及基质受体(P=0.002,FDR=0.033)等基因集相关(图4)。这表明SERPINE1 可能通过影响肿瘤血管生成以及肿瘤细胞转移从而促进肿瘤进展。
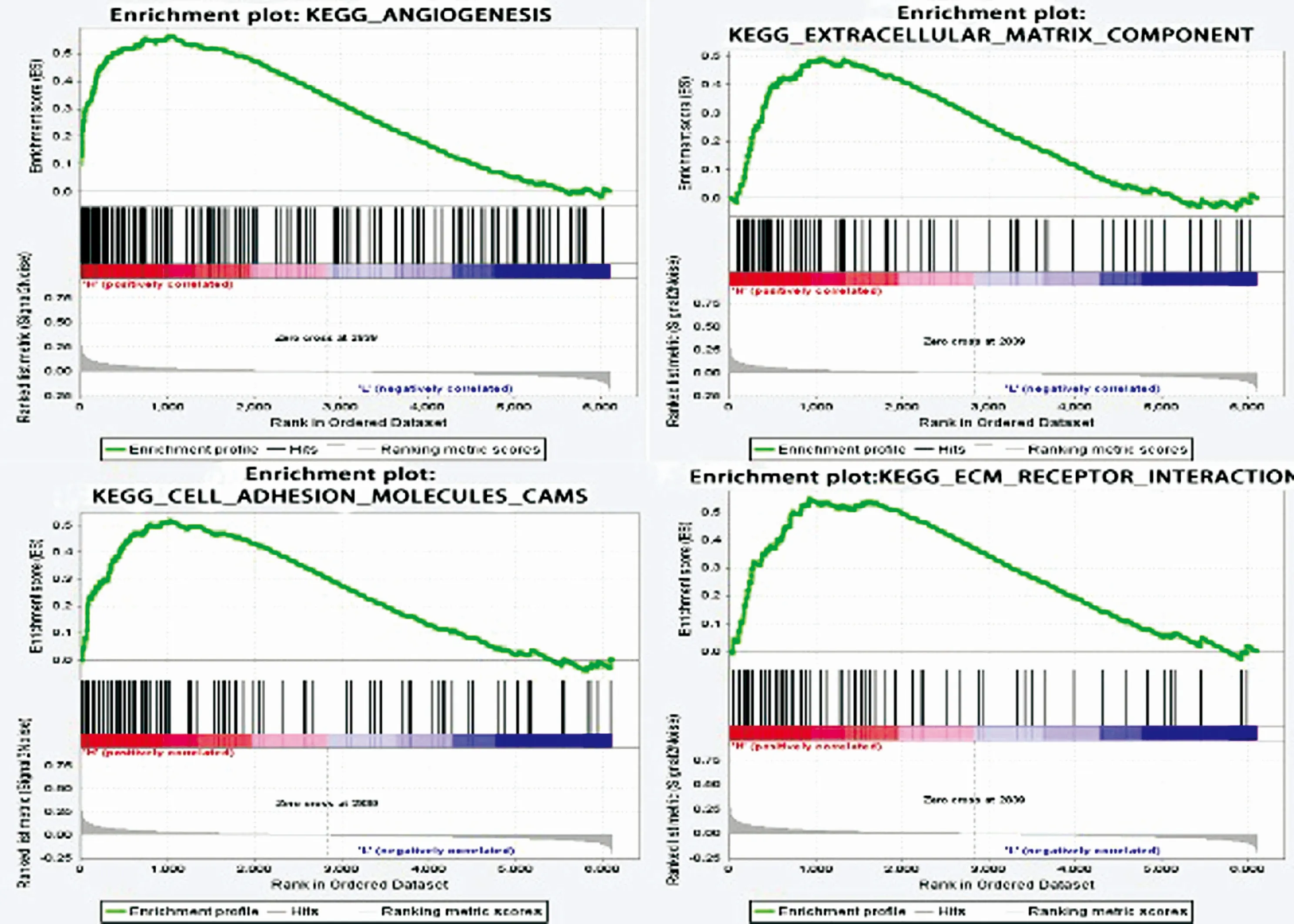
图4使用GSEA分析SERPINE1相关富集基因集
3 讨 论
本研究通过分析两种转移侵袭能力不同前列腺癌细胞系PC3及PC3-CTC中EMT相关分子的变化,结合GEO数据库、Oncomine数据库及其他肿瘤的Kaplan-Meier生存分析结果,最终筛选出了促癌转移基因SERPINE1。并通过GSEA分析发现SERPINE1可能通过影响血管生成等过程促进前列腺癌转移。
SERPINE1或者纤溶蛋白酶原激活物抑制物1(plasminogen activator inhibitor 1,PAI-1)属于丝氨酸蛋白激酶抑制剂家族成员,其编码的蛋白能够抑制组织型纤维蛋白酶原激活物(tissue plasminogen activator,tPA) 以及尿激酶型纤维蛋白酶原激活物(urokinase plasminogen activator,uPA)的活性,从而抑制纤维蛋白溶解过程。正常生理状态下,SERPINE1能够平衡纤维蛋白激活及溶解系统,有利于伤口愈合,病理状态下,血浆中SERPINE1的异常升高导致过度的纤维蛋白激活,形成疤痕[10]。此外,SERPINE1还参与了心脏、肝、肺、肾、皮肤等器官的纤维化病理过程[11]。
最近的研究表明SERPINE1参与了肿瘤的发展、转移及化疗药物耐药过程,但具体机制尚不明确,SERPINE1作为EMT通路中的一员,可能通过促进肿瘤的血管生成来到达促进肿瘤生长的目的。
血管形成是肿瘤发展的重要过程,与此相同的是, EMT也在肿瘤进展中扮演重要角色。而关于二者之间的关系,有研究表明主要由间质样肿瘤细胞构成的肿瘤组织中血管密度明显高于上皮样肿瘤细胞所形成的肿瘤组织,对于血管内皮的标志物CD34的检测结果也表明在间质性肿瘤中CD34表达要高于上皮性质的肿瘤。由同一种乳腺癌细胞发展而来的间质样肿瘤细胞中相较于上皮样肿瘤细胞检测出了更高的A型血管内皮生长因子(vascular endothelial growth factor,VEGF-A)水平,无论是从mRNA以及蛋白水平均如此[12]。转化生长因子β(transforming growth factor-β,TGF-β)是目前最有效的EMT过程激动剂[7],通常认为TGF-β通过激活果蝇抗体节极性蛋白类似蛋白(similar mothers against decapentaplegic,SMAD)途径进而发挥作用,然而有研究发现TGF-β作用存在一种SMAD非依赖途径,其下游包括胞外信号调节激酶/有丝分裂激活蛋白激酶(extracellular signal-regulated kinase /mitogen-activated protein kinase,ERK/MAPK)、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/ protein kinase B,PI3K/Akt)信号通路,而这些通路大多参与了EMT相关过程[13]。而ERK/MAPK、PI3K/Akt信号通路同时也是血管生成过程不可或缺的环节[14]。这表明EMT与血管生成过程有共用的信号通路。ZHANG等[15]报道富亮氨酸α-2糖蛋白1(leucine rich α-2-glycoprotein 1,LRG1)能够通过激活缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)来调节血管生成过程以及EMT的发生,HIF-1α在VEGF通过与其血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)结合之后启动一系列下游通路从而促进肿瘤血管生成的过程中起到至关重要作用,此外,HIF-1α也能够通过作用于Twist1以及Snail家族转录受体1(snail family transcriptional repressor 1,Snail1)来调节EMT过程。综上所述,EMT过程与血管生成拥有共同通路以及一些分子,EMT过程中一些表达变化的分子可能会促进前血管生成因子表达,从而促进血管生成的发生。
与肾癌不同,关于血管生成过程在前列腺癌中的作用的研究比较少,一般认为前列腺癌是寡血管生成的肿瘤。然而有研究表明血管内皮的标志物CD34、VEGF-A及HIF-1α的表达均随着癌组织Gleason评分、T分期的升高及伴有远处转移相关[16]。这表明血管生成可能在前列腺癌的发展过程中起到一定作用。SARASWATI等[17]报道α-檀香醇能够通过调节VEGFR2介导的AKT/雷帕霉素作用靶点激酶(mechanistic target of rapamycin kinase,mTOR)/核糖体蛋白S6激酶β1(ribosomal protein s6 kinase beta-1,P70S6K)通路来抑制血管生成以及前列腺癌的生长。ROY等[18]报道维甲酸受体应答物1(retinoic acid receptor responder 1,RARRES1)能够通过抑制肿瘤血管生成过程,增强了氧化应激对前列腺癌细胞的生长抑制作用。还有研究显示雄激素受体(androgen receptor,AR)作为转录因子能够作用于VEGF相关基因的上游,促进VEGF的转录[19]。除此之外,一些针对血管生成的靶向治疗临床研究早已在进行中,目前的结果表明能够稳定或者降低患者的前列腺特异抗原(prostate specific antigen,PSA)水平[20]。一项临床试验结果显示抗雄激素联合抗VEGF(贝伐珠单抗Bevacizumab、阿瓦斯汀Avastin)治疗相较于单独抗雄治疗能够显著延长前列腺癌患者生存期[21]。SERPINE1能够通过抑制纤溶蛋白酶,从而促进肿瘤的血管生成,进而参与前列腺癌的进程。
综上所述,SERPINE1在多种疾病中发挥着重要作用,然而其在前列腺癌中的功能研究得并不充分。本研究综合多种方法发现了SERPINE1作为潜在促癌基因,同时也为SERPINE1可能通过血管生成来促进前列腺癌转移的机制研究提供生物信息学证据支持。然而SERPINE1促进前列腺癌发展转移的具体机制仍需要进一步的实验证据支持。
