SFRP2单克隆抗体对肾癌SNU349细胞增殖及迁移的影响
2018-09-05吴小荣沙建军陈勇辉黄翼然刘东明
沈 超,吴小荣,沙建军,陈勇辉,薛 蔚,黄翼然,刘东明
(上海交通大学医学院附属仁济医院泌尿外科,上海 200127)
肾细胞癌(renal cell carcinoma,RCC)亦称肾癌,是常见的泌尿系统肿瘤,约占肾脏恶性肿瘤的80%~90%,成人恶性肿瘤的2%~3%[1]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾癌中最常见的病理类型,约占肾癌的70%~85%[2]。目前手术是肾癌的主要治疗手段,然而约20%~30%的局限性肾癌患者术后仍将发展为转移癌[3]。晚期肾癌对传统化疗及放疗敏感性均较低。近年来,分子靶向治疗的不断发展使之成为了晚期肾癌的重要治疗手段[4]。然而靶向治疗依然存在毒副作用及耐药相关问题[5-6]。因此,研究肾癌分子机制,寻找特异性治疗靶点对肾癌治疗及预后至关重要。
Wnt信号通路是一条进化上相对保守的信号通路,其生物学效应对肿瘤的增殖、迁移和侵袭密切相关[7]。分泌型卷曲相关蛋白2 (secreted frizzled related proteins 2,SFRP2) 是由SFRP2基因编码的分泌型糖蛋白,其分子结构中具有一个独特的N-端胞外半胱氨酸富集区(cysteine-rich extracellular domain,CRD)结构,该结构与Frizzled(Fz)蛋白的CRD区域同源,而后者是公认的Wnt结合位点[8]。本研究采用基因芯片分析及实时荧光定量PCR方法检测SFRP2在ccRCC中的表达情况,同时采用细胞增殖试验、划痕试验检测不同浓度SFRP2单克隆抗体对SFRP2高表达株SNU349细胞体外增殖、迁移的影响,为ccRCC靶点治疗提供新的思路。
1 材料与方法
1.1研究对象收集本中心2016年2月~2017年1月术后病理诊断为ccRCC组织标本37例。所选标本患者术前均未接受化疗、放疗或其他抗癌治疗,均无肾细胞癌家族史。所选标本患者年龄22~81岁,平均52.1岁,其中男性20例(54.1%),女性17例(45.2%)。肿瘤直径2.6~7.1 cm,平均3.9 cm。临床分期依据2010年美国癌症联合委员会(American Joint Committeeon Cancer,AJCC)对肾癌的TNM分期,T1期26例,T2期7例,T3期4例,其中2例下腔静脉癌栓伴肾门淋巴结转移。另收集同期正常肾脏组织(距离癌组织5 cm以外) 10例作为对照,所有组织标本获取后即冷冻于液氮中。
1.2材料肾癌细胞株SNU349(上海皓元生物医药科技有限公司);SFRP2 mAb由本实验室克隆筛选获得;Balb/c小鼠(扬州大学比较医学中心);高糖DMEM(Gibco公司);弗氏佐剂(sigma公司);RNA提取试剂Trizol(Invitrogen公司);RT试剂盒(Fermentas公司);Premix Taq Version 2.0 PCR扩增试剂盒(TaKaRa公司);DEPC水(上海碧云天生物有限公司);引物均由上海生工生物技术有限公司合成。
1.3方法
1.3.1基因芯片分析 CcRCC微阵列数据及相应临床资料提取自ArrayExpress数据库[9]。基因表达谱应用GeneChip human genome U133 Plus 2.0 array完成。运用基因显著性分析(significance analysis of microarrays,SAM) 检测T1~T4期ccRCC中SFRP2的表达。
1.3.2实时荧光定量多聚核苷酸链式反应(real-time quantitative polymerase chain reaction,qRT-PCR) 利用Trizol试剂提取组织总RNA,依照Premix Taq Version 2.0 PCR扩增试剂盒步骤,反转录合成cDNA。PCR反应体系为20 μL,扩增条件:95 ℃预变性30 s,然后95 ℃变性 5 s,58 ℃ 退火30 s,72 ℃ 延伸30 s,共40个循环。选择ccRCC稳定表达基因HMBS、PPIA、ATP5J和TBP为混合内参。实时定量PCR结果以ΔCt分析。计算公式:ΔCt(目标基因)=Ct (目标基因) - GM{Ct(HMBS),Ct(PPIA),Ct(ATP5J),Ct(TBP)}。
1.3.3SFRP2单克隆抗体制备 选择并合成SFRP2特异性抗原peptide B(序列:EITYINRDTKIILETKSKTC)多肽,偶联血蓝蛋白(keyhole limpet hemocyanin,KLH)载体蛋白,选取5只6~8周龄雌性BALB/c小鼠,将peptide B-KLH多肽与弗氏佐剂混合免疫,皮下注射100 μg,2~3周加强免疫一次。间接酶联免疫吸附剂测定法(enzyme linked immunosorbent assay,ELISA)确定抗血清针对peptide B多肽效价,待效价检测正常后进行细胞融合。制备骨髓瘤细胞及脾细胞,以数量比1∶20混合。加入HAT DMEM培养基,铺于96孔板中,每孔100 μL,CO2培养箱中培养。融合10 d后进行筛选检测。根据ELISA结果,以样品孔吸光度(absorbance,A)值/阴性孔A值≥2.1判定阳性孔,选择阳性孔细胞加DMEM铺于96孔板,重复亚克隆,挑出单克隆孔扩大培养定株。取蛋白A琼脂糖介质,填装层析柱,将腹水与磷酸缓冲盐溶液(phosphate buffer saline,PBS)按1∶1混匀后缓慢上样,待抗体结合后用甘氨酸洗脱缓冲液洗脱。纯化抗体后立即在PBS中进行4度透析过夜。纯化后抗体行聚丙烯酰胺凝胶电泳(sodiumdodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),考马斯亮蓝染色测定纯度。
1.3.4细胞增殖试验 取对数生长期肾癌SNU349细胞以每孔5×103个种于96孔板,每孔体积200 μL,培养24 h;更换培养基,每孔分别加入50、100及200 μg/mL的SFRP2 mAb,对照组加入同体积PBS,实验组和对照组均设8个复孔,孵育24 h和48 h ;在96孔板中每孔加入噻唑蓝(MTT)溶液(5 mg/mL)20 μL,避光孵育4 h;弃上清,每孔加入DMSO 150 μL,振荡5 min;选择570 nm波长,在酶联免疫监测仪上测定各孔吸光度,记录结果,并计算抑制率。
计算公式:细胞生长抑制率(inhibition ratio,IR)=(1-实验组平均A值/对照组平均A值)×100%。
1.3.5划痕试验 取对数生长期肾癌SNU-349细胞配置成单个细胞悬液,并接种于6孔板;用10 μL 移液枪枪头在培养板中以垂直方向划宽度约1 mm划痕;分组给予50、100、200 μg/mL的SFRP2 mAb处理,对照组加入同体积PBS,实验组和对照组均设4个复孔,孵育24 h及48 h;倒置荧光显微镜下观察并拍照,Image-Pro Plus 软件测量划痕区相对距离并计算细胞迁移率。
计算公式:迁移率(%)=(mAb干预前划痕区相对距离-mAb干预后划痕区相对距离) /mAb干预前划痕区相对距离×100%
1.4统计学分析采用SPSS 13.0统计软件处理数据,连续变量组间比较采用t检验,P<0.05表示有统计学意义。
2 结 果
2.1基因芯片显著性分析结果依据E-GEOD-53757 数据库,223121_s_at(SFRP2)在T1~T4期ccRCC中基因探针信号强度分布如图1所示。数据显示,SFRP2在ccRCC各分期中表达无显著差异,但在部分T1、T2及T4ccRCC中信号强度显著增高,提示部分ccRCC中可能高表达SFRP2。
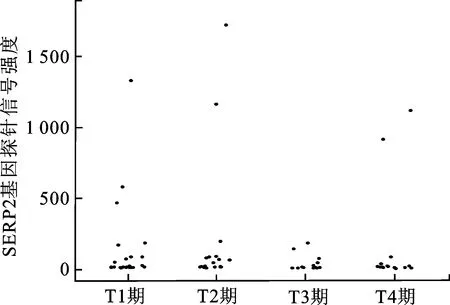
图1 E-GEOD-53757 数据库,223121_s_at(SFRP2)在T1~T4期ccRCC中基因探针信号强度分布
2.2qRT-PCR验证SFRP2在ccRCC及癌旁正常组织中的表达为进一步验证基因芯片提示结果,本研究运用qRT-PCR技术检测37例ccRCC组织及10例癌旁正常组织中SFRP2的表达。结果显示在部分ccRCC组织中,ΔCt 值显著降低,其差异具有统计学意义(P<0.05),证实在部分ccRCC中SFRP2表达程度显著增高(图2)。
2.3SFRP2mAb的制备及纯化纯化后抗体行SDS-PAGE电泳,分别于相对分子质量为55和25处呈现2条带,抗体纯度在90%以上(图3)。
2.4不同浓度SFRP2mAb对肾癌SNU349细胞增殖的影响对照组中肾癌SNU349细胞生长良好,轮廓清晰,呈贴壁汇合状,细胞形态以梭形为主,少量细胞呈圆形。SFRP2 mAb 实验组中,随单克隆抗体浓度提升及实验时间增长,细胞皱缩、脱落明显增加,细胞形态紊乱,生长受抑(图4A)。MTT结果显示,与对照组相比,实验组均表现出显著增殖抑制作用(P<0.05),SFRP2 mAb 对SNU349细胞增殖抑制率随单克隆抗体浓度增加及作用时间延长而提升(图4B),其中当SFRP2 mAb浓度为200 μg/mL,作用时间为48 h时其抑制效果最明显(P=0.006)。同时,24 h及48 h抑制率与抗体浓度的相关系数(r)分别为0.859和0.857,提示其抑制作用呈先一定浓度依赖性。
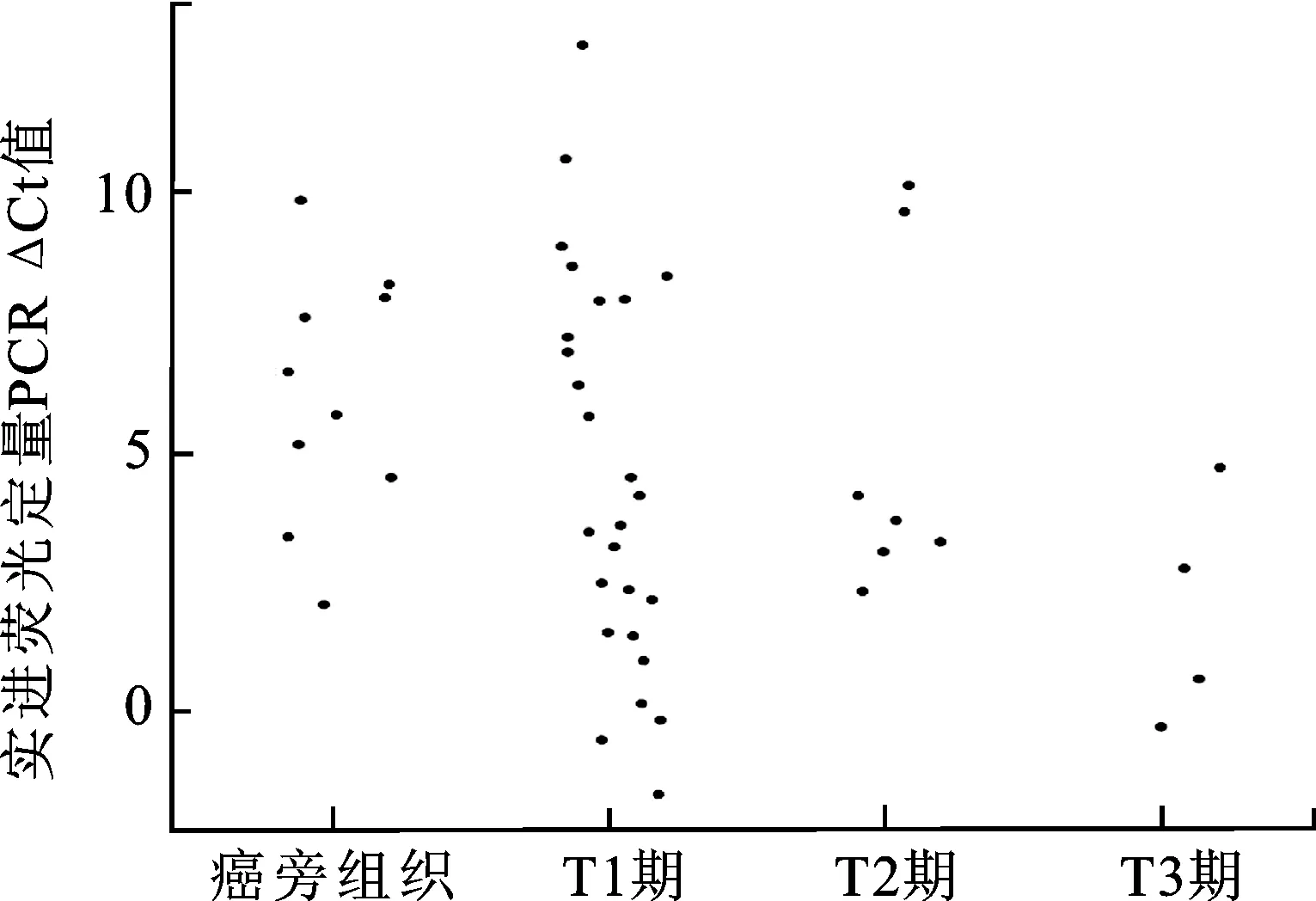
图2 qRT-PCR检测SFRP2在ccRCC及癌旁正常组织中的表达结果
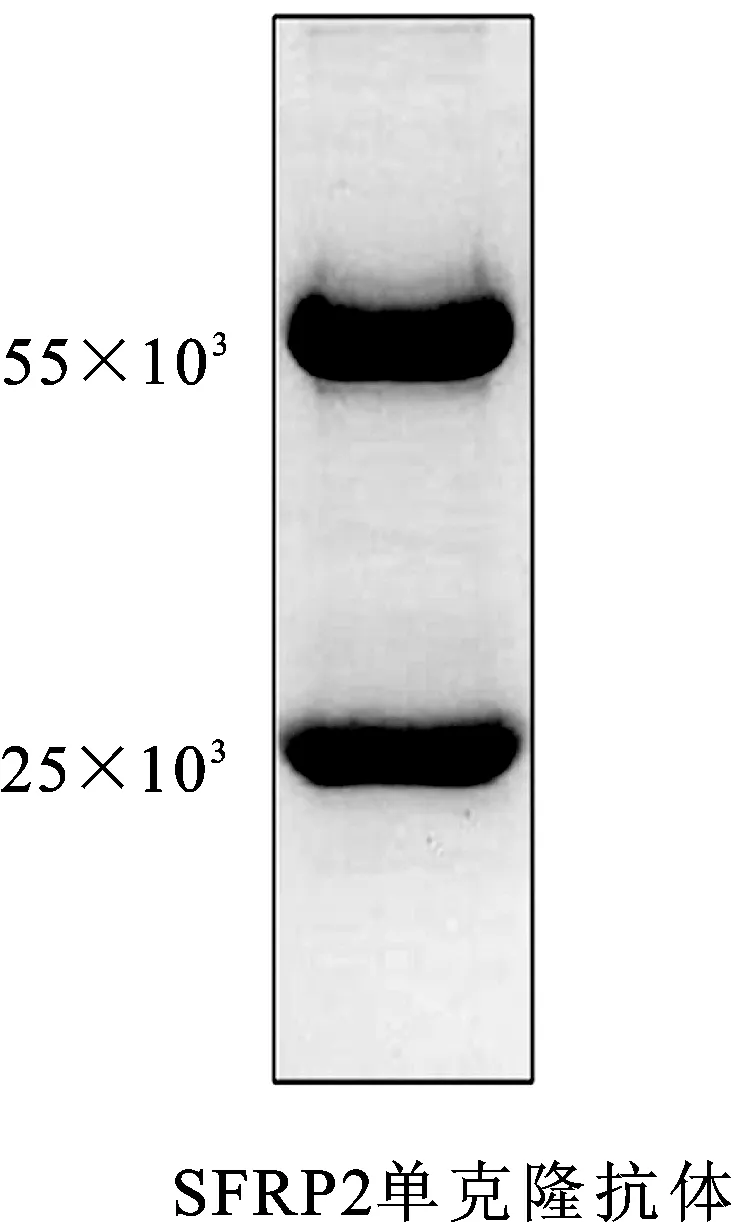
图3 SDS-PAGE 电泳分析抗体腹水纯化后的纯度

图4 不同浓度及时间作用下SFRP2 mAb对SNU349细胞增殖的影响
A:SFRP2 mAb对SNU349细胞形态的影响;B:SFRP2 mAb对SNU349细胞抑制率的影响。
2.5不同浓度SFRP2mAb对SNU349细胞迁移的影响划痕实验结果显示,SFRP2 mAb能有效抑制SNU349细胞划痕愈合(图5A)。统计结果显示,与对照组相比,在SFRP2 mAb 作用后,SNU349细胞的迁移能力显著下降(P<0.05),SUN349细胞迁移率随SFRP2 mAb浓度上升而降低(图5B),其中当SFRP2 mAb浓度为200 μg/mL时抑制效果最为显著(P=0.009)。

图5不同浓度及时间作用下SFRP2mAb对SNU349细胞迁移的影响
A: SFRP2 mAb对SNU349细胞迁移形态的影响;B: SFRP2 mAb对SNU349迁移率的影响。
3 讨 论
RCC是泌尿系统常见肿瘤之一,且发病率呈逐年上升趋势。早期肾癌常常因临床表现不明显而被患者忽视,据统计约25%~30%的患者在临床就诊时已经有转移,而出现转移的晚期肾癌患者的5年生存率仅有10%[10]。晚期RCC对于传统放疗及化疗均不敏感。而以白细胞介素-2(interleukin-2,IL-2)、干扰素-α(interferon-α,IFN-α) 等为代表的细胞因子治疗其有效率不及20%,同时伴随较多毒副作用[11]。近年来,分子靶向治疗成为了晚期RCC治疗研究的热门领域。然而靶向治疗药物依然存在手足皮肤反应、消化道反应、极度乏力等不良反应[12]。因此,积极探讨RCC发生、发展的分子机制,寻找高特异性治疗靶点对于晚期RCC的治疗具有至关重要的临床价值。
SFRP2属于分泌型卷曲相关蛋白家族组SFRPs的一员,其N端在结构上具有一个独特的半胱氨酸富集区(cysteine-rich domain,CRD),与Wnt信号传导通路中的特异性受体Fz受体具备高度同源性[13]。因此SFRP2通常被认为可以通过竞争性结合等方式实现对Wnt信号传导通路的负调节,进而减少β-catenin的激活,最终抑制肿瘤增殖[14]。许多研究证实了SFRP2表达下调在不同肿瘤发生发展中的重要作用,而其启动子CpG岛的甲基化则被认为是导致SFRP2基因表达下调的关键因素[15]。KINOSHITA等[16]对胃癌中SFRP2基因表达及其甲基化状态进行研究,发现在胃癌中SFRP2启动子超甲基化导致其表达下调,进而促进肿瘤生成及其转移侵袭能力。TANAKA等[17]对51例人结直肠癌患者中SFRP2表达情况进行研究,亦得出相似结论,认为SFRP2超甲基化在结直肠癌发生发展中起促进作用。然而近年来,亦有相关研究得出完全相反的结论:在犬类乳腺癌的相关研究中发现,相较于正常乳腺组织,SFRP2在肿瘤组织中显著增加,高浓度SFRP2降低了紫外线诱导凋亡的敏感性,同时增强了肿瘤细胞的转化能力[18]。ROTH等[19]研究发现,在脑胶质瘤细胞中,SFRP2的异位表达可以显著促进裸鼠颅内移植瘤的生长。LEE等[20]研究认为,SFRP2可能通过激活NF-kappaB传导通路或是抑制JNK传导通路实现抗肿瘤凋亡作用;其研究亦指出SFRP2与纤连蛋白整合素蛋白复合体(fibronectin-integrin protein complex)的结合可能也是导致其诱导细胞黏连及抗凋亡的原因之一。因此,在部分肿瘤中,SFRP2亦可扮演促癌基因的角色。
本研究中运用基因芯片技术以及实时荧光定量PCR技术检测SFRP2在肾透明细胞癌及癌旁正常组织中的表达。结果显示,SFRP2在部分肾透明细胞癌中显著高表达(P<0.05)。研究结果提示在部分肾透明细胞癌中SFRP2高表达可能在其诱导增殖中起重要作用。为验证该假设,本研究首次运用SFRP2 mAb技术,检测不同浓度抗体对SFRP2高表达株肾癌SNU349细胞体外增殖及迁移的影响。结果显示,SFRP2 mAb可以有效抑制肾癌SNU349细胞体外增殖及迁移,其作用效果呈现浓度依赖性。
目前,关于SFRP2促瘤机制并无明确定论,研究成为主要为以下3种假设:①SFRP2同时具备高亲和力及低亲和力的结合位点。当受体与其高亲和力位点结合时表现为对Wnt信号传导通路的增强效应,当低亲和力位点与受体结合时则表现为抑制效应[21]。②SFRP2在高浓度情况下,可以与Fz受体结合形成无功能复合物[22]。③SFRP2在高浓度Fz受体环境下促进Wnt蛋白转运从而激活信号传导通路,在低浓度Fz受体环境下则表现为通路拮抗剂[23]。因此,SFRP2在不同肿瘤中所表现出截然不同的效应可能与其遗传多态性以及不同的细胞微环境密切相关。YAMAMURA等[24]在对肾癌中SFRP2表达的研究中得出与本研究类似结论:SFRP2的稳定表达可以促进体内及体外肾细胞癌增殖,同时减少紫外线诱导的细胞凋亡,增长细胞G2期。SFRP2的表达显著活化T细胞因子/淋巴增强子转录活动,增加c-Fos、Bcl2、Bcl-w,cyclin B2和cyclin E2基因表达同时减少p53基因表达。
近年来,以SFRP2为靶点的分子靶向治疗研究不断升温。FONTENOT[25]等将SFRP2 mAb运用于血管肉瘤及三阴乳腺癌(指雌激素受体、孕激素受体、人表皮生长因子受体2,三者均为阴性的乳腺癌)中,结果显示SFRP2 mAb能够有效抑制体外血管生成、细胞增殖及迁移,同时能有显著抑制体内血管肉瘤及三阴乳腺癌模型的增长。他们认为SFRP2在血管肉瘤及三阴乳腺癌中扮演促癌基因的角色,同时提出了SFRP2 mAb成为这两类肿瘤特异性靶向治疗药物的可能性。本研究中SFRP2 mAb有效抑制SFRP高表达株肾癌SNU349细胞的体外增殖及迁移亦提示SFRP2在部分高表达SFRP2的肾癌中成为治疗靶点的可能前景。
综上所述,SFRP2在部分ccRCC中表达明显升高。SFRP2 mAb可显著抑制肾癌SNU349细胞体外增殖及迁移,且抑制程度与mAb浓度成正相关关系。研究结果提示SFRP2高表达可能与部分肾透明细胞癌诱导生成及肿瘤发展密切相关,SFRP2可能是肾透明细胞癌的早期预防诊断以及预测肿瘤的复发、转移及预后有价值的分子标志物。同时,SFRP2 mAb可能成为部分SFRP2过表达的ccRCC的有效治疗靶点。
