MC1对碱处理及未处理谷子秸秆的分解特性比较
2018-09-05曹燕篆张建伟闫双堆
曹燕篆,张建伟,闫双堆
(山西农业大学 资源与环境学院,山西 太谷 030801)
秸秆是世界上最丰富的木质纤维素资源,同时也是主要的农业有机废弃物,全世界每年可产生近20亿吨秸秆,我国作为农业大国,秸秆产量每年可达7亿多吨,占世界秸秆资源产量的25%左右[1~2],秸秆的综合利用对农业生态稳定、农民增收及缓解能源环境压力具有重要作用[3]。中国是世界上谷子种植面积最大的国家之一,近年来,随着谷子的抗旱节水特性、营养保健功能及产业开发价值逐渐被人们重新认识,种植面积持续扩大,随之而来的是产量可观的谷子秸秆[4],但目前对谷子秸秆的资源转化研究较少。
谷子秸秆主要由木质纤维素组成,化学成分复杂,物理结构致密,对微生物的分解具有抵抗作用。分解效率低成为限制秸秆资源高效利用的瓶颈,因此多种不同的预处理方式被提出,其中NaOH处理是一种最常见的预处理方式,能够有效去除木质素并破坏结晶结构从而增加纤维素接触面积[5,6]。大量的研究表明,秸秆等天然木质纤维素材料经过不同浓度的NaOH预处理后能够显著提高水解效率,获得更多的还原糖、甲烷产量等[7,8]。然而,大量废液的产生需要处理,降低了秸秆资源化经济效益,若处理不当则会造成环境污染问题。生物预处理由于具有成本低、环境友好、产量高等优点,成为目前研究的热点[9]。同时,研究发现微生物菌群比单个菌株具有更好的木质纤维素分解能力[10]。本研究利用已经筛选获得的一组能够有效分解多种木质纤维素材料的菌群MC1,其组成主要包括Clostridium straminisolvens CSK1,Clostridium sp. FG4, Pseudoxanthomonas sp. M1-3,Brevibacillus sp. M1-5及 Bordetella sp. M1-6[11],比较对NaOH处理及未经任何前处理谷子秸秆的分解特性,研究MC1对谷子秸秆的分解潜力,对我国谷子秸秆的资源化利用具有重要意义。
1 材料与方法
1.1 材料
菌种:菌群MC1由中国农业大学农学院废弃物资源利用研究室提供[12]。
谷子秸秆:取自山西农业大学实验站。一部分用1% NaOH浸泡24 h清水冲洗至pH中性,60 ℃烘干至恒重备用(碱处理秸秆AT),另一部分直接烘干备用(未处理秸秆NT),秸秆木质纤维素组成见表 1。

表 1 秸秆样品组成成分Table 1 Components of millet straw samples
1.2 培养基及培养条件
复合菌系MC1的活化及培养使用PCS培养基:蛋白胨5 g,酵母粉1 g,NaCl 5 g,CaCO32 g,去离子水1 L,pH 7.0。将200 mL的培养液加入到300 mL的三角瓶中,添加1%的谷子秸秆作为唯一碳源,121 ℃灭菌30 min。待培养基冷却至室温,接种MC1进行分解试验,接种量为5 % v/v,接种后置于50 ℃静置培养,于0,1,3,6,9,12,15 d取样测定分解过程中的减重、生物量及酶活等指标,3次重复。
1.3 谷子秸秆的总减重及各成分减重
MC1分解过程中剩余的谷子秸秆用3%醋酸浸泡去除培养基中的CaCO3,用已知重量的滤纸过滤,于60 ℃烘干至恒重后称重,计算秸秆总减重。烘干后的秸秆粉碎过1 mm筛,称取0.5 g装入F57专用袋中,用美国ANKOM公司生产的ANKOM220型纤维分析仪测定纤维素、半纤维素及木质素含量。
1.4 酶活测定
MC1分解谷子秸秆过程中的羧甲基纤维素酶活及木聚糖酶活测定方法参考文献[13]。
1.5 生物量测定
通过测定培养体系中总蛋白量反应MC1分解谷子秸秆过程中生物量的变化。培养体系中总蛋白包括培养液蛋白及菌体蛋白两部分。将所有培养液分次倒入离心管中8 000 r·min-1离心10 min,上清液为第1部分蛋白液,收集的菌体备用。向三角瓶中添加50 mL无菌水,150 r·min-1振荡30 min洗脱附着在未分解秸秆上的菌体细胞,将获得的菌液分次倒入离心管中8 000 r·min-1离心10 min,收集第2部分菌体蛋白,并与上一步离心的菌体混合,用超声波细胞破碎仪(Scientz-IID)破碎两次(20 KHz),每次5 min,破碎后的悬浮液冷却至室温,8 000 r·min-1离心10 min,取上清作为第2部分菌体细胞的蛋白液。蛋白浓度的测定使用BCA法[14]。
1.6 培养液中有机酸的测定
利用高效液相色谱仪(LC-20 A,岛津)测定谷子秸秆分解过程中有机酸的累积情况。培养液经12 000 r·min-1离心10 min,上清液与乙腈按体积比1∶1混合后静置5 min,12 000 r·min-1离心10 min后上清过0.22 μm滤膜。仪器配置及条件为:伯乐Aminex HPX-87H液相色谱柱,柱温为40 ℃,SPD-S20 A检测器,流动相5 mm H2SO4,流速为0.6 mL·min-1,测定时间40 min。
1.7 培养液中还原糖的测定
采用蒽酮硫酸法测定培养液中还原糖的浓度,测定方法参照文献[15]。
2 结果与分析
2.1 MC1对谷子秸秆的分解能力
由图1可知,MC1能够有效分解谷子秸秆。培养15 d后,碱处理秸秆的总减重为61.8%,未处理秸秆的总减重为60.0%,分解6 d后两种处理秸秆的分解率差异较小,碱处理秸秆的分解率比未处理秸秆的分解率高0.3%~3.6%。但是,3 d内碱处理秸秆的分解速率显著高于未处理秸秆。3 d后,对碱处理秸秆的分解率达到44.1%,而对未处理秸秆的分解率只有20.8%。可见,碱处理能够在较短时间提高MC1对谷子秸秆的分解率,若分解时间超过6 d,MC1对未处理谷子秸秆同样具有良好的分解效果。
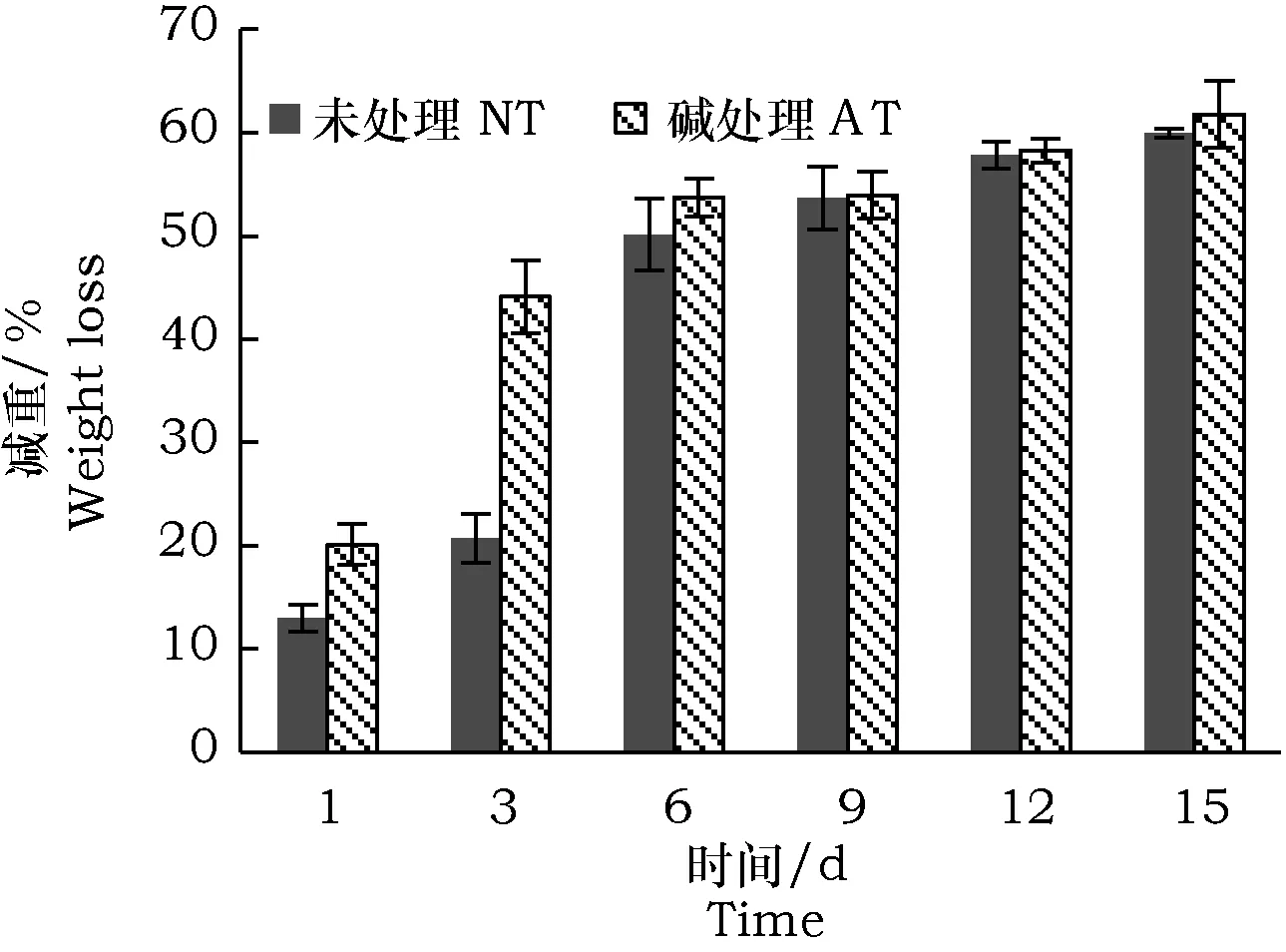
图1 谷子秸秆分解效果Fig.1 Degradation of Millet straw by MC1
2.2 木质纤维素各成分减重
由表1可知,0 d未处理秸秆的纤维素半纤维素的总量为82.5%,碱处理秸秆为81.7%,碱处理后纤维素比例增加,半纤维素及木质素含量减少。分解15 d后,谷子秸秆残留的木质纤维素成分见图2,未处理秸秆残余的纤维素、半纤维素、木质素含量分别为0.45 g,0.18 g,0.11 g,分解率分别为58.2%,69.3%,47.2%。碱处理秸秆残余的纤维素、半纤维素、木质素含量分别为0.41 g,0.12 g,0.12 g,分解率分别为65.0%,74.3%,30.2%。可见,MC1对未处理谷子秸秆具有明显的分解能力,并且对半纤维素的分解能力最强。
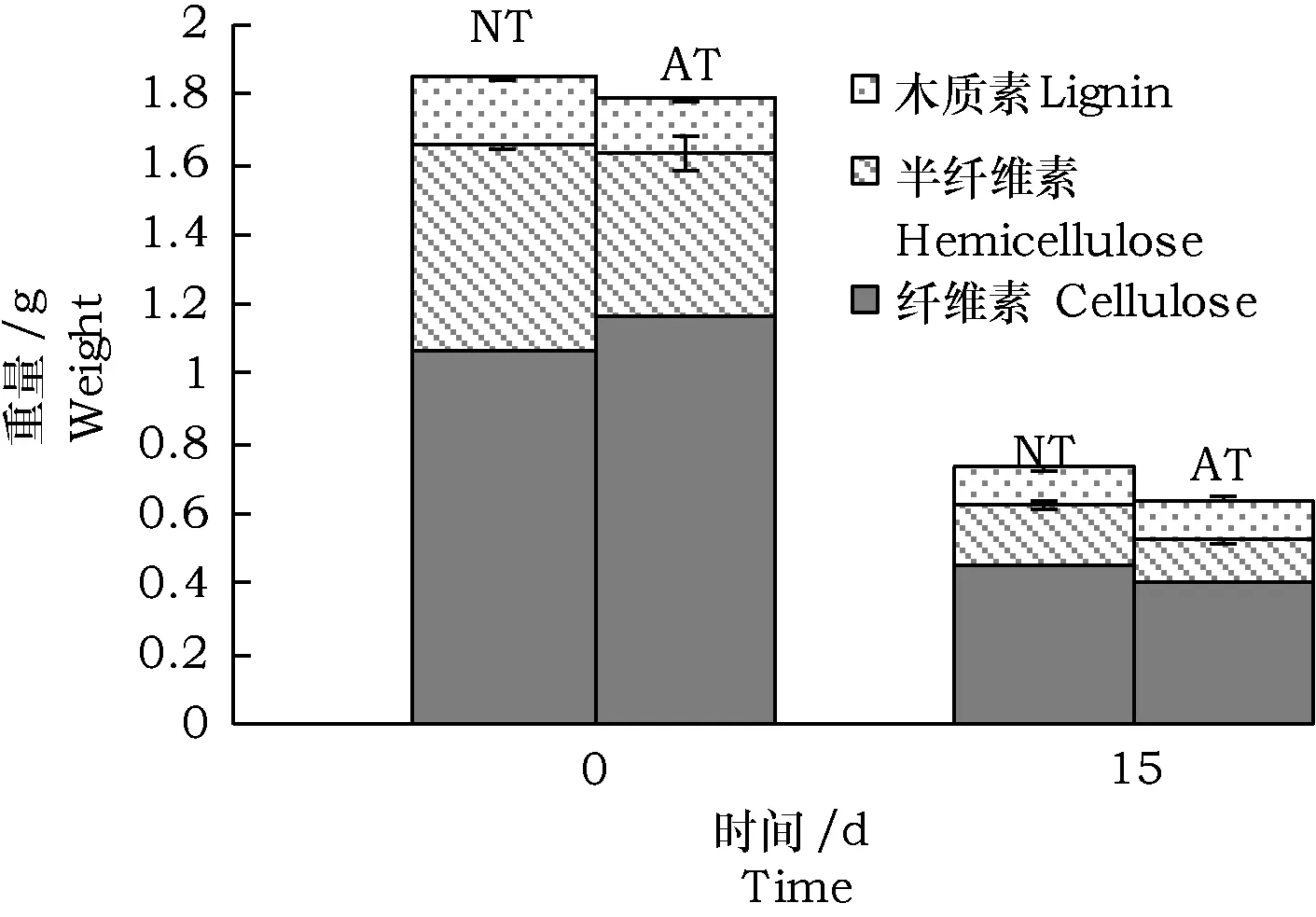
图2 谷子秸秆分解过程中的成分减重Fig.2 Degradation of lignocellulosic components of Millet straw
2.3 分解过程中的酶活变化
图3分析了MC1分解谷子秸秆过程水解液中羧甲基纤维素酶活及木聚糖酶活,结果显示发酵液中的木聚糖酶活高于羧甲基纤维素酶活。碱处理秸秆为底物时,分解第9 d木聚糖酶活、羧甲基纤维素酶活均达到最高,分别为84.8 IU·mL-1和14.1 IU·mL-1。未处理秸秆为底物时,分解第9 d羧甲基纤维素酶活达到最高,为13.1 IU·mL-1,木聚糖酶活呈逐渐增加的趋势,在第15 d达到最高为79.2 IU·mL-1。另外,从图 3可以看出羧甲基纤维素酶活和半纤维素酶活在3 d后都有一个快速增加的趋势,6 d后变化的幅度减少,该变化规律与秸秆分解率一致。
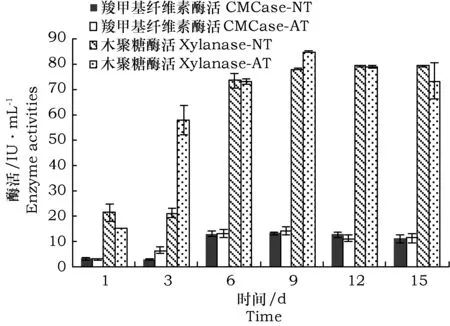
图3 谷子秸秆分解过程中的酶活Fig.3 Enzyme activities during Millet straw degradation
2.4 培养液中还原糖的累积
由图4可知,分解第0 d,未处理及碱处理秸秆为底物时培养液中的还原糖浓度分别为147.3 mg·L-1和111.4 mg·L-1,碱处理浸泡和冲洗过程会造成秸秆中还原糖的部分损失。MC1分解未处理秸秆第9 d培养液中的还原糖浓度达到最高为355.6 mg·L-1,分解碱处理秸秆第9 d达到一个高峰后先下降又上升,其中第9 d时培养液中还原糖的浓度为299.5 mg·L-1,第15天时为305.9 mg·L-1。
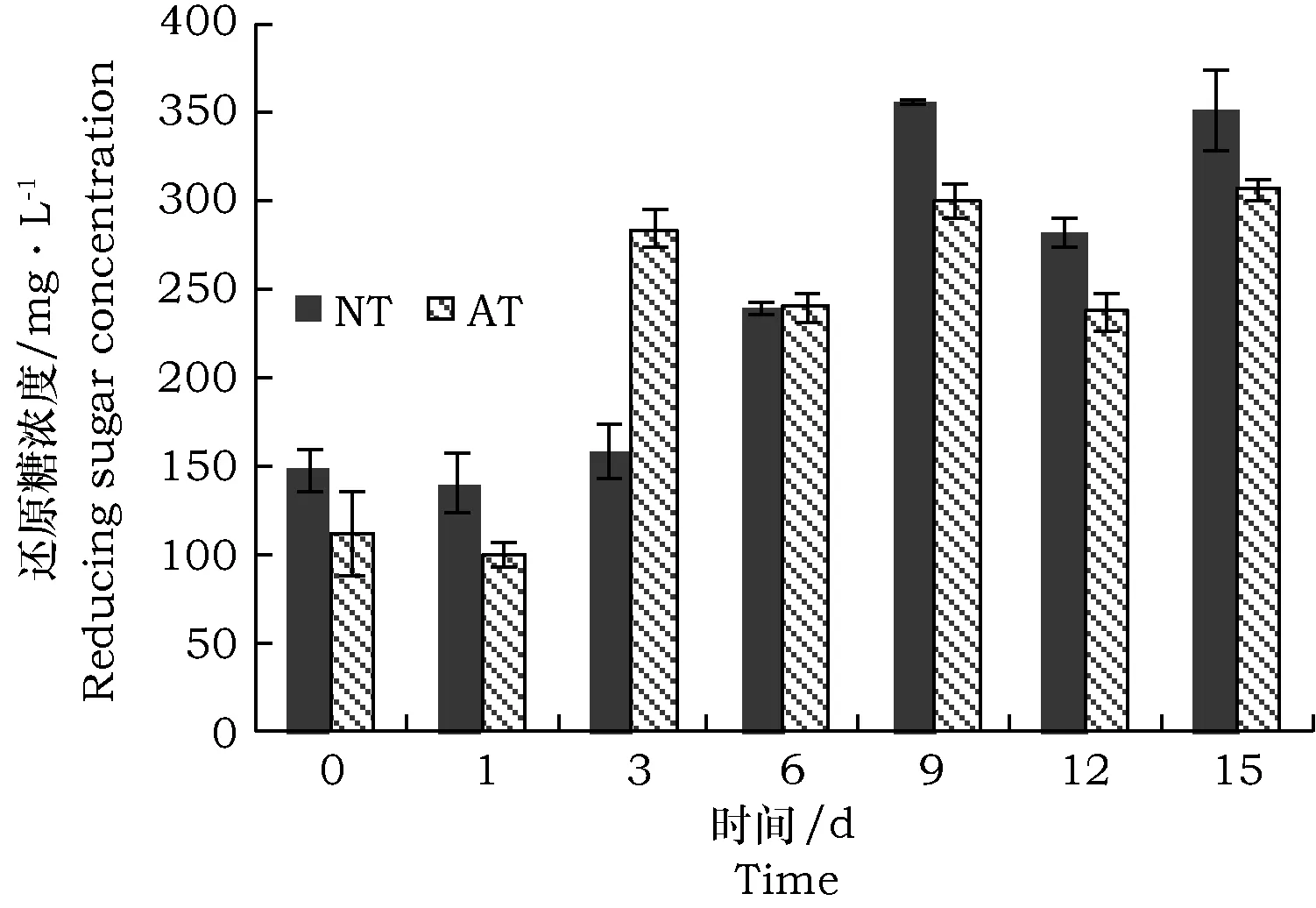
图4 谷子秸秆过程中产生的还原糖Fig.4 Analysis of reducing sugar during Millet straw degradation
2.5 培养液中挥发性产物的变化
利用HPLC分析了MC1分解谷子秸秆过程中产生的主要有机酸:甲酸、乙酸和丙酸的含量,分解液中未检测到丁酸(图5)。结果表明乙酸产量高于甲酸和丙酸,分解第3 d乙酸浓度达到最高,未处理秸秆和碱处理秸秆为底物时的浓度分别为1.18 g·L-1、1.27 g·L-1。分解过程中甲酸的累积规律与乙酸相似,分解第3 d,甲酸的浓度达到最高,未处理秸秆和碱处理秸秆为底物时的浓度分别为0.54 g·L-1、0.65 g·L-1。丙酸浓度在整个分解期间比较稳定,为0.60±0.10 g·L-1。
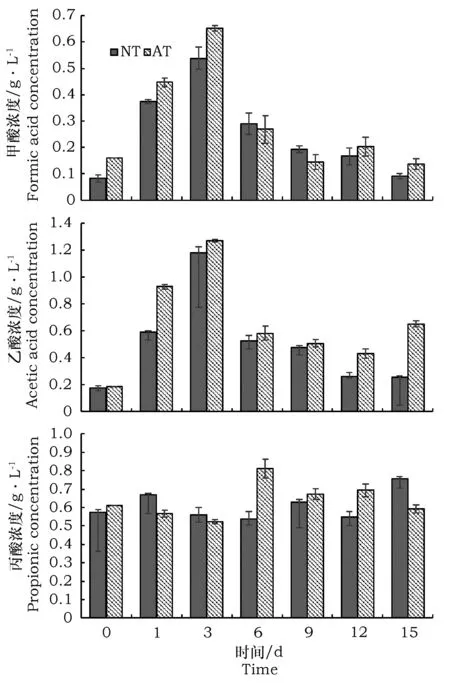
图5 谷子秸秆分解过程中挥发性产物的变化Fig.5 Changes of major volatile products during Millet straw degradation
2.6 生物量
MC1分解谷子秸秆过程中,无论是培养液中的蛋白还是菌体蛋白都呈先上升后下降的趋势(图 6)。培养0 d,未处理秸秆和碱处理秸秆培养液中的蛋白浓度为437.5 mg·L-1,主要来自培养基中的蛋白胨成分。在整个分解过程中,培养液中的蛋白浓度最高出现在第9天,分解未处理秸秆及碱处理秸秆的浓度分别为1 810.0 mg·L-1和1 220.6 mg·L-1。菌体蛋白最高浓度出现在第6 d,分解未处理秸秆及碱处理秸秆的浓度分别为855.21 mg·L-1和1 405.6 mg·L-1。结果表明添加未处理秸秆有利于培养液中蛋白的累积,而碱处理秸秆有利于菌体蛋白的积累,并且以未处理秸秆为底物时总生物量略高于碱处理秸秆为底物。
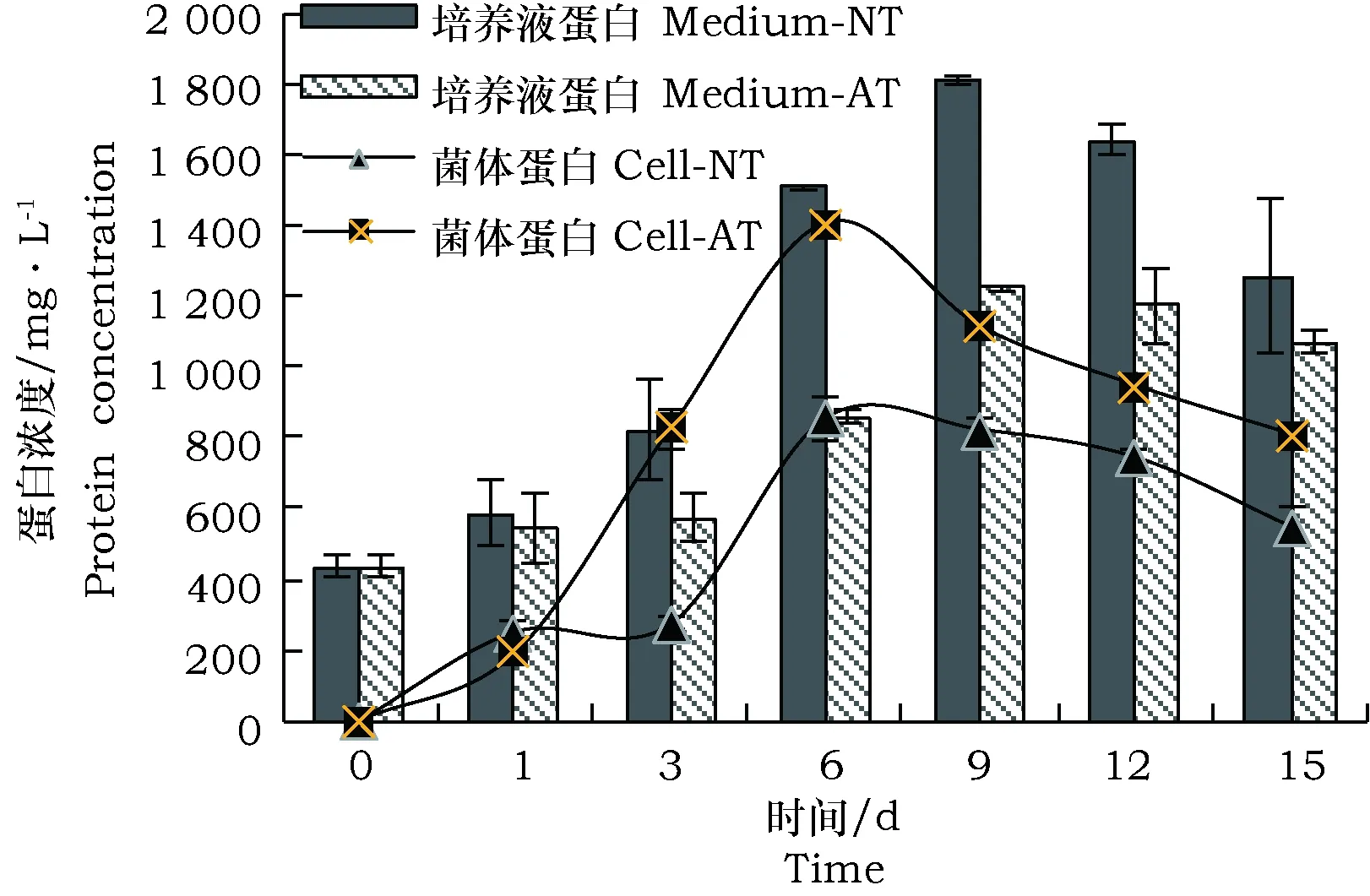
图6 谷子秸秆分解过程中生物量的变化Fig.6 Changes of protein concentration during Millet straw degradation
3 讨论与结论
为了提高秸秆的分解效率,通常需要对秸秆进行物理、化学或生物预处理。王慧等[16]利用复合菌系XDC-2对未经化学处理的水稻秸秆进行分解,12 d总质量减少了39.71%,显著低于碱处理水稻秸秆58.2%的降解率[17]。杨巧丽等[18]从粪便中筛选到一组木质纤维素分解菌群,6 d对未经化学处理但粉碎后的小麦秸秆、稻草秸秆、玉米秸秆的降解率分别为47.0%,48.62%及50.21%。复合菌系MC1能够15 d分解碱处理秸秆的61.8%,未处理秸秆的60.0%,6 d对2种秸秆的分解率都达到50%以上。另外,焦有宙等利用几株木质纤维素优势土著菌及其混合菌对玉米秸秆进行分解,35 d对纤维素、半纤维素的最高分解率为46.32%和48.53%[19],而MC1能够在14 d分解玉米秸秆纤维素的53.1%,半纤维素的76.4%[20]。主要由于复合菌系没有破坏菌群之间的协同共生关系,对天然木质纤维素的分解能力大于单个菌株或菌株的简单混合。
谷子秸秆分解过程中可产生还原糖、甲酸、乙酸及丙酸等能源物质,甲酸和乙酸浓度在分解的第3 d达到最高。有研究表明秸秆水解酸化过程中会产生短链挥发性产物,同时对木质纤维素材料的进一步水解酸化有重要意义,另外有机酸的种类、浓度的变化取决于pH、微生物的种类、温度及有机物的种类等[21~22]。秸秆水解后的有机酸尤其是乙酸、丁酸被认为是产甲烷的最适底物,能够促进甲烷效率并提高甲烷生产的稳定性[23]。
MC1分解谷子秸秆过程中以未处理秸秆为底物时总生物量略高于碱处理秸秆为底物。李湘等利用复合菌系MC1降解不同预处理后的玉米秸秆也发现,未处理秸秆的生物量要大于碱处理秸秆,并且气爆处理后生物量最大[24]。综上,高效木质纤维素分解复合菌系MC1能有效分解未经任何处理的谷子秸秆,可产生还原糖、有机酸等能源物质,为谷子秸秆的资源利用提供依据。
