大白猪群中PIT1基因多态性与生长性状的相关性研究
2018-09-04郑安代李明杨谢永杰聂光伟毛慧敏王国水
郑安代,李明杨,谢永杰,聂光伟,毛慧敏,王国水,左 波*
(1.华中农业大学动科动医学院农业部猪遗传育种重点实验室,武汉 430070;2.浙江天蓬集团有限公司,浙江 江山 324111;3.雏鹰农牧集团股份有限公司,河南 郑州 451162)
1 概述
PIT-1(pituitary transcription factor1,PIT-1)基因是POU结构域蛋白家族的一员,它是重要的组织特异性转录因子,参与激活生长激素(GH)、催乳素(PRL)、促甲状腺素β亚单位(TSHβ)基因的表达调控,从而对动物的生长发育有着直接或间接的作用[1]。另有研究表明,PIT1基因突变会阻碍GH、PRL、TSHβ激素的分泌,从而引起动物矮小[2]。在一些因缺少多种垂体激素而导致侏儒的人体和小鼠中,都可发现缺少PIT1基因的活性[3,4]。现在,猪的PIT1基因已被定位在13号染色体上的q46区域[5]。1993年,Tuggle[6]等将PIT1基因作为影响猪生长性状的候选基因,研究PIT1基因多态性与猪生长胴体性状之间的关联性,并在梅山猪中发现了一个BamHI的多态位点。Yu[7]等检测了BamHI、MspI、RsaI三个酶切位点,并对其进行研究,其中PIT1基因的MspI位点与初生重和背膘厚显著相关。而Stancekova等在大白猪和大白与长白猪杂家群体中研究MspI酶切位点与重要经济性状相关性,发现背膘厚和瘦肉率均达到显著水平[8]。因此,人们研究PIT1基因的多态性,将其作为重要遗传标记,为生长性状的分子标记辅助选择提供依据。
2 材料与方法
2.1 实验材料
法系大白猪313头(源自浙江开盛生态农业发展有限公司),体重在85~135 kg,使用一次性采血器在前腔静脉处采集血液。基因组DNA采用血液基因组DNA中量提取试剂
精品思想 市场战略盒(离心柱型)提取,于-80 ℃超低温冰箱中保存。
2.2 PCR扩增
本实验主要利用PCR-RFLP 技术进行基因分型,所用引物由上海生工生物工程有限公司合成,引物序列见表1。PCR反应体系为10 mL::2×Es Taq Master Mix(含染料)5.0 mL;ddH2O 4.0 mL;Sense primer(10 mmol)0.25 mL;Antisense primer(10m mol) 0.25 mL ;DNA 0.5 mL。PIT1 基因反应程序:94 ℃,5 min;35个循环(30 s 94 ℃,30 s 65 ℃,30 s 72 ℃);72 ℃,5 min ;25 ℃,1 min。
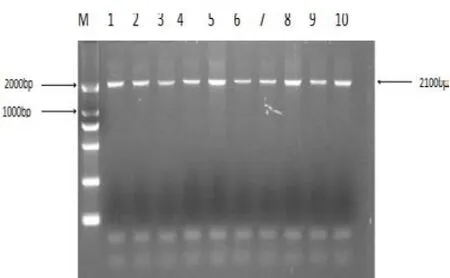
图1 PIT-1基因PCR产物凝胶电泳结果
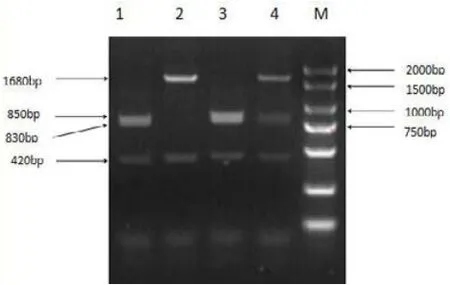
图2 PIT-1基因PCR-MspIRFLP酶切分型凝胶电泳结果

表1 扩增目的基因所用的引物

表2 大白猪群中PIT-1和HDAC1基因型频率和等位基因频率
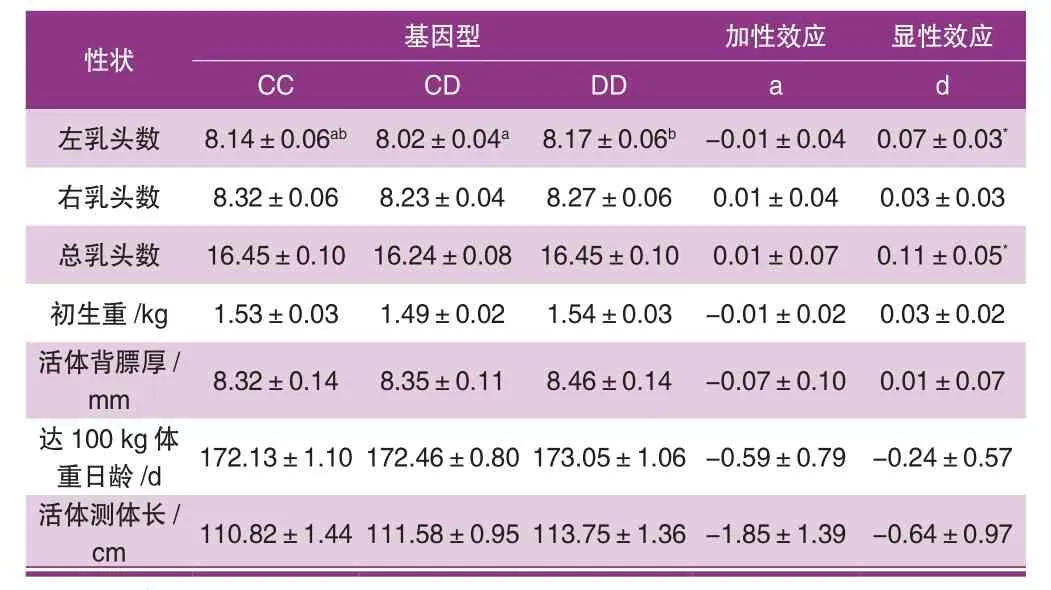
表3 PIT1基因MspI多态性与大白猪性状间的关联分析
2.3 PCR-RFLP 分析
PIT1基因用限制性内切酶MspI进行酶切。酶切反应体 系 为 :PCR 产 物 10.0 mL,10×FastDigest Green buffer 2.0 mL,内切酶 0.5 mL,ddH2O 7.5 mL。37 ℃消化1 h。酶切产物用1.5%的琼脂糖凝胶电泳检测分型,并拍照保存图片。
2.4 统计分析
本实验所采用模型为:Tijkl=μ+Gi+Fj+Sk+Pl+eijklm,Tijkl 为性状表型值,μ 为平均值,Gi 为基因型效应(包括基因加性效应和显性效应);Fj、Sk、Pl 为固定效应,分别为家系、性别、批次,eijklm 为残差效应。采用SAS 软件GLM 模型自编程序完成,同时采用reg 程序计算基因加性效应和显性效应,并进行显著性检验。
3 结果与分析
3.1 PIT1基因的PCR-MspI-RFLP多态性检测
本研究用于检测PIT1基因多态性的扩增片段产物长度为2 100 bp,见图1。利用MspI限制性内切酶酶切 后 产 生 1 680 bp、850 bp、830 bp和 420 bp 4个 片段,根据条带类型的不同共检测到3种基因型,分别命名 为 DD基 因 型(850 bp+830 bp+420 bp)、CD基 因型(1 680 bp+850 bp+830 bp+420bp) 和 CC基 因 型(1 680 bp+420 bp)。基因分型结果见图2。
3.2 PIT1基因在大白猪中的基因频率分布及与生长和胴体性状的关联分析
3.2.1 PIT1基因在大白猪群体中的基因频率分布
利用PCR- RFLP 技术对PIT1基因多态性进行检测,在法系大白猪中检测到3种基因型,对各基因型频率进行统计,结果如表2 所示。
由表2得出,在法系大白猪群体PIT1基因的C等位基因和D等位基因的频率比较接近,D等位基因在群体中的分布略高于C等位基因,且D等位基因为优势等位基因。哈迪-温伯格(Hardy-Weinbery)平衡结果显示,PIT-1基因在大白群体中符合哈迪-温伯格平衡状态(P>0.05)。
3.2.2 PIT1基因多态性与法系大白猪生长及胴体性状的关联分析
对PIT1基因多态性位点的不同基因型与大白猪生长及胴体性状进行相关性分析,结果如表3所示。
由表3可以看出PIT1基因在在法系大白猪中,DD基因型个体左乳头数高于CD型基因型个体乳头数,两者差异显著(P<0.05),且高于CC基因型个体,但不显著。其他性状都没有达到显著水平,但是DD基因型个体的初生重、活体测体长均高于CC基因型和CD基因型,而CC基因型个体的活体背膘厚、达100 kg体重日龄要低于CD基因型个体和DD基因型个体。
4 讨论
PIT1基因MspI 酶切位点在大白猪群体中有基因分型。其中PIT1基因MspI位点在大白猪品种中D等位基因略高于C等位基因,D等位基因是优势等位基因,这与Stancekova等[8]和柳小春等[9]研究结果一致。其中,PIT1基因MspI酶切位点3种基因型与大白猪生长性状之间相关性不显著,但 CC基因型个体的活体背膘厚、达100 kg体重日龄要低于CD基因型个体和DD基因型个体,说明CC基因型在生长速度上要优于DD基因型,C等位基因对于生长性状具有正效应,而且还具有降低活体背膘厚的作用。而在刘峰[10]的研究中,大白、长白、杜洛克3个品种中CC基因型个体的达100 kg体重日龄都显著低于DD基因型个体。本实验结果与其是一致的,但与Yu[7]等的结果是相反的。
PIT1基因的功能对猪的生长发育影响较大,且该基因CC基因型个体具有背膘薄、瘦肉率高、脂肪率低、生长速度快的特点[8,10],而本实验也证明了CC基因型个体背膘薄以及100 kg体重日龄低的特点。这些研究结果证明PIT1基因可以作为背膘厚、达100 kg体重日龄等生长胴体性状的候选基因,并应用到分子育种中。而选择该基因的CC基因型个体能够使得猪群向着生长速度快、背膘薄的方向发展。
