二茂铁巯基化合物/金纳米粒子/还原石墨烯修饰电化学传感器检测Cu2+
2018-09-03谢成根金俊成单宏伟
杨 梅, 谢成根, 吴 菊, 金俊成, 程 超, 单宏伟
(皖西学院材料与化工学院,安徽仿生传感与检测技术省级实验室,安徽六安 237012)
铜元素是人体进行正常生命活动所必需的微量元素之一,影响着人体的正常代谢,对人体中多种酶的合成及增强人体免疫力有着重要作用[1]。测量Cu2+方法最常见的有:荧光法[2 - 3]、原子吸收光谱法[4]、电化学分析方法等[5]。其中电化学方法,尤其是伏安法,因其具有使用费用低,仪器设备简单,检测步骤简便,易于操作的优点,被广泛用于金属离子的检测分析。还原石墨烯(RGO)具备较大的比表面积、优异的导电性、良好的机械和吸附等特性,可以提高电化学传感器的灵敏度[6]。二茂铁(Fc)具有夹心结构和芳香性的高度富电子特性,因其特有的结构而具有良好的反应活性,在大多数常见溶剂中可进行可逆的单电子氧化,具有可逆的氧化还原特点。有机-无机杂化材料与两种原始的有机化合物和无机化合物相比,表现出更强的电催化性能。
本文利用RGO较大的比表面积和吸附性能,将RGO修饰到玻碳电极(GCE)上,再电沉积金纳米粒子(AuNPs),利用自组装原理将二茂铁巯基化合物(FcSH)修饰到AuNPs表面,制备成有机-无机杂化材料电化学传感器[7 - 9]。Fc的富电子性能和良好的反应活性可以与重金属Cu2+发生配位作用,RGO和Fc在GCE上形成的有机-无机杂化材料提高了检测的灵敏度,通过这一机理建立了超痕量Cu2+电化学检测新方法[10 - 12]。
1 实验部分
1.1 主要仪器与试剂
IS5红外光谱仪(美国,热电尼高力);TU-1901紫外光谱仪(北京普析通用仪器有限责任公司);CHI660E电化学工作站(上海辰华仪器有限公司),三电极体系:以修饰GCE作为工作电极,饱和甘汞电极作为参比电极,铂丝电极作为对电极。
二茂铁甲醛(Fc,萨恩化学技术(上海)有限公司),石墨(上海胶体化工厂),半胱氨酸(国药集团化学试剂有限公司),氯金酸(上海三爱思试剂有限公司),水合肼(天津市福晨化学试剂厂)。实验所用试剂均为分析纯,实验用水均为二次蒸馏水。
1.2 RGO的制备
参照文献方法[13]制备RGO。
1.3 FcSH的制备
FcSH合成路线如下:

取含有1.0 mmol L-半胱氨酸的10 mL无水乙醇溶液,置于圆底烧瓶中,在50~60 ℃油浴中,搅拌下滴加含有1.0 mmol二茂铁甲醛的10 mL无水乙醇溶液,反应4 h,过滤,并用少量无水乙醇洗涤,干燥后即得产物FcSH化合物。 红外光谱表明在波数1 606 cm-1处是-C=N伸缩振动,波数为3 057 cm-1、1 387 cm-1、1 122 cm-1处的峰为Fc的特征吸收峰, 2 570 cm-1是-SH伸缩振动。紫外光谱表明Fc基团的最大紫外吸收峰在225 nm处,-C=O基团最大吸收峰在265 nm处[14]。
1.4 传感器的制备
1.4.1FcSH/AuNPs/RGO/GCE电化学传感器的制备分别用0.3 μm和0.05 μm的Al2O3粉末将GCE抛光成镜面,依次用乙醇和二次蒸馏水超声清洗后,氮气流吹干。在处理后的GCE表面滴加RGO,静置风干后,将电极放在5 mmol的氯金酸溶液中,于-0.6 V~+0.6 V电位下,用循环伏安法沉积AuNPs,再将电极放入含有2 mmol/L FcSH化合物的乙醇溶液中浸泡48 h后取出电极,依次用乙醇和二次蒸馏水冲洗,氮气流吹干,即制FcSH/AuNPs/RGO/GCE电化学传感器。

图1 FcSH/AuNPs/RGO/GC 电化学传感器的制备Fig.1 Schematic illustration showing the preparation of the FcSH/AuNPs/RGO/GC sensor
1.4.2FcSH/AuNPs/RGO/GCE电化学传感器的电化学测定将三电极体系浸入含一定浓度Cu2+的0.1 mol/L HCl 支持电解质的电解池中,在-0.2 V~+0.6 V的电位范围内,阴极富集,于富集电位为-0.2 V,静置时间为180 s条件下进行方波伏安法扫描,记录方波伏安峰电流。
2 结果与讨论
2.1 RGO/GCE、AuNPs/GCE和AuNPs/RGO/GCE的扫描电镜形貌表征
从RGO/GCE、AuNPs/GCE和AuNPs/RGO/GCE的扫描电镜(SEM)形貌来看,图2A中RGO具有褶皱的卷曲状结构,图2B中AuNPs在GCE上以聚集的形式存在,图2C中AuNPs分散在RGO薄层上,AuNPs颗粒大小的变化表明了AuNPs和RGO之间有相互作用。
2.2 FcSH/AuNPs/RGO/GCE电化学传感器的的电化学表征
从RGO/GCE、AuNPs/GCE、AuNPs/RGO/GCE和FcSH/AuNPs/RGO/GCE的交流阻抗(图3)可以看出,FcSH/AuNPs/RGO/GCE共修饰电极增大了GCE的比表面积和导电性。从图4可以看出不同修饰电极在1.0×10-12mol/L Cu2+溶液(0.01 mol/L HCl)中检测,FcSH/AuNPs/RGO/GCE方波伏安峰电流最大,电化学响应最好,说明FcSH化合物对于痕量Cu2+具有很好的结合作用。

图2 GCE表面修饰层的扫描电镜(SEM)图Fig.2 SEM images of modified layer on GCEA.RGO/GCE;B.AuNPs/GCE;C.AuNPs/RGO/GCE.

图3 不同材料修饰GCE的阻抗(EIS)图Fig.3 EIS of GCE modified with different materials
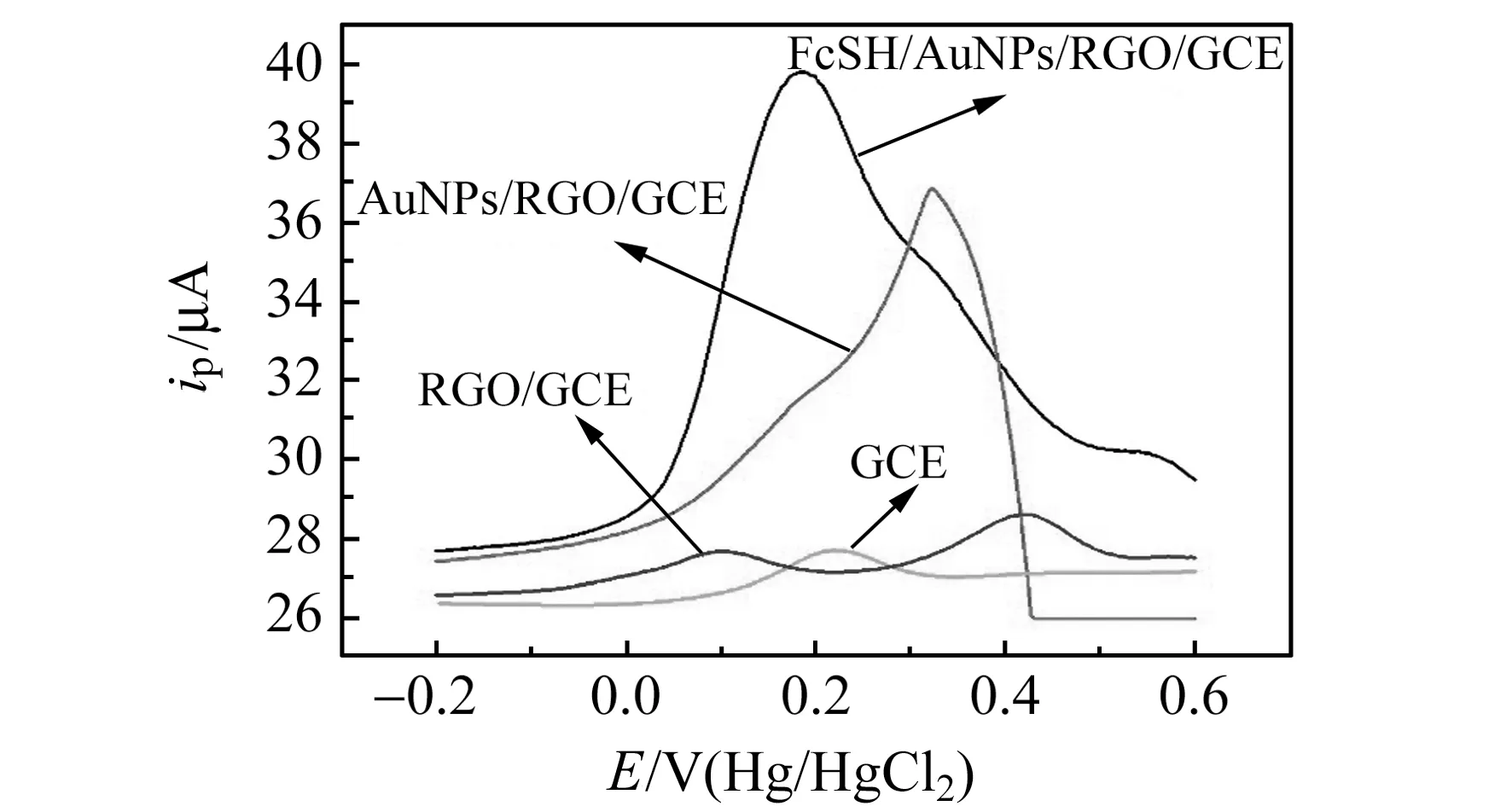
图4 Cu2+在不同材料修饰GCE上的方波伏安图Fig.4 Square -wave voltammograms of 1.0×10-12 mol/L Cu2+ at GCE modified with different materials
2.3 电化学实验条件的优化[14]
实验表明,支持电解质对Cu2+的方波伏安曲线影响较大,图5表示在含有1.0×10-12mol/L Cu2+的0.1 mol/L HCl、HNO3和 H2SO4的方波伏安曲线。由图可知,在HCl介质中体系的方波伏安曲线最好,峰电流最大,所以实验中选择HCl为支持电解质。进一步探讨了1.0×10-12mol/L Cu2+分别于0.001、0.01、0.1 mol/L HCl介质中的方波伏安曲线。如图6所示,在0.01 mol/L HCl中1.0×10-12mol/L Cu2+的方波伏安峰电流最大,所以实验中的HCl浓度选择为0.01 mol/L。同样讨论了富集时间对Cu2+的方波伏安峰电流的影响,结果表明最佳的富集时间为180 s。

图5 不同支持电解质中1.0×10-12 mol/L Cu2+的方波伏安图Fig.5 Square -wave voltammograms of 1.0×10-12 mol/L Cu2+ in 0.1 mol/L HCl,0.1 mol/L HNO3 and 0.1 mol/L H2SO4
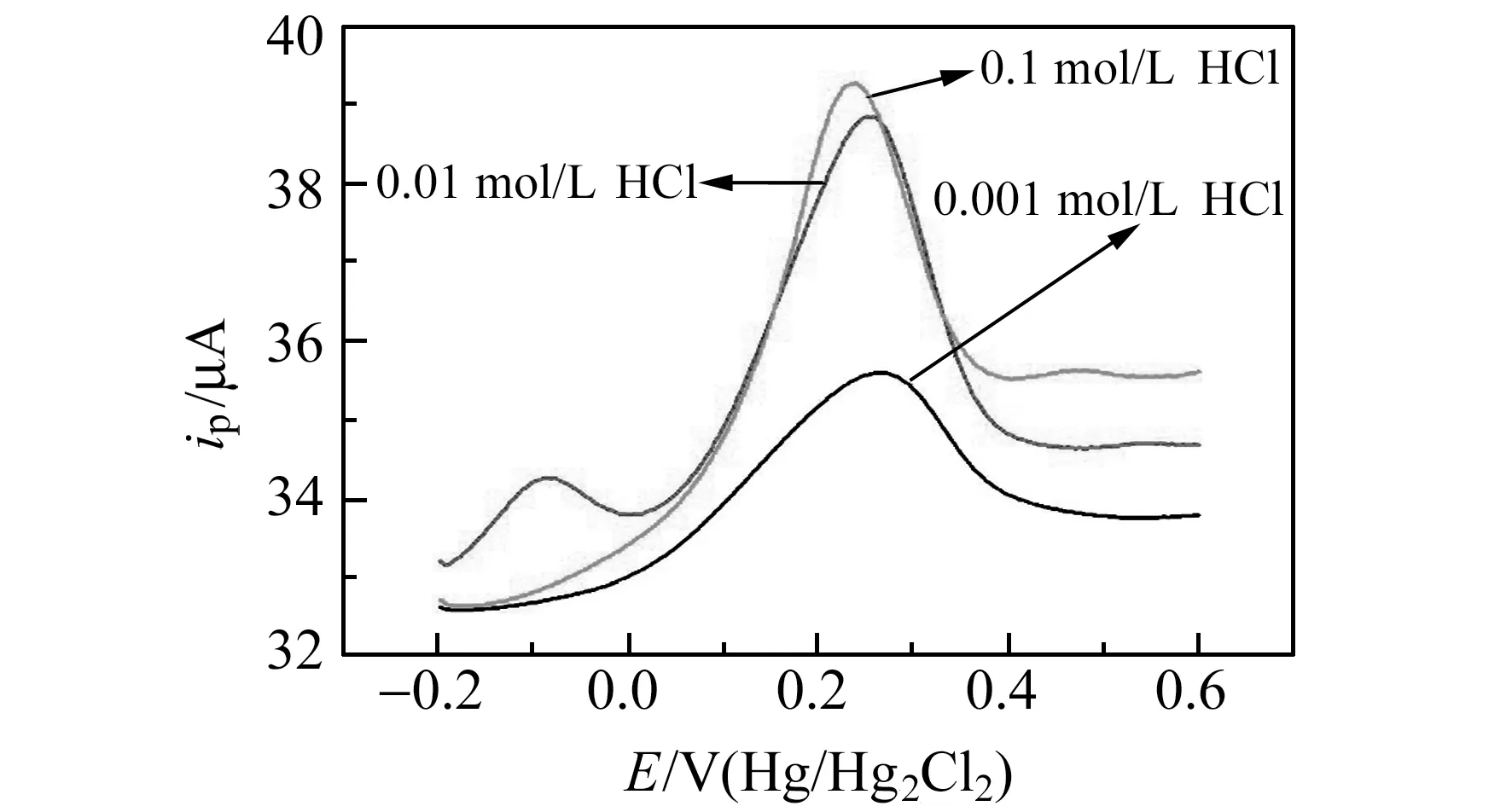
图6 不同浓度支持电解质中1.0×10-12 mol/L Cu2+的方波伏安图Fig.6 Square -wave voltammograms of 1.0×10-12 mol/L Cu2+ in 0.1 mol/L HCl,0.01 mol/L HCl and 0.001 mol/L HCl
2.4 FcSH/AuNPs/RGO/GCE电化学传感器应用
图7为FcSH/AuNPs/RGO/GCE 电化学传感器在最优化实验条件下,在 Cu2+浓度为1.0×10-12~1.0×10-11mol/L、1.0×10-11~1.0×10-10mol/L范围内的方波伏安曲线。结果显示Cu2+的浓度在上述范围内与其峰电流(ip)呈良好的线性关系,Cu2+浓度在1.0×10-12~1.0×10-11mol/L范围内的回归方程为:i(μA)=0.682c(1.0×10-12mol/L)+2.732,相关性系数为0.9866;Cu2+浓度在1.0×10-11~1.0×10-10mol/L范围内回归方程为:i(μA)=0.377c(1.0×10-12mol/L)+6.583,相关系数为0.9974,检出限(S/N=3)为0.94×10-12mol/L。对1.0×10-11mol/L Cu2+平行测定8次,相对标准偏差(RSD)为2.8%。
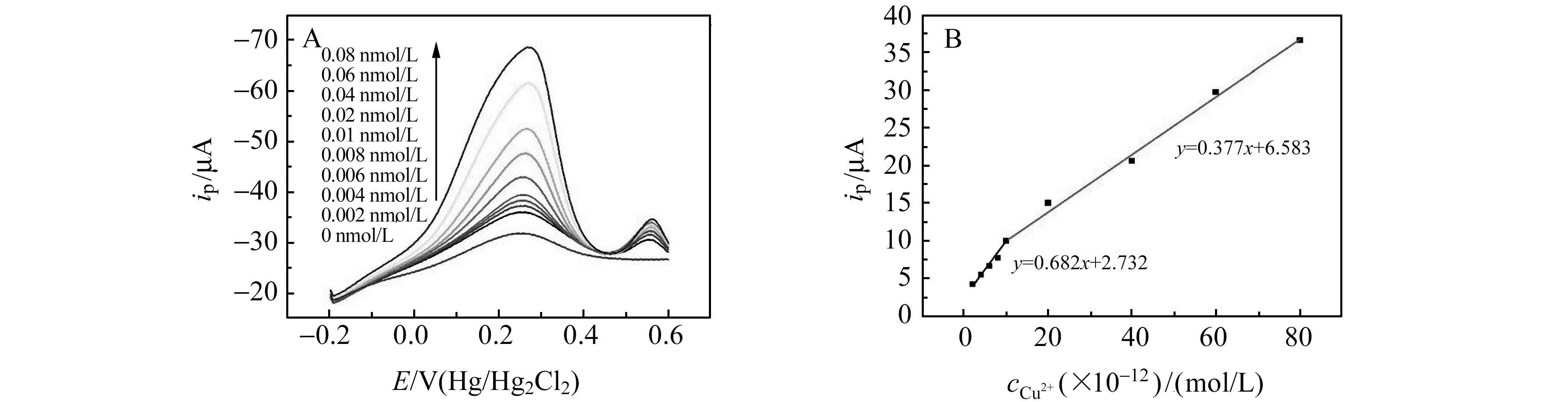
图7 不同浓度Cu2+在0.01 mol/L HCl中的方波伏安图(A)和Cu2+的校正曲线(B)Fig.7 Square -wave voltammograms of increasing Cu2+ concentration in 0.01 mol/L HCl(A) and the calibration curve of Cu2+(B)
2.5 方法的选择性和稳定性

2.6 分析应用
将本方法应用于已知Cu2+含量样品的检测,每个加标水平做6次平行实验,计算不同样品中的Cu2+含量,以考察该方法的精密度和回收率,具体结果见表l。从表1中可见回收率为92.9%~106.2%,RSD为2.6%~4.2%。说明该方法准确度较高[15 - 16]。
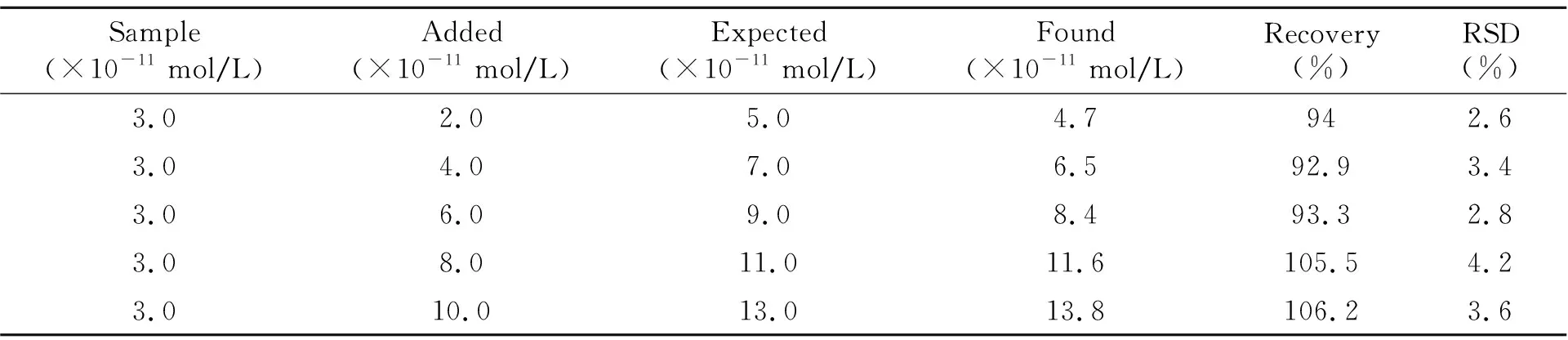
表1 加标回收实验结果
3 结论
本文基于FcSH/AuNPs/RGO/GCE电化学传感器,建立了电化学方波伏安法测定Cu2+的新方法。实验结果表明,该方法灵敏度高、检出限低,并具有良好的选择性、稳定性和重现性,可用于溶液中Cu2+的测定,显示了本方法在Cu2+检测方面具有良好的应用前景。
