肺叶与亚肺叶切除治疗60岁以上Ia期小细胞肺癌的预后比较分析
2018-09-03曾海康刘洋夏晓君李谨何建行
曾海康 刘洋 夏晓君 李谨 何建行
小细胞肺癌(small cell lung cancer, SCLC)是肺癌中一类特殊的恶性实体瘤,约占肺癌总数的10%-15%,发病与长期吸烟有关[1]。SCLC的特点是侵袭性强、增长迅速、早期易转移、具有癌旁内分泌特性,对放疗、化疗治疗较敏感[1,2],因此,目前的治疗多以化疗或放疗为主[3]。近年来,研究显示早期SCLC患者如病变仅局限于肺实质内,最初治疗方案考虑以手术治疗为主[4,5],最新的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南表明,对于明确无淋巴结转移的I期(T1-2N0)SCLC患者,推荐行手术治疗[6]。
目前指南已强烈推荐,电视辅助胸腔镜(video assisted thoracic surgery, VATS)微创手术治疗肺癌,标准术式为肺叶切除术。对于早期小肺癌(≤3 cm),亚肺叶切除(楔形/肺段)术式可在完整切除肿瘤的基础上、最大限度地保护了患者肺功能,现已较普遍应用于早期肺癌的外科治疗[7,8]。已有多项研究证实,亚肺叶切除术式治疗对各年龄段、早期非小细胞肺癌(non-small cell lung cancer, NSCLC)的生存预后结果中,取得了与肺叶切除治疗类似的术后预后[9-13]。
有术者考虑到亚肺叶(楔形/肺段)切除治疗的优势和SCLC快速生长、对化放疗敏感等特性,认为亚肺叶切除或可作为SCLC的姑息性手术治疗方案之一,尤其是针对心肺功能衰退的老年SCLC患者。然而,目前关于亚肺叶切除治疗IaA期SCLC、以及与肺叶切除的对比研究及预后报道较少,早期SCLC的手术治疗方式(肺叶/亚肺叶切除)和选择仅为NCCN专家组的倾向意见,缺少有力的循证医学证据支持。
鉴于此,本研究通过选择年龄≥60岁的T1N0M0(≤3 cm)SCLC患者,进行回顾性研究和统计分析,旨在探索肺叶切除与亚肺叶切除治疗早期SCLC生存预后的对比,以及影响术后预后的相关临床病理因素。
1 资料和方法
1.1 资料 通过美国国立癌症研究所“监测、流行病学和结果数据库(Surveillance, Epidemiology and End Results database, SEER)”数据库,使用SEER*Stat8.3.4软件检索该数据库,获取SCLC的临床病理特征资料及相关预后信息。本研究最终纳入1992年1月-2010年12月,共515例SCLC患者。纳入标准:(1)病理证实T1N0 SCLC(≤3 cm);(2)年龄≥60岁;(3)存在一个原发性恶性病变[按照国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)第7版TNM分期标准,pT1N0M0]。
根据SEER数据库,获取了以下信息:患者基本信息(年龄、性别、种族)、肿瘤相关特征(大小及位置)、淋巴结检查、放化疗、外科手术治疗及预后情况。总队列中,将患者分为肺叶切除(Lob)、亚肺叶切除(Sub)和非手术队列(Non-surgical)。在手术(肺叶+亚肺叶切除)队列中,首先根据是否行淋巴结采样/清扫分为2个亚组(是:n=99;否:n=43);然后根据术后有无放化疗分为4个亚组:肺叶切除加放化疗组(Lob+CR,n=59)、单独行肺叶切除组(Lob,n=51)、亚肺叶切除加放化疗组(Sub+CR,n=35)、单独行亚肺叶切除组(Sub,n=22)。
1.2 研究结果及随访 本研究的终止日期为2013年12月31日,总生存期(overall survival, OS)定义为从确诊SCLC开始,至因任何原因引起死亡的时间间隔;失访或研究终止日期仍存活定义为删失。肺癌特异性生存期(lung cancer specific survival, LCSS)定义为确诊SCLC至肺癌致死的时间间隔;失访或其他死亡原因致死或研究终止日期仍存活则定义为删失。该研究总队列的平均随访时间(median follow-up time, MFT)为36(范围0-120)个月。
1.3 统计学方法 计量资料用均数±标准差(Mean±SD)表示,计数资料用百分比(%)表示。Kaplan-Meier法(Log-rank检验)比较生存曲线及统计学差异。用Kaplan-Meier法单因素分析得出有意义的临床病理因素纳入Cox回归模型进行多因素分析。所有数据均采用SPSS 20.0软件进行统计学分析。生存曲线使用GraphPad Prism 5.01软件作图。检验水准:P<0.05有统计学意义。
2 结果
2.1 一般结果 本研究纳入1992年1月-2010年12月,共515例≥60岁T1N0M0 SCLC。其中167例(33%)接受手术切除(94例接受术后化疗、22例接受术后放疗、73例仅手术治疗);348例(68%)接受非手术治疗。整个队列的平均年龄为72岁(60岁-95岁),平均肿瘤大小为2.1(范围0.4 cm-3 cm)cm,平均随访时间为36(范围1个月-120个月)个月。在肺叶切除组(110例)中,78例(71%)患者接受了淋巴结采样及病理检查;亚肺叶切除组中(57例)中,21例(37%)患者接受了淋巴结采样及病理检查。亚肺叶切除手术方式为:楔形切除23例、部分/楔形/节段切除27例(1992年-1997年)、肺段切除4例(表1)。
2.2 总队列的OS及LCSS 本研究中肺叶切除组、亚肺叶切除组、和非手术治疗组的中位OS分别为45个月、23个月和16个月,该三组相应的5年OS分别为44%、30%和14%(LobvsSub,χ2=4.851,P=0.028;Subvsnon-surgical,χ2=6.529,P=0.011;图1A)。中位LCSS在肺叶切除组、亚肺叶切除组、和非手术治疗组中分别为65个月、29个月和18个月,该三组相应的5年LCSS分别为55%、41%和21%(LobvsSub,χ2=2.694,P=0.101;Subvsnon-surgical,χ2=8.617,P=0.003;图1B)。
2.3 手术队列的OS和LCSS 在淋巴结采样/清扫检查精确计数的手术队列中(n=142),有淋巴结检查(n=99)和无淋巴结检查(n=43)的患者中位OS分别为42个月和23个月,其相应的中位LCSS分别为64个月和24个月。有无淋巴结检查患者的5年OS分别为42%和31%(有vs无,χ2=2.600,P=0.107;图2A),相应的5年LCSS分别为52%和41%(有vs无,χ2=0.275,P=0.600;图2B)。
2.4 术后联合放化疗(CR)比较 总共167例患者被分为以下几组:肺叶切除+放化疗组(Lob+CR,n=59)、单独肺叶切除组(Lob,n=51)、亚肺叶切除+放化疗组(Sub+CR,n=35)、单独亚肺叶切除组(Sub,n=22)。该四组的中位OS分别为未定义、29个月、25个月和19.5个月;该四组5年OS分别为:50%、36%、37%和17%(Lob+CRvsLob,χ2=4.210,P=0.040;LobvsSub+CR,χ2=0.094,P=0.759;Sub+CRvsSub,χ2=4.091,P=0.043;图3A)。中位LCSS在肺叶切除+放化疗组、单独肺叶切除组、亚肺叶切除+放化疗组及单独亚肺叶切除组中分别为122个月、62个月、111个月和19.5个月;四组5年LCSS分别为57%、52%、50%和20%(Lob + CRvsLob,χ2=2.674,P=0.102;LobvsSub+CR,χ2=0.466,P=0.495;Sub+CRvsSub,χ2=4.936,P=0.026;图3B)。

表1 515例Ia期SCLC患者的临床特征[n(%)]Tab 1 Clinical characteristics of 515 patients with stage Ia SCLC[n(%)]
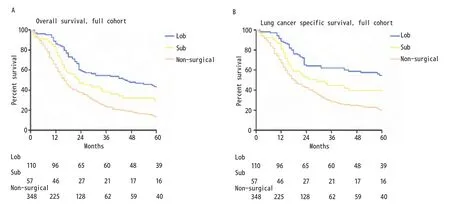
图1 Ia期SCLC患者肺叶切除组、亚肺叶切除组及非手术组的生存曲线.A:OS曲线(Lob vs Sub, χ2=4.851, P=0.028; Sub vs non-surgical, χ2=6.529,P=0.011);B:LCSS曲线(Lob vs Sub, χ2=2.694, P=0.101; Sub vs non-surgical, χ2=8.617, P=0.003)。Fig 1 Kaplan-Meier survival curves between stage Ia SCLC patients with Lob, Sub and non-surgical cohort.A: OS curve (Lob vs Sub, χ2=4.851,P=0.028; Sub vs non-surgical, χ2=6.529, P=0.011); B: LCSS curve (Lob vs Sub, χ2=2.694, P=0.101; Sub vs non-surgical, χ2=8.617, P=0.003).

图2 手术队列中淋巴结检查组与对照组的生存曲线。A:OS曲线(有 vs 无,χ2=2.600,P=0.107);B:LCSS曲线(有 vs 无, χ2=0.275, P=0.600)。Fig 2 Kaplan-Meier survival curves between stage Ia SCLC patients with and without ELN in the surgery cohort.A: OS curve (with vs without,χ2=2.600, P=0.107); B: LCSS curve (with vs without, χ2=0.275, P=0.600).
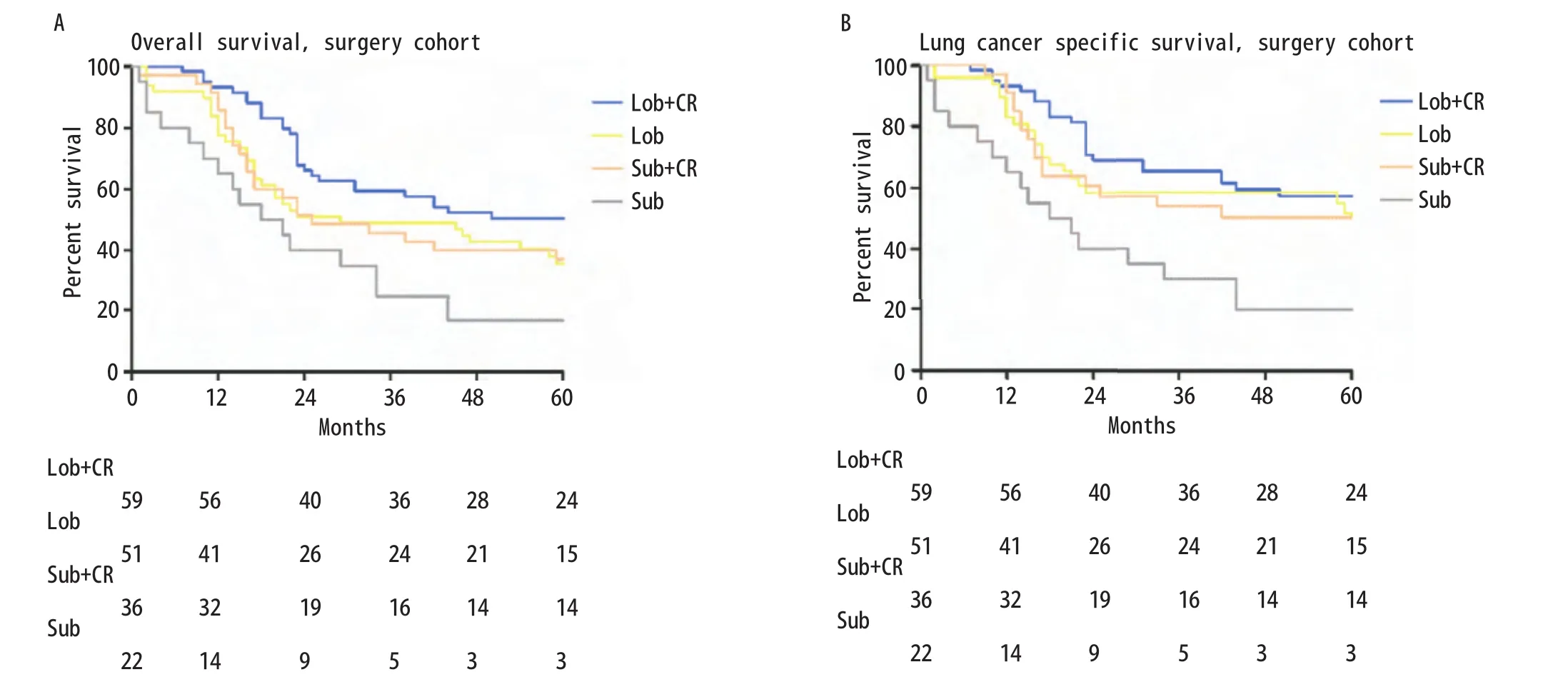
图3 Ia期SCLC患者肺叶切除+放化疗组、单独肺叶切除组、亚肺叶切除+放化疗组及单独亚肺叶切除组的生存曲线。A:OS曲线(Lob+CR vs Lob, χ2=4.210,P=0.040; Lob vs Sub+CR, χ2=0.094, P=0.759; Sub+CR vs Sub, χ2=4.091, P=0.043);B: LCSS曲线(Lob+CR vs Lob, χ2=2.674, P=0.102; Lob vs Sub+CR, χ2=0.466, P=0.495; Sub+CR vs Sub, χ2=4.936, P=0.02)。Fig 3 Kaplan-Meier survival curves between stage Ia SCLC patients with Lob+CR, Lob, Sub+CR and Sub cohort.A: OS curve (Lob+CR vs Lob,χ2=4.210, P=0.040; Lob vs Sub+CR, χ2=0.094, P =0.759; Sub+CR vs Sub, χ2=4.091, P=0.043); B: LCSS curve (Lob+CR vs Lob, χ2=2.674, P=0.102; Lob vs Sub+CR, χ2=0.466, P=0.495; Sub+CR vs Sub, χ2=4.936, P=0.02).

表2 Ia期SCLC患者总生存和肺癌特异性生存的单变量分析Tab 2 Univariate analysis of overall survival and lung cancer specific survival for Ia SCLC

表3 Ia期SCLC患者总生存和肺癌特异性生存的多变量分析Tab 3 Multivariate analysis of overall survival and lung cancer specific survival for Ia SCLC
2.5 单因素和多因素统计分析 通过Kaplan-Meier法单因素分析显示(表2):有意义的临床病理因素为年龄、肿瘤大小、淋巴结检查计数、是否手术、放疗、化疗(P<0.05)。Cox多因素分析表明(表3):淋巴结检查、手术(肺叶切除/亚肺叶切除)、放化疗是独立的预测预后因素。与亚叶切除术相比,肺叶切除术可改善患者的OS(LobvsSub, HR=0.645, 95%CI: 0.433-0.961,P=0.031),但对LCSS并无明显差异(LobvsSub,HR=0.703, 95%CI: 0.459-1.078,P=0.106)。
3 讨论
众所周知,SCLC对放化疗敏感,但最终大多数会复发、其预后较其他类型肺癌差。本研究结果发现,对于年龄≥60岁T1N0M0的SCLC患者,肺叶切除的术后生存率明显高于亚肺叶切除(5年OS分别为44%和30%,P=0.028)。在总队列中,手术治疗队列相较于非手术队列能带来更好的预后(非手术队列5年OS仅为:14%)。此外,肺叶切除+辅助放化疗联合的患者生存率最高(5年OS为50%)。结果证实,肺叶切除联合术后放化疗治疗年龄≥60岁、肿瘤大小≤3 cm的SCLC患者的优势显著,而Ia期SCLC手术方案的选择上行亚肺叶切除并不能得到令人满意的结果,其预后较肺叶切除更差(中位OS分别为23个月和45个月,5年OS为30%和44%,P=0.028)。
Weksler等[14]的回顾性研究报道了3,566例I期或II期SCLC患者,其结果显示手术患者的术后中位生存期(34个月)明显高于非手术患者(16个月,P<0.001);肺叶切除或全肺切除组术后的中位生存期为39个月,明显优于楔形切除组患者(28个月,P=0.001),该研究结果与本研究类似。我们认为,亚肺叶切除相较于肺叶切除治疗早期SCLC效果差,主要与SCLC恶性程度高、早期容易转移的特性相关;选择亚肺叶切除术式,虽然能更好地保护患者的肺功能,但可能对肿瘤所在肺叶内的潜在远处转移控制欠佳。针对SCLC侵袭强和早期易转移等特性,选择肺叶切除治疗切除范围更大,尽管较大程度损害了肺功能,但保证了病灶肺叶的完整切除,降低了潜在复发及转移的风险,对患者远期生存更有益。
本研究结果显示,亚肺叶切除+术后放化疗组相较于单纯肺叶切除组患者的生存预后,结果无统计学差异(P=0.759),故亚肺叶切除+辅助放化疗是否可改善生存还需进一步验证。有研究证实NSCLC患者行肺叶切除术+淋巴结采样/清扫检查,可改善患者的生存预后[15],但本研究的SCLC手术队列中,行淋巴结采样/清扫检查与无淋巴结采样/清扫检查患者相比,预后差异无统计学意义(P=0.107);但Cox多变量分析结果却显示,淋巴结检查是OS和LCSS有益的的独立预后因素(OS:HR=0.516,P<0.001; LCSS: HR=0.564,P<0.001)。造成单因素分析无统计学意义的原因,可能在于样本量少及潜在的选择性偏倚有关。
最新NCCN指南推荐I期SCLC的治疗方式为手术+辅助化疗[6],但SCLC选择手术治疗的现状却不尽人意。Wakeam等[16]研究纳入的9,740例T1-2期SCLC患者的手术率仅为(23%),其中2/3可手术患者(即符合手术条件患者)未选择手术治疗。这与本研究纳入的Ia期老年SCLC患者的手术治疗率(32%)类似。因此,早期SCLC患者手术治疗率还有较大提升空间。Naidoo等[17]综述道,胸外科的VATS手术正在高速发展,新技术对比传统开胸手术有更多优点:术后疼痛减轻、住院时间缩短、气体漏出减少、肺炎和房性心律失常降低,同时炎症介质的释放也较开胸手术少,且VATS较于传统开胸手术的无病生存率和整体生存率是相当的。微创胸外科的发展,增加了患者手术机会,手术可选择的术式也随之增加。所以,我们相信未来对于早期SCLC的手术治疗及术式的选择会有更多的关注与改进。
本研究中,T1N0M0 SCLC(≤3 cm)在接受肺叶切除术+辅助放化疗的患者5年OS最高(50%),这说明,即使Ia期SCLC,辅助放化疗对其预后也至关重要。这与NSCLC不同,Liang等[18]在其综述中总结道:NSCLC在Ia期术后进行化疗对于生存率无明显改善,Ib期是否行辅助化疗仍有争议,故一般在可切除的Ia期NSCLC患者术后不推荐行辅助化疗,而辅助放疗在NSCLC中的价值有待证实[19]。邵为朋等[20]在对SCLC治疗策略的综述中提到:目前针对SCLC的治疗仍然是延续近30年传统的放化疗为基础的治疗,并展望未来多方式综合治疗(放化疗+靶向治疗+免疫治疗)或许能给SCLC患者带来一线生机。因此,不管Ia期SCLC切除术式如何选择,其术后放化疗的效果也不可忽视。我们期待未来在手术治疗SCLC的基础上,搭配放化疗+靶向治疗+免疫治疗等综合治疗能给患者带来更好的治疗效果。
然而,本研究仍存在以下局限。第一,回顾性分析的研究性质;第二,虽然本研究纳入了SEER数据库共515例Ia期SCLC患者,选择亚肺叶切除治疗的这部分早期患者仍存在一定的选择性偏倚;且可能造成此偏倚患者的肺功能、伴随的心血管疾病等信息在SEER数据库中无法获得。第三,本研究纳入的Ia期SCLC患者病例数量仍偏少、术后随访时间较短。
总之,本研究通过对比肺叶切除和亚肺叶切除治疗Ia期SCLC的预后分析,结果证实Ia期患者行亚肺叶切除治疗预后较肺叶切除差。针对年龄≥60岁的T1N0M0(≤3 cm)可手术切除SCLC患者,我们建议首选解剖性肺叶切除+辅助放化疗治疗。在新技术快速发展及其带来许多优势前提下,本研究结果的科学性和普遍性还需将来多中心、大样本及前瞻性的临床研究来进一步证实和完善。
