脂肪干细胞移植对大鼠脑缺血后微血管生成及MT1-MMP表达的影响
2018-09-03林小娟陈建豪郑智楷杨凌杰
林小娟 唐 毅△ 陈建豪 郑 伟 郑智楷 杨凌杰
1) 福建省立医院北院 福建省老年医院 福建医科大学教学医院神经内科,福建 福州 350003 2)福建省立医院康复科,福建 福州 350003
脂肪来源干细胞(adipose-derived stem cells,ADSCs) 是近年来从脂肪组织中分离得到的一种具有多向分化潜能的干细胞。许多研究表明[1-2]ADSCs移植有利于脑缺血大鼠神经功能的康复。在这个过程中,血管新生对神经细胞的保护作用至关重要,尤其在新生血管的萌芽阶段[3-5]。1994年,SATO等[6-8]第一次识别MT1-MMP,是第一种被鉴定锚定在细胞膜上的不可溶性的基质金属蛋白酶,并发现它在血管新生中起着重要作用。MT1-MMP可以在缺血局部降解基底膜和细胞外基质的有效成分,并在血管稳定中起关键作用,同时其能减少渗漏并促进血管新生[9]。在体外实验中,大量证据表明MT1-MMP可促进外周血管新生[10-13],但在促进脑血管新生方面研究较少。本研究旨在建立稳定的大脑中动脉闭塞(MCAO)模型,通过检测ADSCs移植后大鼠脑组织血管的新生和MT1-MMP的表达,探讨ADSCs移植对缺血性卒中后MT1-MMP相关性血管新生的影响。
1 材料与方法
1.1实验动物和分组健康雄性清洁级大鼠,每只质量250~300 g,购自上海斯赖克公司,许可证号:SCXK沪2007-0005)。大鼠随机分为3组,其中假手术组5只大鼠,MCAO组及ADSCs组各15只大鼠;各组按术后4 d、7 d、14 d不同时间点再分为3个亚组,每个亚组5只。
1.2大鼠MCAO模型制备制备MCAO大鼠模型参考改良Zea-Longa线栓法[14],方法如下:将大鼠麻醉并固定于手术台上,取颈部正中切口,逐步将右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)分离,先后在ECA和CCA近心端结扎,并于CCA近分叉处剪手术切口,插入线栓深度约18 mm,阻断大脑中动脉的所有血液来源,扎紧备线,最后缝合皮肤切口。以同样方法处理假手术组大鼠,但是不插入线栓。
1.3脂肪来源干细胞的分离、培养、纯化与鉴定取健康清洁级的体质量为80~100 g的雄性SD大鼠,ADSC的分离、培养、扩增和传代,用第3代经流式细胞术,鉴定证实为ADSC的细胞用于移植实验。
1.4神经功能缺损评分造模后第4、7、14天,采用mNSS量表对各组大鼠进行神经功能评诂。mNSS评分包括运动、感觉、反射和平衡4部分,总分为0~18分,分值越大,神经功能缺损越严重。
1.5免疫组织化学法检测各组大鼠FⅧ-R Ag标记阳性血管内皮细胞各组大鼠脑组织常规石蜡切片进行免疫组织化学法检测。先后滴加RAG-1 Antiody (工作浓度约1:300),兔抗人MT1-MMP抗体(工作浓度1:250),4 ℃孵育过夜。次日标本复温后,经清洗3次后,再先后滴加荧光二抗FITC标记山羊抗小鼠IgG(H+L),Cy3标记山羊抗兔IgG(H+L);避光孵育1 h,室温显色,然后封片、镜检。
1.6 Western Blot检测蛋白浓度按蛋白抽提试剂盒说明书提取各组大鼠脑组织蛋白,Bradford法测定蛋白浓度。蛋白样品电泳、转膜、封闭,分别加入一抗:兔抗人MT1-MMP抗体(工作浓度1:500),β-Actin(工作浓度约1:500),加入二抗:辣根过氧化物酶标记山羊抗兔IgG(H+L)(工作浓度1:2 000),山羊抗小鼠IgG(H+L)(工作浓度1:3 000)重复洗涤3次后;ECL液显色,成像。Image J软件分析数据。
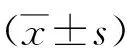
2 结果
2.1大鼠神经功能mNSS评分造模4 d后,ADSCs组mNSS评分与MCAO组相比,差异无统计学意义(P>0.05);造模后7 d、14 d,ADSCs组mNSS评分优于同期MCAO组(P<0.05)。见表1。
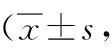
表1 大鼠神经功能mNSS评分结果分)Table 1 Results of mNSS score of nerve function in
2.2大鼠缺血周边区新生血管密度(MVD)分析激光共聚焦显微镜显示,脑缺血大鼠梗死周边区散在分布FⅧ-R Ag标记的血管内皮细胞(图1),术后4 d,MCAO组脑缺血大鼠梗死周边区可见微血管新生,于术后7 d、14 d达高峰;而在相应的各时间点,ADSCs组较MCAO组微血管新生现象更为明显,差异有统计学意义(P<0.05)。见表2。
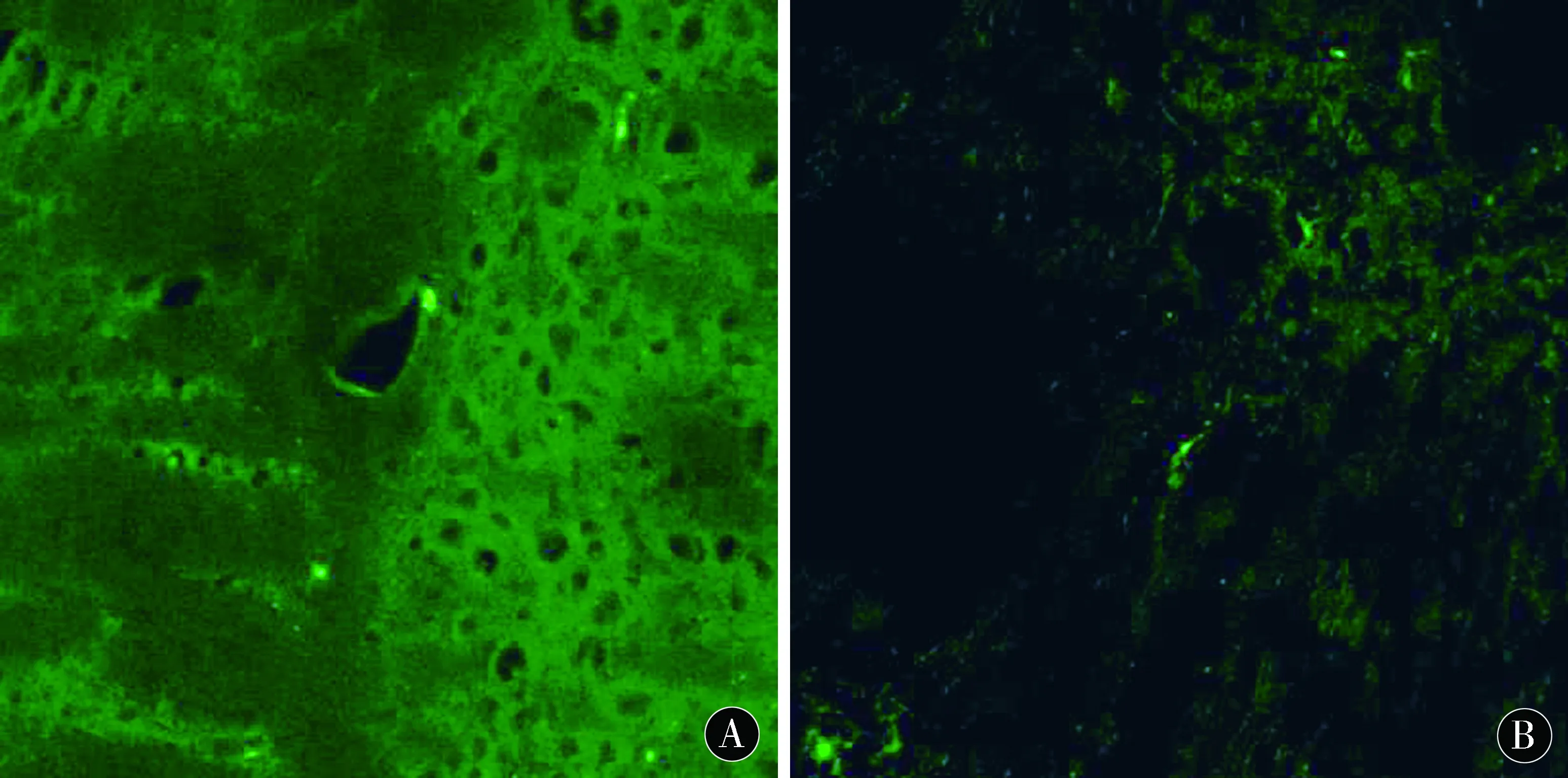
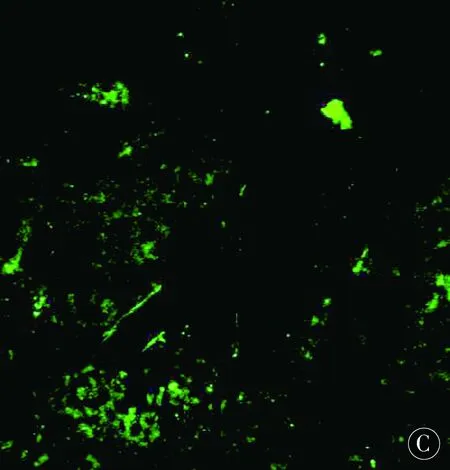
图1 ADSCs移植后4 d、7 d、14 d,MCAO大鼠脑缺血周边区可见大量FⅧ-R Ag标记阳性血管(标尺=100 μm)Figure 1 4 d,7 d and 14 d after ADSCs transplantation,a large number of ADSCs can be seen in the peripheral area of cerebral ischemia in MCAO rats FⅧ-R Ag markers positive blood vessels(ruler =100 μm)
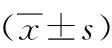
表2 各组脑组织中缺血周边区MVD分析Table 2 MVD analysis of peripheral ischemia in brain tissue of each
2.3大鼠脑缺血周边区MT1-MMP的蛋白表达假手术组中MT1-MMP均呈低水平表达。MCAO组术后4 d可见MT1-MMP表达水平升高,术后7 d表达水平达高峰,而14 d时表达水平有所下降。ADSCs组中,MT1-MMP表达水平在各时间点有同样的趋势;移植术后4 d、7 d,MCAO组MT1-MMP表达水平均明显升高,差异有统计学意义(P<0.05)。见图2、表3。移植术后14 d,2组表达水平无显著差异。此外可见缺血区MT1-MMP的蛋白表达变化。见图3。通过双重荧光免疫组化标记,在脑缺血大鼠梗死周边区,在新生的微血管内皮细胞上可见MT1-MMP及Ⅷ因子共表达(图4)。
3 讨论
ADSCs是ZUK等[15]于2001年首次从人的脂肪组织中抽取而后悬液中分离获得,相对于其他干细胞,具有易于取材、分离容易、能逃避免疫排斥反应等诸多优点,脂肪来源干细胞已成为极具前景的种子细胞之一[16-19]。研究表明[20],脂肪干细胞能促进缺血性卒中大鼠梗死区血管新生。其中的机制可能通过上调VEGF和bFGF的表达[21],促进血管新生;也可以通过Notch1-Dll4信号通路,提高Notch1受体及Dll4配体在血管内皮细胞上的表达,促进微血管生成,从而起到对脑缺血大鼠的脑保护作用。

表3 各组中缺血脑组织周边区MT1-MMP的蛋白表达Table 3 Protein expression of mt1-mmp in peripheral areas of ischemic brain tissue in each
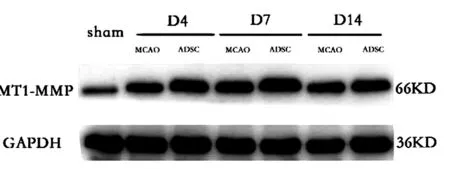
图2 各组中MT1-MMP的蛋白表达Figure 2 Protein expression of MT1-MMP in each group
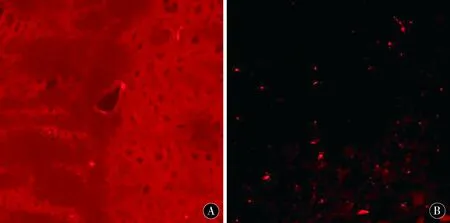
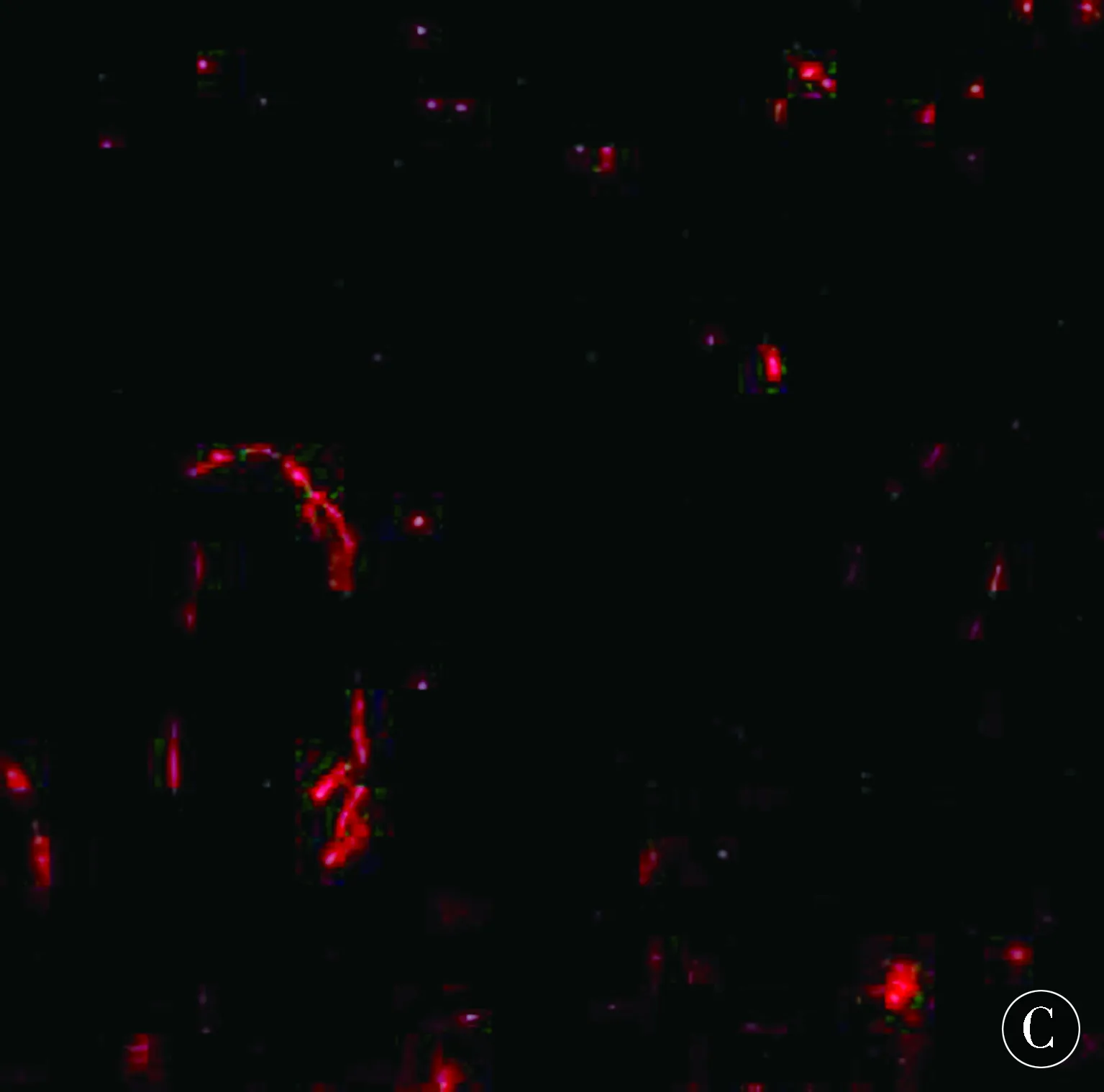
图3 ADSCs移植后4 d、7 d、14 d MT1-MMP在大鼠脑部的表达Figure 3 Expression of MT1-MMP in the brain of rats 4 d,7 d and 14 d after ADSCs transplantation
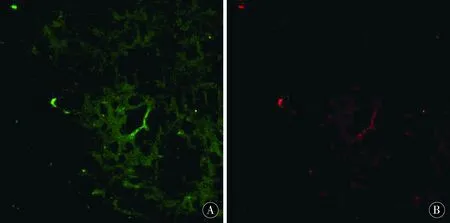
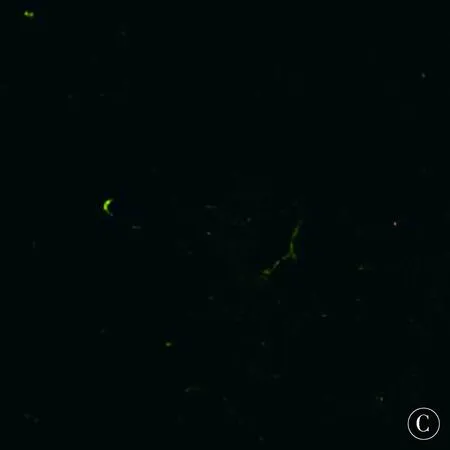
图4 MT1-MMP与FⅧ-R Ag标记新生血管共表达在微血管内皮细胞上Figure 4 MT1-MMP and FⅧ-R Ag marked the co-expression of neovascularization in microvascular endothelial cells
MT1MMP在血管损伤时,负责降解内皮细胞外基质,参与内皮细胞的迁徙及归巢等[22-25],并重塑血管内皮细胞[26-28]。通过细胞间环境的修饰,MT1-MMP可以使血管内皮细胞或黏附分子信号转导发生改变,从而影响内皮细胞的功能,继而促进血管新生[29-32]。相关研究表明,MT1-MMP基因沉默动物模型可见到血管新生抑制现象[33-34],提示MT1-MMP对血管新生的影响。而ADSCs移植是否通过调节MT1-MMP促进脑血管新生,目前研究较少。许多研究证实,FⅧ-RAg是直接反映血管新生的指标,其标记血管内皮细胞的特异性和敏感性均很强;通过MT1-MMP与FⅧ-RAg的共同标记,可证明MT1-MMP对血管新生的影响。
本次试验成功建立了MCAO大鼠模型,并移植ADSCs。相比MCAO组及ADSCs组,造模后4d,神经功能康复比较无明显差异;在7d、14d,ADSCs组较MCAO组神经功能康复明显改善。大鼠脑缺血周边区域,我们观察到ADSCs组脑缺血周边区微血管新生,且较MCAO组显著增多,证实ADSCs移植确能促进血管新生;在双重免疫荧光标记后,我们发现在脑缺血大鼠梗死区新生内皮细胞上FⅧ-RAg与MT1-MMP共表达,提示MT1-MMP参与了大鼠脑缺血后梗死周边区血管新生。通过Western-blot印迹分析,在术后4d,MCAO组可见MT1-MMP表达升高,术后7d达到高峰;而ADSCs组较MCAO组MT1-MMP表达水平明显升高;提示ADSCs移植可促进大鼠梗死周边区MT1-MMP表达的作用;在术后14d时,MT1-MMP表达水平无明显升高,提示MT1-MMP可能在血管新生早期萌芽阶段起作用,这与以往的研究结果相符合[35-38]。因而考虑ADSCs移植的脑保护作用可能部分是通过MT1-MMP的表达上调,从而促进血管新生,特别在早期血管新生阶段,最终保护神经细胞,促进神经功能康复。
ADSCs移植后能够促进MT1-MMP在脑缺血大鼠梗死周边区新生血管内皮细胞上的表达,从而促进血管新生,保护神经细胞,最终达到神经功能康复。
