高原环境中妊娠期不同程度缺氧对胎羊心肌组织基质金属蛋白酶8蛋白表达的影响
2018-09-01李华李云胡劼陈晓峰唐莎
李华 李云 胡劼 陈晓峰 唐莎
830000 乌鲁木齐,新疆医科大学附属中医医院心脏超声科
高原是一种复杂的低温、低压、低氧环境,已有研究表明妊娠期母体长期暴露于高原环境中,可能会诱导胎儿心脏发育程序改变,导致出生后心脏组织器官结构与功能的永久改变[1-3]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是降解细胞外基质成分的最主要蛋白水解系统,对维持心肌组织正常结构和功能起重要作用[4-5]。近年来,对MMPs与缺氧造成的心肌结构和功能改变关系的研究主要集中在 MMP-2、MMP-3、 MMP-9 等[6],而高原环境缺氧对胎儿心肌组织的影响与 MMP-8 关系的研究甚少。因此,本实验通过观察分析不同海拔的高原环境缺氧导致胎羊心肌组织、线粒体结构及胶原含量的病理性改变,结合各组胎羊心肌组织中MMP-8蛋白的变化,以期为高原环境下妊娠期缺氧诱导先天性心脏病的发生发展提供理论基础和依据。
1 材料与方法
1.1 实验材料
实验选用新疆医科大学实验动物中心提供的清洁级性成熟人工授精配种成功的平原妊娠期绵羊24只,体重25~35 kg,年龄相近,约8~10个月;西北地区特殊环境人工模拟实验舱(DYC-3010M)(新疆医科大学),超纯水仪(milli-Q Integral 3),电热鼓风干燥箱(101-2AB),正置荧光显微镜(Olympus,CX31),扫描电子显微镜(Hitachi S-4800),Image pro plus图像分析系统。
1.2 实验分组
按照简单随机抽样法将24只平原妊娠期绵羊分为3组:平原对照组(8只)、轻度低氧组(8只)和重度低氧组(8只)。
1.3 实验方法[7]
应用人工实验舱,通过调整人工实验舱各项参数,精确模拟平原和高原低氧的气候环境,平原对照组于平原环境人工实验舱内饲养,轻度低氧组、重度低氧组分别于模拟西北地区海拔 3 000 m 及 5 000 m 环境的低压高寒环境人工实验舱中饲养。各组饲养期间动物自由饮水进食,每隔24 h开舱30 min添加水及饲料,舱内饲养持续整个妊娠期。
1.4 标本收集和处理
实验结束后,麻醉处死各组母体绵羊后,剖腹取出胎羊,取出心脏,迅速剪去各组胎羊 2 块心尖1 mm3大小心肌组织供扫描电子显微镜观察、Masson 染色观察和 Western Blot 检测。将剩余标本液氮速冻后-80℃冰箱内保存。
1.5 扫描电子显微镜检测
将心肌组织按组装入5 ml 样品管中,加入体积分数2.5% 2 ml 戊二醛溶液4℃过夜固定,分别用50%、70%、85%、95%酒精、无水乙醇Ⅰ、Ⅱ、Ⅲ进行梯度脱水各15 min,样本干燥处理、喷金后,于扫描电子显微镜下观察并摄片切片。
1.6 Masson 染色
取一块心肌组织,采用 Masson 三色法进行染色,按照石蜡包埋、切片、脱蜡、浸染、冲洗和封片的步骤制片后在正置显微镜下观察。心肌细胞染成红色,胶原纤维染成蓝色。选取各组的 Masson 染色切片,每张切片随机选取 5 个视场,每个视场选取 5个阳性表达区域, 采用 Image pro plus图像分析系统分析计算胶原蛋白所占面积百分比,红色代表胶原阳性染色。心肌胶原面积分数=胶原面积/全视野面积×100%
1.7 Western blot 检测
每组样本取 0.2 g 心肌组织,按照提取总蛋白、蛋白浓度的测定、SDS-PAGE电泳、转膜、抗体孵育、显色与分析;放入X 胶片曝光、显影、定影的步骤对MMP-8蛋白的含量进行检测。凝胶扫描成像测定的目标带单位密度和内参蛋白 β-actin 条带比较后进行统计分析。
1.8 统计学方法

A:平原对照组;B:轻度低氧组;C:重度低氧组图1 扫描电子显微镜观察各组胎羊心肌组织的超微结构

A:平原对照组;B:轻度低氧组;C:重度低氧组图2 各组胎羊心肌胶原含量的分析
2 结果
2.1 心肌组织和线粒体的超微结构
如图1所示, 平原对照组显示肌原纤维平行排列,边缘整齐,肌节呈规律性分布,肌丝基本位于同一平面,线粒体规则地散在分布于肌原纤维中间、胞膜下和核周区,呈长条蚯蚓状;与平原对照组比较,轻度低氧组可以观察到心肌组织排列稍紊乱,可见心肌组织间隙增宽,线粒体形态结构有不同程度的损伤,表现为体积增大,数量明显增多;与平原对照组及轻度低氧组相比,重度低氧组显示肌丝位于不同平面(横小管不在同一水平),部分肌纤维断裂重新分布,边缘模糊不整齐,心肌表面线粒体分布混乱、形态各异,出现不同程度的片状聚集和融合,形成 “巨线粒体”。
2.2 胎羊心肌胶原含量的比较
高原环境妊娠期母体缺氧时,妊娠晚期胎羊心肌出现不同程度的纤维化,Masson 染色光镜下观察,重度低氧组心肌细胞体积增大、排列明显紊乱,胶原明显增多,散在分布于心肌间质内,将心肌细胞分隔成网筛状(图2)。
与平原对照组(0.346%±0.011%)相比,轻度低氧组(2.165%±0.028%)和重度低氧组(4.612%±0.035%)的心肌胶原面积百分比明显增大,且重度低氧组高于轻度低氧组,差异有统计学意义(P<0.05)。
2.3 心肌组织MMP-8表达量的比较
Western blot结果显示,MMP-8蛋白相对表达量在轻度低氧组(5.87%±1.32%)较平原对照组(10.38%±1.1%)明显降低,重度低氧组(4.83%±0.59%)较轻度低氧组及平原对照组均明显降低,差异有统计学意义(P<0.05)(图3)。
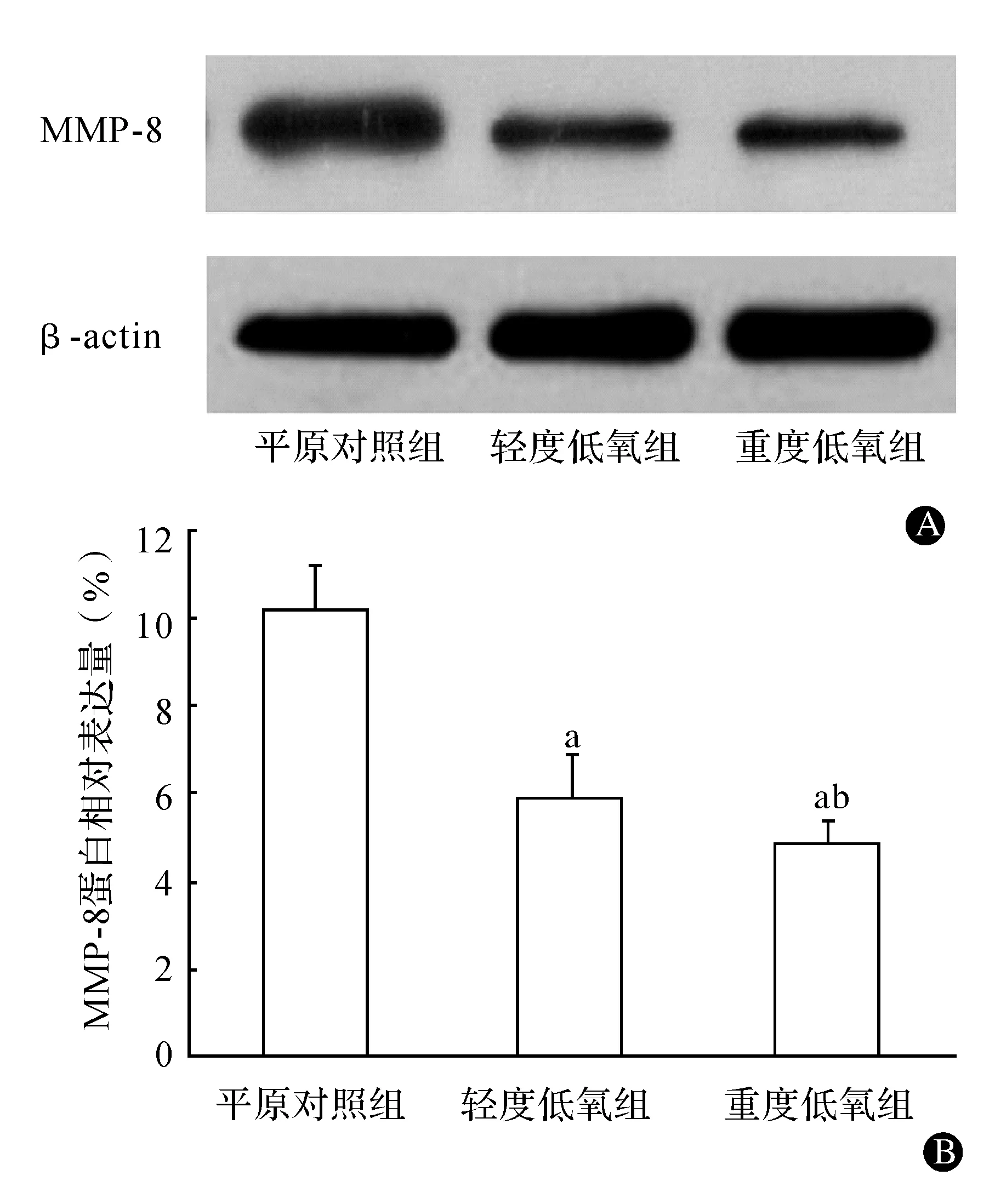
A:Western blot检测MMP-8蛋白表达;B:MMP-8蛋白的表达;与平原对照组相比,aP<0.05;与轻度低氧组相比,bP<0.05图3 各组胎羊心肌组织MMP-8蛋白相对表达情况
3 讨论
正常情况下,胎儿生活在相对缺氧的状态,而这种低氧气张力的生活环境对胎儿心血管系统的正常发育和成熟起着必不可少的作用[8]。但一旦胎儿体内氧分压低于基线,则可使胎儿各器官产生缺氧表现。缺氧是高原环境的主要特征,随着海拔每升高 100 m,人体内氧分压可伴随下降 1 mmHg 左右,当母体所处海拔高度使动脉氧分压降为 40 mmHg,胎儿氧供低于13 ml·min-1·kg-1胎儿质量(0.6 mmol·min-1·k-1)时,即可造成胎儿摄氧量下降[9]。妊娠早期,胎儿正处于细胞快速增殖阶段,对环境的异常较为敏感,因此,高原环境的妊娠对于胎儿是明显的负担。
高原环境可对胎儿心肌组织造成损伤。本研究中,轻度低氧组心肌线粒体数目明显增多、体积增大、形态结构有部分代偿性变化,而重度低氧组心肌组织肌原纤维排列紊乱、部分断裂、甚至消失,细胞内部分线粒体明显肿胀、体积增大、形态不规则、嵴断裂、呈片状聚集,形成“巨线粒体”。由此可见,不同高度的高原环境对胎儿心肌组织造成不同程度心肌损伤,心肌线粒体的结构变化直接影响并反映心肌对缺氧的耐受状态。Masson 染色显示,轻度低氧组、重度低氧组心肌内的胶原含量逐渐增多,其中重度低氧组发现心肌细胞凋亡增加、心肌间质见胶原累积、增多的胶原纤维呈筛孔状分隔心肌细胞,提示高原环境缺氧时,妊娠晚期胎儿心肌组织可发生心肌胶原网络的重构。
研究证明,高原环境中妊娠期母体缺氧会引起胎儿血液的重新分布,使胎儿心脏的耗氧量改变;缺氧引起的酸中毒会导致胎儿心脏的糖原耗竭,显著降低其心脏的能量和氧气供应[10-11]。MMPs表达量和活性正常是维持心肌结构和功能的重要因素。有研究发现,缺氧可诱导胎儿心肌组织内MMP-2和MMP-9等蛋白的表达失衡,炎性细胞因子表达上调,引发胎儿心脏组织重构,引起胎儿生长受限、发育异常[12-13]。然而,心肌组织结构的改变与MMP-8 表达的关系研究的尚少。MMP-8,也称中性粒细胞胶原酶或胶原酶Ⅱ,主要用于Ⅰ、Ⅱ、Ⅲ、Ⅳ型胶原的降解。活化的 MMP-8 可以降解基质的胶原成分,破坏胶原网的结构,使心肌细胞之间的连接趋于松散,心肌细胞排列紊乱,正常的间质支持结构消失[14-15]。本研究 Western blot结果显示,妊娠晚期与平原对照组相比,轻度低氧组和重度低氧组 MMP-8 蛋白表达量明显减少,且重度低氧组低于轻度低氧组,提示随着缺氧程度的增加,在妊娠晚期胎儿心肌组织中 MMP-8 蛋白活性逐渐降低。MMP-8蛋白含量降低能促进胶原合成,使胶原沉积的净效应增加,从而加速心肌纤维化,干扰心肌细胞的收缩功能,该结果也与心肌组织胶原增多,心肌纤维化的病理结果相一致,提示MMP-8 蛋白表达量的下调可能参与妊娠晚期胎儿心肌损伤及纤维化过程。
综上所述,不同海拔的高原环境对胎儿心肌组织造成不同程度心肌损伤,心肌线粒体的结构的变化直接影响并反映心肌对缺氧的耐受状态。MMP-8 蛋白表达量的下调可能参与妊娠晚期胎儿心肌损伤及纤维化过程。然而,高原环境下妊娠期母体的慢性缺氧对胎儿心肌造成的损伤变化是一个动态变化过程,本研究仅限于对妊娠晚期的分析和观察,尚未动态监测缺氧不同时期胎羊心肌组织中MMP-8的变化,今后有待于进一步深入研究。
利益冲突:无