β-catenin和Dkk-3在SD大鼠颊黏膜癌变过程中的表达
2018-08-31段丽君陈雨荷邱燕玲刘旭倩
段丽君,李 秀,余 丽,陈雨荷,邱燕玲,刘旭倩
(1四川省遂宁市射洪县人民医院口腔科,四川遂宁 629200;2西南医科大学附属口腔医院)
Dkk家族是近几年发现的一类编码分泌性糖蛋白的抑癌基因,人Dkk家族相关成员包括Dkk-1,Dkk-2,Dkk-3,Dkk-4以及被称为Soggy的Dkk-3相关蛋白[1]。研究表明,Dkk-3在人类多种恶性肿瘤的发生、发展中起到抑制作用[2-7]。而β-catenin是一种能与20多种蛋白结合发挥多重调节功能的蛋白,它不仅是经典的Wnt/β-catenin信号途径的核心蛋白和整条信号传导通路的关键枢纽分子[8],而且还具有介导细胞与细胞间黏附的重要功能[9]。在正常细胞膜上的β-catenin、E-钙粘素和细胞膜上的骨架蛋白结合形成复合体,介导细胞间的粘附,当β-catenin由胞膜向胞浆或胞核转移时,上述复合体减少,使细胞间的粘附作用降低而易脱落,使肿瘤呈现浸润式生长方式。本实验采用4-硝基喹啉-1-氧化物(4-introquinoline-1-oxide,4 NQO)诱发构建SD大鼠颊黏膜癌变模型,运用免疫组化法检测Dkk-3和β-catenin蛋白在大鼠颊黏膜癌变过程中的表达,以探讨Dkk-3与β-catenin蛋白在口腔黏膜癌变发生过程中的作用及相关关系。
1 材料和方法
1.1 材料
兔抗鼠Dkk-3多克隆抗体(美国R﹠D);兔抗鼠β-catenin多克隆抗体(美国Abzoom);免疫组化试剂盒SP-9000(北京中杉金桥);HE染色试剂盒(北京诺博莱特);即用型DAB显色试剂盒(北京中杉金桥)。
1.2 方法
1.2.1 组织标本
收集西南医科大学口颌面修复重建和再生实验室提供的4 NQO诱发SD大鼠口腔黏膜癌变所获颊部病损组织。其中正常颊黏膜16例,轻度上皮异常增生11例,中度上皮异常增生12例,重度上皮异常增生10例,颊癌9例。PBS代替一抗作阴性对照。
1.2.2 标本的处理
所有蜡块连续性切片,常规脱蜡至水,一部分进行HE染色作为组织诊断学用,另一部分进行免疫组织化学染色:①枸橼酸钠缓冲液加热至96℃15 min,对组织抗原进行修复,PBS冲洗3次;②3%H2O2室温下孵育10 min,PBS冲洗3次;③切片分别滴加一抗 Dkk-3(1∶100)和β-catenin(1∶100),37 ℃湿盒内孵育1.5 h,PBS冲洗3次;④每张切片滴加1滴生物素标记的二抗(工作浓度),37℃下孵育20 min,PBS冲洗3次;⑤滴加链霉菌抗生物素-过氧化酶溶液,37℃孵育30 min,PBS冲洗3次;⑥DAB显色5 min左右,水洗以终止显色反应;⑦苏木素复染;酒精梯度上行脱水;二甲苯透明;中性树胶封片。
1.2.3 结果判定与统计
Dkk-3的表达以正常上皮细胞的胞浆和胞核中出现棕黄色颗粒为阳性。光镜下,每例样本随机选择10个高倍视野,Motic Medical数码医学图像分析系统进行分析,取平均值,排除非特异性染色和边缘效应,着色强度记分标准:无染色=0分;轻度染色=1分;中等染色=2分;重度染色=3分。阳性率(阳性率是指每例样本Dkk-3表达的染色强度得分和阳性细胞数得分的乘积≥6的样本数占每组总样本数的百分率)评分标准:阳性细胞数<10%(0分);11%~25%(1分);26%~49%(2分);≥50%(3分)。染色强度与阳性率乘积为Dkk-3最后得分≥6分为阳性;<6分判定为阴性。β-catenin以正常上皮细胞的胞膜上出现黄色或棕黄色的染色为阳性,如≥70%胞膜阳性表达者称为正常表达,反之为表达减弱或缺失;≥10%胞浆或胞核阳性表达者称为异位表达;胞膜表达减弱或缺失和异位表达统称为异常表达。
1.2.4 统计学分析
用SPSS 20.0软件进行统计分析,计数资料采用χ2检验,在χ2检验有统计学意义的前提下再进行两者的Pearson相关性分析,P<0.05有统计学意义。
2 结 果
2.1 病理资料分析
对所选蜡块进行常规HE染色,由三位病理科医生复片,对58例标本进行分组:正常颊黏膜16例;轻度上皮异常增生11例;中度上皮异常增生12例;重度上皮异常增生10例;鳞状细胞癌9例,见图1。
2.2 β-catenin蛋白在SD大鼠颊黏膜癌变过程中的表达
正常组棘层以上细胞膜β-catenin阳性表达,呈棕黄色颗粒,基底层着色不明显;轻度上皮异常增生组棘层以上细胞膜阳性表达减少,部分胞质中呈浅黄色弱阳性表达;中度上皮异常增生组中多数棘层以上细胞胞浆中出现黄色颗粒;重度上皮异常增生组中细胞层次紊乱,胞浆阳性表达开始减少但颜色变为棕黄色,大量胞核呈阳性;鳞癌组大量胞核阳性表达,见图2。

图1 大鼠正常黏膜(HE染色,×200)

图2 β-catenin蛋白在大鼠颊黏膜的表达(Polymer,×200)
在SD大鼠颊黏膜由正常至癌变过程中β-catenin异常表达的差异具有统计学意义(χ2=22.493,P<0.05)(表1)。β-catenin的异常表达与病理分级程度成正相关关系(rs=0.386,P<0.05),即认为从正常到癌变β-catenin异常表达水平逐步增加,差异具有统计学意义(P<0.05),见表2。
2.3 Dkk-3蛋白在SD大鼠颊黏膜癌变过程中的表达
正常组上皮基底层和棘细胞胞浆呈阳性表达,广泛的棕黄色颗粒,近表层细胞的胞核中出现少量黄色颗粒;轻度上皮异常增生组上皮基底层和棘细胞的胞浆阳性表达减少,但胞核中棕黄色颗粒增加;中度上皮异常增生组上皮的胞浆阳性表达明显降低,仅部分细胞胞浆有浅黄色颗粒,棘层以上的细胞胞核为阳性表达,着色细胞数明显减少,基底层几乎无着色;重度上皮异常增生组上皮仅见极少数细胞胞核浅黄色颗粒;鳞癌组上皮细胞Dkk-3阴性表达,见图3。
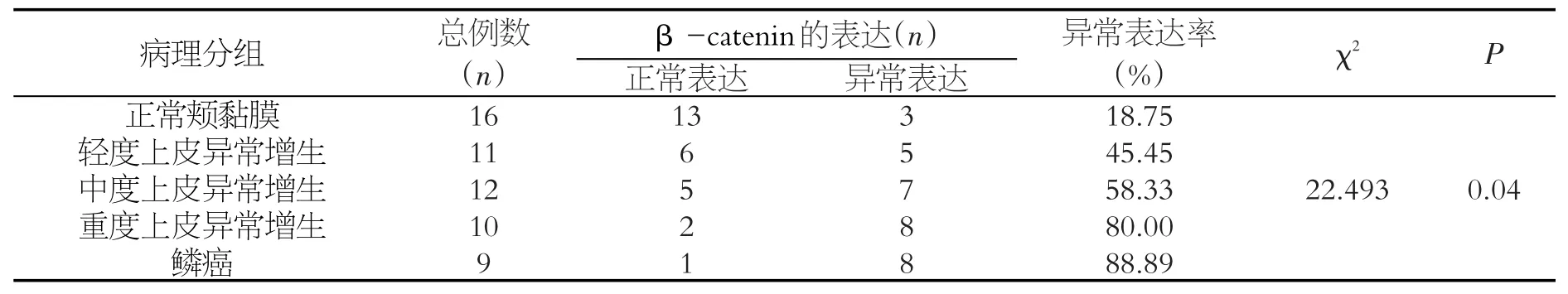
表1 β-catenin在SD大鼠正常颊黏膜至癌变各阶段组织中的异常表达比较

表2 β-catenin异常表达差异与颊黏膜病理分级的相关性分析

图3 Dkk-3在大鼠颊黏膜中表达(Polymer,×200)
由表3可见,在SD大鼠颊黏膜由正常至癌变这一动态变化过程中Dkk-3阳性表达的差异具有统计学意义(χ2=16.113,P<0.05)。Dkk-3的阳性表达随着病理分级程度呈负相关关系(rs=-0.521,P<0.05),即认为从正常到癌变Dkk-3的阳性表达水平逐步降低,差异具有统计学意义(P<0.05),见表4。

表3 Dkk-3在SD大鼠正常颊黏膜至癌变各阶段组织中的表达比较

表4 Dkk-3阳性表达差异与颊黏膜病理分级的相关性分析
3 讨 论
Wnt/β-catenin信号转导通路是最经典的信号通路之一[10],当这条通路被异常激活时,可导致β-catenin在胞浆中大量聚集,激活下游的c-ymc、cyclin1等原癌基因,进而导致肿瘤的发生[11]。β-catenin作为Wnt/β-catenin信号通路关键细胞因子最早是被当做粘附因子而发现的,研究表明它还是一种胞内可溶性的多功能蛋白,在细胞内以两种形式存在:①结合型:主要位于细胞-细胞链接侧的细胞膜上,β-catenin和E-cadherin、细胞骨架蛋白结合形成复合体,介导细胞之间的粘附,维持正常上皮细胞的极性和完整性;②游离型:主要位于胞浆中,正常情况下它与APC、GSK-3β和Axin形成的“破坏复合物”结合后,被泛素化并由蛋白水解酶降解,从而胞浆始终维持在一个几乎被检测不到的水平,但是如果这个复合物被破坏后,就可导致β-catenin失磷酸化,在胞浆中大量聚集,进而进入胞核启动下游的原癌基因,介导细胞增殖和分化。β-catenin以上两种存在形式表明,其表达异常不仅可降低细胞间的粘附性,还受Wnt/β-catenin信号通路的开关闭状态影响,它对肿瘤的发生发展起着双重推进作用。研究证实,β-catenin在胞浆和胞核中表达量的增加与肿瘤的增殖、分化和转移密切相关[12]。本实验显示,β-catenin异常表达与SD大鼠的颊黏膜病理恶性程度呈负相关关系,在颊黏膜癌变过程中β-catenin的异常表达数的差异在总体上是具有统计学意义的(P<0.05),可能与β-catenin由胞浆向胞核转移后启动了细胞核内的癌基因有关;因β-catenin随着病理分化程度的降低在细胞膜上的表达量也降低,使细胞之间的粘附性降低,导致细胞更易脱落和侵袭下层组织。这些结果与学者顾晓荔等[13]对β-catenin在宫颈鳞癌中的表达研究相一致,同时与胡冬玉等[14]研究的β-catenin在皮肤鳞癌及癌前病变中的表达变化相吻合,提示β-catenin可能在SD大鼠口腔颊黏膜癌变过程中起促进作用。
Dkk-3是近几年发现的一类编码分泌性糖蛋白的抑癌基因,定位于人类经常缺失的染色体11p5.1的位点上,研究发现Dkk-3与人类多种恶性肿瘤的发生发展、侵袭和转移密切相关[15-18]。本实验对Dkk-3在SD大鼠颊粘膜癌变过程中的表达变化进行探讨,结果显示Dkk-3在大鼠正常颊黏膜高表达,表达部位与童辉等[19]对Dkk-3蛋白在乳腺癌中表达研究结果相似。本实验中Dkk-3的阳性表达率随着颊黏膜病理分化程度的降低而降低,在重度上皮异常增生组中Dkk-3阳性表达率仅为20﹪,表达部位与牛云霞等[20]对Dkk-3在直肠癌组织中的免疫组化染色结果相同。Dkk-3在鳞癌组表达缺失,正常组和上皮异常增生组相比,它们之间的差异在总体上是具有明显的统计学意义。关于Dkk-3在正常组织和肿瘤组织中表达部位的不同,目前鲜有报道,本研究推测是因为在正常组织中Dkk-3的阳性表达量本身就很高,使绝大多数Dkk-3主要聚集在胞质中,易于从胞质中游离出来和胞膜表面的Wnt辅助性受体LRP5/6结合,抑制Wnt受体复合物形成;随着病理分化程度的降低,Dkk-3表达的部位主要出现在胞核中,但是阳性表达率是显著降低的,两者间的相关性分析显示Dkk-3阳性表达的差异与颊黏膜病理恶性程度呈负相关关系。Dkk-3在大鼠颊黏膜癌变过程中表达量的变化与国内外学者在肿瘤方面的研究结果基本一致。本实验也证实了Dkk-3作为抑癌基因在肿瘤的发生发展中起抑制作用,其表达量和病理分化程度成正相关关系。以上数据提示,Dkk-3在异常增生组织和癌组织中的表达并不是完全缺失,仍然有Dkk-3阳性表达的组织会发生癌变。
本实验同时分析了Dkk-3和β-catenin在SD大鼠颊黏膜癌变过程中表达变化的相关关系,结果显示,Dkk-3和β-catenin在大鼠颊粘膜癌变过程中呈负性相关关系。同时证明了Dkk-3对Wnt/β-catenin信号转导通路具有抑制作用,Dkk-3与细胞膜上的辅助性受体LRP5/6相结合,阻止Wnt蛋白和受体Frizzled及辅助性受体LRP5/6结合形成受体复合物,使得胞质内Dsh蛋白不能被活化,未活化的Dsh蛋白不能抑制糖原合成酶激酶3β(GSK3β)的活性,从而使轴蛋白(Axin)、结肠腺瘤样息肉(APC)蛋白和β-catenin等不能形成降解复合体,胞质内的酪蛋白激酶1(CK1)和GSK3β就不能对β-catenin进行磷酸化[21-22]。未被GSK3β磷酸化的β-catenin同时也避免了被泛素连接酶E3亚基β-转导素重复蛋白(β-TrCP)的识别和被26S蛋白酶体降解,从而在胞质中逐渐积聚,当积聚到一定阈浓度后开始向胞核转移,并与胞核内的转录因子Tcf/Lef相结合,招募共同转录起始因子激活一系列的下游靶基因,如c-myc、cyclin1、survivin等而导致细胞异常增殖和分化。正常细胞中的Dkk-3与LRP5/6结合,关闭经典的Wnt/β-catenin信号通路[23],使得胞质中游离的β-catenin维持在较低的水平。同时,在正常细胞胞膜上的β-catenin大部分与胞膜粘附蛋白E-cat等结合形成复合体参与细胞骨架的调节,调节细胞之间的粘附,防止细胞脱落[24]。
4 结 论
Dkk-3能通过抑制Wnt/β-catenin信号通路来调节β-catenin在胞质内的表达水平,使β-catenin的异常表达量始终处于较低水平,防止下游靶基因的转录从而降低细胞增殖、分化,通过降低细胞脱落率降低肿瘤的转移和侵袭能力。
