与双膦酸盐类药物相关的非典型股骨骨折的研究进展
2018-08-30辛思旭柴三葆孙健斌袁宁刘玉芳南敏张晓梅
辛思旭 柴三葆 孙健斌 袁宁 刘玉芳 南敏 张晓梅
北京大学国际医院代谢内分泌科,北京 102206
双膦酸盐类药物(bisphosphonates,BPs)是治疗骨质疏松症的一线用药[1],其作用机制是通过抑制破骨细胞功能,诱导破骨细胞凋亡,减少骨吸收,从而提高骨密度,降低骨折发生率。它们的使用大大降低了椎体及非椎体骨折的发生率。然而,长期应用BPs并不是没有风险。在过去十年,美国食品药品监督管理局(US Food and Drug Administration,FDA) 发布安全警告:BPs可能导致下颌骨坏死、心房颤动、非典型股骨骨折(atypical femoral fracture,AFF)等。2011年4月,中国国家食品药品监督管理局(State Food and Drug Administration,SFDA)发布《药品不良反应信息通报》,提醒临床医生在使用BPs时需密切关注其严重不良反应。目前,世界各地均有关于长期应用低剂量BPs致非典型股骨骨折的报道[2],越来越多的证据揭示了BPs与非典型股骨骨折的关系[3-7]。
1 AFF的定义
AFF特指发生在股骨小转子至股骨干近端1/3区域内、由低能量创伤引起的股骨转子下骨折或股骨干骨折[8]。
2013年,美国骨与矿物质研究学会(American Society for Bone and Mineral Research,ASBMR)在原有版本[9]]基础上更新了AFF的诊断标准[10]。首先,确诊需满足:骨折位于股骨干股骨小转子至股骨髁上间。还需满足:①无外力或轻微外力下骨折,站立位或更低位摔倒;②横形或短斜形骨折;③轻微粉碎或非粉碎性骨折;④伴有内侧尖锐突起的完全骨折或仅限于外侧皮质的不完全骨折;⑤骨折部位的外侧皮质增厚,伴骨膜反应(图1、2、3)[11]。以上5项标准至少满足4项。
次要标准包括:①股骨干皮质广泛增厚;②单侧或双侧的前驱症状;③双侧骨皮质受累;④骨折延迟愈合。
2 AFF的流行病学特征
2005年,Odvina[12]首次报导了与双膦酸盐类药物相关的非典型股骨骨折,他发现长期口服阿仑膦酸钠的患者在无明显外伤诱因下出现自发性非椎体骨折,且术后骨折延迟愈合甚至不愈合。2011年瑞典大规模临床流行病学调查数据显示[13],人群中应用双膦酸盐类药物致非典型股骨骨折的发生率约为5/10 000。越来越多的研究[14-15]显示双膦酸盐类药物致非典型股骨骨折的发生率为3~50/(100 000人.年)。其通常发生在用药5年后,平均为7.3年[16]。骨折后12个月、24个月的致死率分别为14%、25%[17]。
Gedmintas等[18]的荟萃分析显示,双膦酸盐与非典型股骨骨折相关,其校正RR值为1.70 (95%CI1.22~2.37),亚组分析显示AFF发病风险更高(RR 11.78;95%CI0.39~359.69)。对用药超过 5年的患者进行亚组分析,校正RR值为1.62 (95%CI1.29~2.04)。陆永江等[19]的荟萃分析同样显示,BPs明显增加AFF的发生风险,尤其是应用BPs超过5年的患者。
3 AFF的诱因及危险因素
因骨质疏松症患者体内骨转化和骨代谢异常,骨质疏松症本身是AFF的一项重要危险因素[20]。研究还发现,AFF更多见于女性,与其他人种相比,亚裔和西班牙裔人种也被认为是AFF的一项危险因素[14,21-23](见表1)。
2017年Koh等[24]回顾性分析了35 104例应用BPs超过1年的患者,其中43例女性诊断为AFF (0.12%)。该研究显示,体重指数每增加1 kg/m2、长期应用糖皮质激素、长期应用BPs且无药物假期使AFF发病风险分别增加1.2、3.0、5.2倍。

表1 关于AFF危险因素(年龄、性别、种族)的主要临床研究Table 1 The main clinical studies of risk factors for AFF(Age, Sex, Race)
成人低磷酸酯酶症是以血清中组织非特异性碱性磷酸酶降低为特征的罕见遗传性全身系统疾病。碱性磷酸酶活性降低使5′-磷酸吡哆醛、无机焦磷酸盐在体内堆积,无机焦磷酸盐与双膦酸盐的化学结构相似,也能抑制骨矿化。Sutton 等[25-26]提出了一个有趣的假说,他们认为成人低磷酸酯酶症可能是AFF的一项危险因素。然而,在Bhattacharyya等[27]对AFF患者的研究中,并没有发现低磷酸酯酶症的实验室或基因学证据。因此,AFF的生物学危险因素有待进一步研究。
4 AFF的发病机制及病理生理学特征
双膦酸盐类药物致非典型股骨骨折的病因并不完全被我们所知[28-31]。它可能通过抑制破骨细胞凋亡,阻碍骨骼信号传导,间接抑制成骨细胞活动,从而抑制骨质沉积和骨骼生理重塑[32]。研究发现[33],BPs对骨折断端骨痂连接的影像学和生物力学强度并无影响,但会延迟硬骨痂重建期,干扰板层骨的正常改建和塑形。此外,局部高剂量应用BPs除了影响骨吸收,还可能通过抑制甲羟戊酸合成而抑制骨形成、通过抑制血管内皮细胞增殖及肿瘤血管形成因子分泌等途径使骨修复过程中血管生成和骨形成减少,骨脆性增加,最终导致AFF的发生[34-35]。
AFF独特的病理生理学特征是前驱疼痛、双侧骨皮质受累、骨皮质增厚、骨折延迟愈合[36]。
5 AFF的临床表现
大多数AFF发生于轻微外伤或站立时跌倒甚至更轻微的情况下。但有些患者的病史或临床表现具有特殊性,常表现为骨折前数月于受累部位出现前趋疼痛。Lo等[22]对38例女性AFF患者的研究显示,几乎有1/3出现了前驱疼痛。Giusti等[37]发现,141例女性AFF患者中,近64%出现前驱疼痛,患者也可能出现对侧肢体疼痛甚至双边骨折。Capeci等[3]分析研究了65例接受髓内钉固定的AFF患者,7例长期使用BPs的患者出现了低动力性双侧股骨粗隆下或股骨干骨折。其中1例表现为同时出现的双边骨折,2例分别于初次损伤后第12、第18个月发生了二次骨折,4例在初次骨折时即出现了应力反应或临近骨折的征象。Lo等[22]发现39.5%的AFF患者发生对侧应力性骨折或完全性骨折,只有2.4%的患者出现典型股骨骨折。
6 AFF的影像学特征
在骨折形成或移位前的早期阶段,股骨粗隆下或股骨干区域可能出现典型的皮质应力反应,表现为外侧皮质“鸟嘴”样改变和皮质增厚。一些患者具有前驱疼痛和代表着无移位骨折的“可怕的黑线”[5,22,38-41]。Kwek等[42]对17例长期应用阿仑膦酸钠致AFF的患者进行系列研究,并归纳总结了其影像学特征:①转子下区一侧出现皮质增厚;②低能量性、横行骨折;③内侧皮质尖峰征。Neviaser等[5]也对AFF的影像学特征进行了总结:X线检查在早期主要表现为不完全骨折或仅为局部骨皮质增厚、隆起。不完全骨折的骨折线位于外侧骨皮质,多为横形,一般不累及内侧皮质。随着应力的增加可发展为完全性骨折,X线检查可见股骨转子下或股骨干简单的横形或斜形骨折线(图4)[43],外侧皮质断端增厚、硬化,局部可见“鸟嘴”样改变,内侧皮质可见尖锐突起。此类骨折多在双侧同时出现,且愈合时间长,易出现骨不连[44-45]。当X线检查不能确诊时,磁共振成像和放射性核素骨扫描可助诊断。
7 AFF的治疗
7.1 非手术治疗
双膦酸盐是一把“双刃剑”,它既是治疗骨质疏松症的有效药物,又是导致AFF的危险因素。2012年,FDA就长期应用BPs的安全性及有效性问题进行了系统性回顾分析[46],虽然未明确推荐BPs的使用时间,但建议所有应用BPs的患者需定期评估以决定下一步治疗方案。对已使用BPs超过5年的患者,应定期评估是否需要继续使用BPs治疗;如出现股骨干骨折,应立即停止使用骨吸收抑制剂。
应力性骨折、不完全性骨折、完全性骨折一经诊断,应立即终止损伤途径[9]。停止抗骨吸收药物可以减少AFF的发生率。Dell等[14]研究表明,在初次骨折后连续应用BPs 3年的患者中,对侧股骨骨折的发生率为53.9%,而在骨折后立即停止使用BPs的患者中,其发生率只有19.3%。
同时推荐患者补充钙剂和维生素D。对于高危患者(如继发于骨质疏松症的二次骨折或应用BPs致骨转换过度抑制),建议启动重组甲状旁腺素-特立帕肽治疗。特立帕肽已被证实在骨折愈合过程中能增加骨痂形成和骨强度[47-52]。ASBMR也建议给予保守治疗无效的骨折患者启用特立帕肽治疗。
药物治疗与辅助设备保护下负重治疗可以改善疼痛、加快愈合。虽然不完全性骨折和轻度疼痛患者可以尝试这种方案,但非手术治疗的失败率很高[45,53-54]。局部负重和药物干预的非手术治疗虽然在某些病例取得成功,但必须进行严密监控以预防骨折进展。
7.2 手术治疗
目前大多数学者认为,与长期应用双膦酸盐相关的非典型股骨骨折有别于骨质疏松性骨折及单纯外伤性骨折,如果不积极行外科干预,保守治疗很难愈合。手术治疗还可以预防继发性骨折、移位以及缓解疼痛。Egol等[54]研究了31例43侧不完全AFF患者,手术组在康复、疼痛和残疾评分方面都更具有优势。手术组影像学治愈率为100%,非手术组为18%。手术组疼痛缓解率为81%,非手术组为64%。手术组简明骨骼肌功能评定为19.7,非手术组评分为25.7。
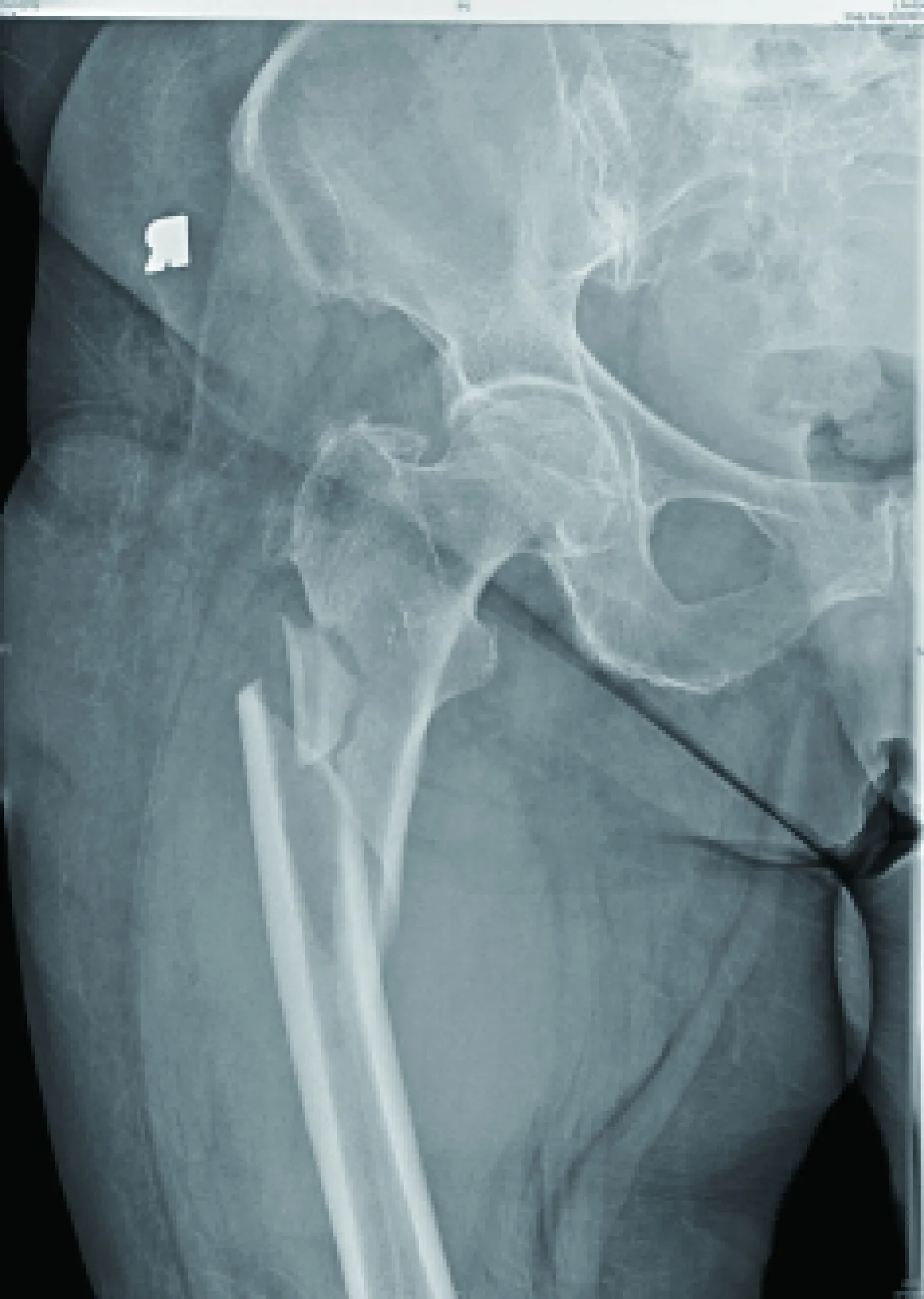
图1 典型高能量性转子下股骨粉碎性骨折[13]Fig.1 Typical high energy subtrochanteric femur fracture with comminution
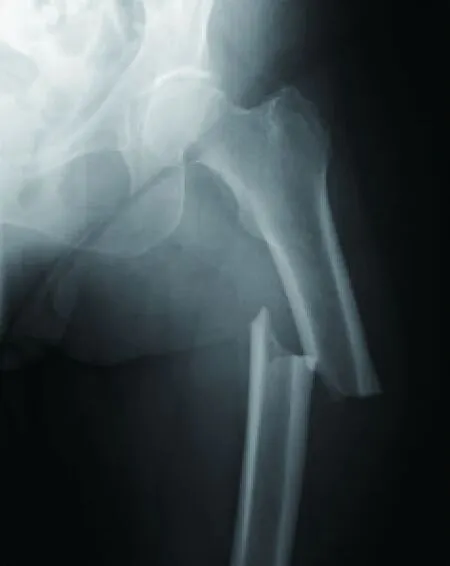
图2 完全性非典型股骨骨折[13]Fig.2 Complete atypical femur fracture
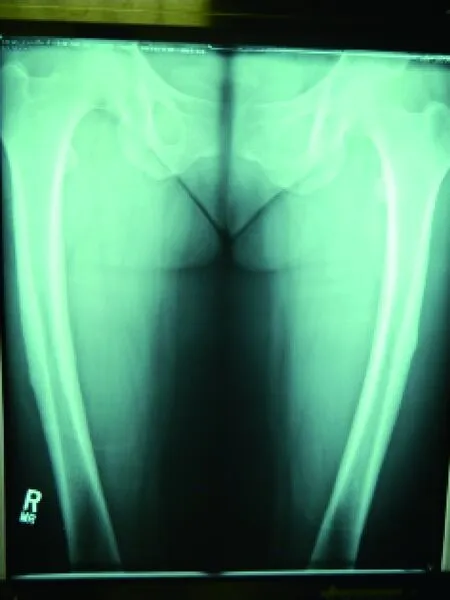
图3 不完全性双边非典型股骨骨折[13]Fig.3 Bilateral incomplete atypical femur fractures
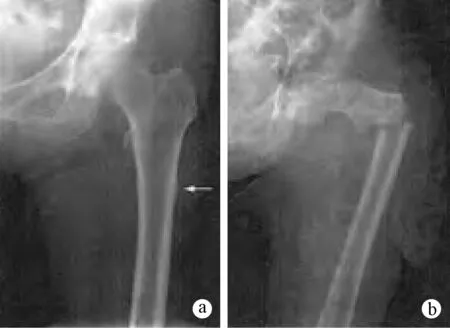
图4 股骨不典型骨折的典型影像[45]a.股骨干外侧皮质增厚(箭头所指);b.典型的股骨转子下骨折,骨折线呈短斜形Fig.4 Typical image of atypical femur fracturea. The lateral cortex of diaphyseal thickening (in the direction of arrow); b. Typical subtrochanteric femoral fracture, which is short oblique fracture
手术治疗适用于所有完全性骨折或部分非完全性骨折患者。潜在技术包括金属板固定或髓内钉固定(IM nailing,IMN)。有报道指出[53,55],与发生骨折后再进行治疗相比,预防性内固定治疗可以减少住院天数。若双膦酸盐休药期后1~2个月影像学特征持续存在且具有前驱疼痛,强烈建议进行预防性IMN[56]。对于完全性骨折的患者来说,IMN是标准方案。固定疗法不可否认是一把双刃剑。Weil等[56]对接受IMN的15例患者17侧骨折进行研究发现,7例(46%)患者尽管最后都成功愈合了,但他们或因动力交锁、更换髓内钉、校正接骨板而需要二次手术。Egol等[54]的研究表明,虽然有98%的患者获得影像学愈合,但只有64%的患者其功能恢复至基线水平。
8 结论
与长期应用双膦酸盐类药物相关的非典型股骨骨折尽管罕见,却越来越受到临床医生的关注。医务人员应该能够认识到临近骨折的症状和体征以及完全性骨折的特点以充分决策治疗方案。要想获得成功,必须同时采用手术和药物干预等多学科治疗方法。尽管有大量回顾性文献可供参考,目前仍缺乏前瞻性研究来比较不同药物的疗效以及手术治疗与药物治疗的不同。我们必须在这方面做更多的研究来创建一套可靠而具有循证医学证据的诊治规范。
