北京南郊地区成年人桡骨远端骨密度及FRAX骨折风险评分与BMI的相关分析和探索研究
2018-08-30栗敏郭勇
栗敏 郭勇
北京市大兴区中西医结合医院,北京 100076
骨质疏松(osteoporosis,OP)为骨量降低、骨组织微结构损伤从而导致骨强度下降、骨脆性增加、骨折风险性增高的一种全身性骨骼系统疾病[1-2]。OP的发生率随年龄的增长而增高。随着我国老龄化的日益加剧,OP导致的骨质疏松性骨折已成为威胁我国中老年人群身心健康和经济负担的重要疾病。1994 年起WHO 颁布提倡利用双能X 线骨密度检测仪计算骨内骨矿物质含量及测算骨密度(bone mineral density,BMD) 用于诊断骨质疏松症,2008 年WHO 又推荐利用骨折危险性评估工具(fracture risk assessment tool,FRAX) 评估10 年内骨质疏松性骨折发生的风险概率(probability of a major osteoporotic fracture,PMOF),本研究通过分析比较北京南郊地区不同性别、不同年龄、不同身体质量指数(body mass index,BMI)人群非优势手臂桡骨远端骨密度及骨折风险预测工具FRAX计算出的全身骨折风险间的差异,探讨BMD、PMOF与年龄和骨密度间的关系及变化趋势。
1 资料与方法
1.1 对象
回顾性分析2015年1 月至2017 年6 月期间在我院接受双能X 线骨密度检测(DEXA) 的体检人群作为研究对象,共计2 680名。其中男性944名,平均年龄(57±10)岁(40~89岁),女性1 736名,平均年龄(57±10)岁(40~87岁)。搜集的研究资料包括身高、体重、既往骨折史、吸烟饮酒史、激素使用史、父母骨折史等,以用于进行FRAX软件分析。
1.2 方法
1.2.1骨密度测定: 采用美国Osteometer Med Tech 公司生产的DTX-200型双能X线骨密度仪进行骨密度检测,测量部位为非优势手臂桡骨远端1/3处(手臂自然伸直状态,相当于自中指末端至尺骨鹰嘴连线的中点)进行测量,管电流设置为5mA,测量并记录相应BMD 值,每次开机测量前,均对设备进行事先预热、校准,系统测量误差小于0.3%。
1.2.2FRAX 软件分析: 登陆http://www. Shef.ac.uk /FRAX/网站,在“国家”选项中选择“中国”,根据界面提示依次输入年龄、性别、体重、身高、既往骨折史、父母骨折史、目前抽烟行为、肾上腺皮质激素服用、风湿性关节炎、继发性骨质疏松症、每日酒精摄取量达3 个单位或以上、桡骨远端骨密度等12 项受检者信息,得到FRAX骨折风险评分即10 年内发生全身骨质疏松性骨折的概率(probability of a major osteoporotic fracture,PMOF)[3]。
1.3 观察指标及研究方法
根据年龄将不同性别的研究对象划分为40~49 岁、50~ 59岁、60~ 69 岁、70~80岁共4 组。将不同性别的研究对象按中国标准BMI (kg/m2) 分为正常体重18.5~23.9, 超重24.0~27.9, 肥胖≥28.0共3组,分别观察。观察分析桡骨远端骨密度及PMOF等指标在不同性别、不同年龄组间的差异和变化趋势及在不同性别及不同BMI组间的差异和变化趋势。
1.4 统计学方法

2 结果
2.1 按性别、BMI分组,桡骨远端BMD与FRAX骨折评分指标在各组之间的差异(表1、表2)
北京南郊地区不同性别成年人的非优势手臂桡骨远端BMD随BMI 的升高呈逐渐升高的趋势,有显著相关性,差异有统计学意义(P<0.05),且不同BMI组中男性BMD值均高于女性,差异有统计学意义(P<0.05)。FRAX骨折风险评分在各BMI组中男性均低于女性,差异有统计学意义(P<0.05);不论性别,PMOF在BMI为24~27.9(超重组)组达高峰,低于或高于此BMI值均有所下降,且正常体重组FRAX评分低于肥胖组(P<0.05),男性PMOF与BMI无明显相关性。

表1 北京南郊地区人群桡骨远端骨密度及FRAX分析按性别、BMI分组后的结果Table 1 Analysis results of FRAX fracture risk score and bone mineral density of the non-dominant arm in residents of Beijing southern suburbs according to gender and BMI groups

表2 北京南郊地区不同性别成年人桡骨远端骨密度及FRAX分析结果按BMI分组LSD法两两比较Table 2 LSD two-by-two comparisons of FRAX fracture risk score and bone mineral density of the non-dominant arm in male and female residents of Beijing southern suburbs by BMI groups
2.2 按性别、年龄分组,桡骨远端BMD与FRAX骨折评分指标在各组之间的差异(表3、表4)
北京南郊地区不同性别成年人的非优势手臂桡骨远端BMD随年龄增高而降低,差异有统计学意义(P< 0. 05),且不同年龄组中男性BMD值均高于女性,差异有统计学意义(P< 0. 05)。PMOF随年龄的增高呈逐渐增高趋势,且差异有统计学意义(P< 0. 05),不同年龄组男性PMOF均低于女性,差异有统计学意义(P< 0. 05)。FRAX骨折风险评分与BMD整体呈负相关。

表3 北京南郊地区人群中按性别、年龄分组后桡骨远端骨密度及FRAX分析结果Table 3 Analysis results of FRAX fracture risk score and bone mineral density of the non-dominant arm in residents of Beijing southern suburbs according to gender and age groups
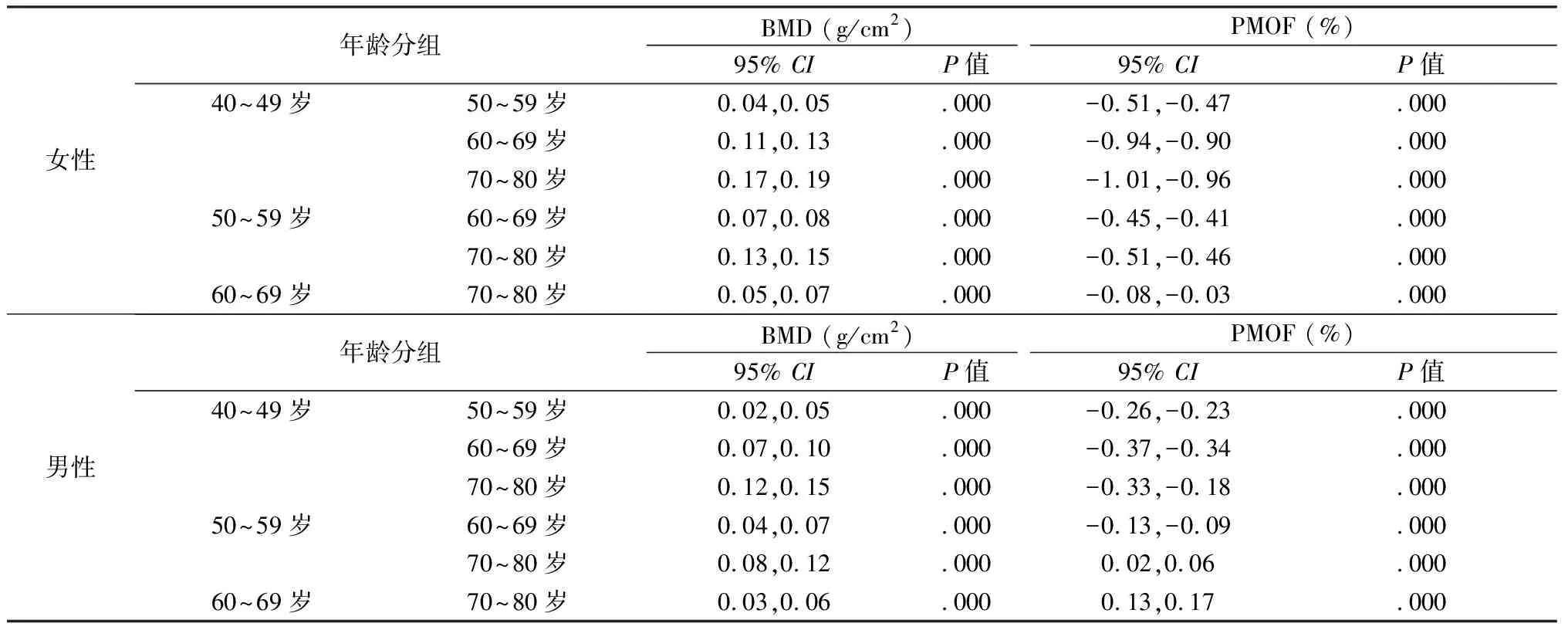
表4 北京南郊地区不同性别成年人桡骨远端骨密度及FRAX分析结果按年龄分组后LSD法两两比较Table 4 LSD two-by-two comparisons of FRAX fracture risk score and bone mineral density of the non-dominant arm in male and female residents of Beijing southern suburbs by age groups
3 讨论
骨质疏松症及其导致的骨质疏松性骨折(osteoporotic fracture,OF)已逐步成为世界范围内严重影响中老年人群身心健康的重要问题,据报道目前我国 40 岁以上的骨质疏松症患者已有1.12 亿[3-4],OP与年龄、性别、身高/体重比、饮酒等多种因素有关,1994 年起WHO 颁布提倡利用双能X 线骨密度检测仪测算骨密度的方法用于诊断骨质疏松症,之后Schuit等[5-6]用 6 年多时间通过对5 794 例患者股骨颈骨密度的监测随访后,认为仅依靠BMD值作为评价骨质疏松性骨折的风险将造成一半以上患者漏诊。2008 年WHO再次推出FRAX骨折危险性评估工具软件,定义了种族、 年龄、 性别以及其他7 种风险因子作为可疑骨质疏松患者的骨折风险因子,用于评估未来10年内发生骨质疏松性骨折的风险概率。本研究通过纳入北京南郊地区40~80岁年龄段体检人群2 680名,收集记录相关临床指标,分别在性别、年龄及BMI三方面研究了非优势手臂桡骨远端BMD及PMOF在各组间的差异及变化趋势。
3.1 非优势手臂桡骨远端BMD、PMOF同性别、年龄的变化趋势
本研究发现,不论受检者的年龄及BMI的不同,男性的非优势手臂桡骨远端BMD值始终大于女性,且PMOF女性始终大于男性,即未来10年内发生全身主要骨折的概率女性大于男性,此差异在女性50岁以后更加明显;不论男性、女性,非优势手臂桡骨远端BMD随年龄的增长而降低,PMOF随年龄的正常而增高,即年龄越大,骨密度越低,骨折风险越大,说明年龄、性别是影响骨量、骨密度、骨折风险的必然因素,增龄、女性绝经导致骨密度减低,骨折风险增高[7,8],年龄是引起骨质退化、骨质疏松的必然因素。研究发现不论性别,随年龄的增长,骨量逐渐减少,骨密度逐渐减低,骨折风险概率逐步提高,女性骨量减少、骨密度减低及骨折风险概率提高的幅度均大于男性。在50岁以后各年龄组更加明显,与女性绝经后雌激素水平减低,对成骨细胞的刺激减弱,成骨细胞活动减低有关,进而骨量减少,骨密度减低,与之前国内外的研究结果相符[3,9-10],即OF 的发病率在 50 岁以后随年龄的增加而呈指数比例增长。
3.2 非优势手臂桡骨远端BMD、PMOF与BMI的关系及相关性分析
本研究发现,非优势手臂桡骨远端BMD随BMI的增高而增高,与BMI呈正相关,BMI (kg/m2)是反映肥胖程度的一个指标,对骨有保护作用,其机制可能是由于脂肪组织可促使雄激素芳香转化为雌激素[11-12],从而使肥胖者将外周脂肪组织中的睾酮转化为雌二醇,雄烯二酮转化为雌酮,雌二醇和雌酮可刺激成骨细胞分泌胰岛素样生长因子-1 (IGF-1),IGF-1可刺激成骨细胞活性,从而促进骨形成,骨密度增加。此外,肥胖时骨所承受的机械负荷增加,促进骨形成,减少骨吸收,从而降低了骨量的减少[13]。有研究发现[14-15]低 BMI 通常导致骨折风险升高,而高 BMI 能降低骨折风险,提示 BMI 是骨折风险预测的独立危险因素。
PMOF不会因BMI的增高而降低,而表现为随BMI的增长呈近似“抛物线”状,即在超重组人群中骨折风险评分达高峰,正常体重人群骨折风险最低,肥胖人群骨折风险评分较超重人群有所降低。对于肥胖和超重人群,虽然脂肪组织可刺激雌激素增多而使骨密度增高,但FRAX骨折风险评分并不完全随骨密度的增高而降低,肥胖人群骨折风险低于超重人群可能与骨密度相对增高、运动减少等因素有关,因此对于超重及肥胖人群不能将BMD单独作为评价骨质疏松的指标。
3.3 PMOF与非优势手臂桡骨远端BMD的相关性分析
本研究结果显示,临床中要综合考虑年龄及骨密度等因素来评估骨质疏松性骨折的发生。对FRAX与BMD 的相关性分析中显示,不同性别之间,PMOF与非优势手臂桡骨远端BMD整体表现为显著负相关,即 FRAX预测个体的PMOF越高时,提示其BMD越低,而BMD越高时,FRAX骨折风险评分越低,间接表明FRAX骨折风险评估系统可以优先地筛选出骨密度减低的高危人群,从而有效的评估骨折风险,有国外研究表明,在不代入 BMD的情况下全身主要部位骨折风险与骨密度之间存在着一定的相关性[16],与本研究结果相符。
综上所述,桡骨远端BMD及PMOF与受检者性别、年龄、BMI均相关,其中在同等年龄及BMI情况下,女性的骨折风险均高于男性;随年龄增长,骨密度降低,骨折风险增加;随BMI的增高,BMD逐渐增高,但此时骨折风险不随BMD的增高而降低,而表现为超重人群骨折风险最高,正常体重人群骨折风险最低,故超重亦是使骨折风险增加的危险因素。通过利用FRAX软件,测量桡骨远端骨密度的高低并充分考虑性别、年龄、BMI等因素可有效评估患者的骨折风险。桡骨远端骨密度可作为评价骨质疏松的重要指标之一。
