猪伪狂犬病排毒情况与gE、gB抗体之间的关系研究
2018-08-29梁鹏帅张乐宜刘燕玲宋长绪
李 段,王 磊,梁鹏帅,张乐宜,刘燕玲,徐 峥,宋长绪
(华南农业大学动物科学学院/国家生猪种业工程技术研究中心,广东 广州 510642)
猪伪狂犬病是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种高度接触性传染病。作为危害全球养猪业最严重的猪传染病之一,猪伪狂犬病引起的主要症状有种猪繁殖障碍,仔猪神经症状、腹泻、呼吸道疾病、生长发育受阻等。随着各规模化猪场对猪伪狂犬病控制的高度重视、高效 gE 基因缺失疫苗的应用、针对gE 抗体水平的长期监测和不断淘汰感染野毒的阳性猪,很多猪场成功实现了对猪伪狂犬病的稳定控制,甚至免疫为野毒(gE)抗体阴性场[1]。但从2011年底开始,猪伪狂犬病再次在我国已经免疫过Bartha-k61的多个猪场暴发,发病的临床症状与经典的伪狂犬一致:5%~15%怀孕母猪流产(本身无临床表现),哺乳仔猪因神经症状导致高死亡率(15%以上),生长育肥猪发病继发猪胸膜肺炎或猪肺疫,导致死亡率达到5%~20%。发病猪群血清gE阳性率快速升高达50%~100%。田克恭等[2]研究发现了PRV变异株,其变异毒力增强,抗原性发生变化。伪狂犬野毒抗体gE阳性率呈上升趋势,2017年虽有所降低,但仍然处于较高水平。
猪群自然感染PRV后便终生带毒、排毒,其主要传播途径多样[3]。母猪血液内的病毒可以通过胎盘屏障传给后代,直接感染胎儿,引起怀孕母猪流产等[4]。PRV的 DNA一般主要以附体的形式出现或插入处于潜伏感染状态下神经元细胞的染色体 DNA中,从而能够长期潜伏在猪群中[5]。PRV感染与免疫抗体水平的研究结果显示,它们之间呈负相关,这对于该病防控起到重要作用[6]。目前有关猪群带毒、排毒与PRV抗体之间关系的研究几乎没有。本研究通过对猪群PRV排毒情况和 gE与gB抗体水平的监测,分析它们之间的关系,以期根据监测结果制定综合防控措施,更好地遏制猪场内伪狂犬病的流行。
1 材料与方法
1.1 试验材料
1.1.1 血清样品 2014年5月,采集广东省某规模化猪伪狂犬病阳性猪场不同阶段猪群的血清样品 224份,同时采集相应猪群中精液样品 7份、乳汁样品 24份、唾液样品82份、鼻拭子样品 177份、肛拭子样品177份、脐带血样品 10份,样品经处理后放于-20℃备用。
2014年6月,采集广东省某规模化猪伪狂犬病阴性猪场不同阶段猪群的血清样品72份,同时采集相应猪群中鼻拭子样品74份、肛拭子样品74份、唾液样品74份、乳汁样品9份、精液样品5份,样品经处理后放于-20℃备用。
记录各猪场主要的免疫程序,各猪场均使用gE基因缺失疫苗免疫。
1.1.2 试剂 伪狂犬病毒gE抗体测定采用gEELISA(酶联免疫吸附试验)诊断试剂盒(购自美国IDEXXR公司,批号为LK935);伪狂犬病毒gB抗体测定采用Biochek Aujeszky gB(PRV-gB)诊断试剂盒(购自天之泰生物公司,批号为FS6014);病毒DNA/RNA提取试剂盒购自Magen公司产品;Ex Taq酶、DNA Marker DL2000等购自TaKaRa公司。
1.1.3 引物 根据GenBank上公布的gE基因序列,从gE的ORF中选取一段保守序列用以PRV-gE的核酸检测,利用Primer5软件设计特异性引物,引物序列如下:gE-F:5’-GACCATG CGGCCCTTTCTGC-3’;gE-R:5’-GGTCCACCG GGCGCAGGCACTGC-3’,预期目的片段长度890 bp。引物由上海捷瑞生物工程有限公司合成。
1.2 试验方法
1.2.1 样品处理 不加抗凝剂收集的血液样品,室温静置2~6 h后,以4 000 r/min离心15 min,取上清液,置1.5 mL EP管中;对于没有血清分离条件的地区,室温静置,让其自然析出血清;-20℃保存血清待检。
鼻拭子和肛拭子用加入抗生素的PBS对拭子进行悬浮,然后8 000 r/min离心5 min,抽取250 μL,用以提取病毒DNA。剩余的样品置于-80℃保存。
1.2.2 血清中PRV gE、gB抗体检测 (1)PRV gE抗体水平检测:使用PRV gE-ELISA抗体检测盒对待检血清样品中的PRV gE抗体水平进行检测,具体操作步骤按试剂盒说明书进行。
(2)PRV gB抗体水平检测:使用Biochek Aujeszky gB抗体检测试剂盒对待检血清样品中的PRV gB抗体水平进行检测,具体操作步骤按试剂盒说明书进行。
1.2.3 病毒DNA提取 取250 μL处理好的样品(如血清、初乳、组织匀浆液、拭子等)置于装有20 μL蛋白酶K的离心管中,其余步骤按照PRV核酸提取试剂盒说明书进行,提取的PRV DNA置-80℃保存备用。
1.2.4 PRV gE基因片段检测 PCR反应体系:2×Taq Buffer12.5 μL,引物(10 μmol/L)各 1 μL,模板 DNA 2 μL,加 ddH2O 至 25 μL。反应条件:95℃预变性5 min;94℃变性30 s、56℃退火30 s、72℃延伸50 s,34个循环;最后72℃终延伸12 min。PCR产物利用琼脂糖凝胶电泳分析。
2 结果与分析
2.1 不同阶段猪群血清样品的PRV gE抗体检测结果
通过gE-ELISA方法对2014年5月和6月采集自广东省某阳性猪场和某阴性猪场不同阶段猪群的血清样品进行PRV-gE抗体检测,结果检出阳性猪场PRV-gE野毒抗体阳性的血清样品共127份,总阳性率为56.7%(表1),从表1可以看出,除了1周龄仔猪、5周龄保育猪和哺乳母猪伪狂犬野毒抗体为阴性外,其他阶段猪群的gE抗体都有阳性,其中后备母猪、一胎母猪和经产母猪的平均阳性率为93.6%,怀孕和空怀母猪的平均阳性率为23.1%,公猪的阳性率是12.1%,6周龄保育猪的阳性率为70%,8周龄保育到育肥猪阳性率偏高,52.7%~100%不等,其中16~24周龄育肥猪的阳性感染率则高达100%,表明阳性猪场不同阶段猪群普遍存在PRV野毒感染,其中育肥猪和母猪感染最严重。1周龄、5周龄为阴性,可能是母源抗体起到比较好的保护效果,但也有野毒感染的影响,比如在6周龄抗体出现异常升高,可能是在保育舍后PRV再次感染,导致抗体水平较高。利用gE-ELISA抗体检测试剂盒检测PRV阴性猪场血清样品72份,检测结果均为gE抗体阴性,表明阴性猪场猪群没有PRV野毒感染,处于正常水平。

表1 阳性场不同阶段猪群PRV gE抗体检测结果
2.2 不同阶段猪群血清样品PRV gB抗体检测结果
检测阳性猪场和阴性猪场不同阶段猪群血清中的PRVgB抗体,结果显示,阳性场不同阶段猪群PRV-gB阳性率都很高,gB抗体的总阳性率为88.8%(表2),从1周龄仔猪到10周龄育肥猪,gB抗体阳性率逐渐降低,之后迅速升高,这一情况与母源抗体消退趋势基本一致,之后升高应该与疫苗免疫有关。阴性不同阶段猪群gB抗体的总阳性率为38.9%(表3),显著低于阳性场,仔猪到12周龄育肥猪,gB抗体阳性率逐渐降低,14周龄育肥猪gB抗体又达到较高水平,之后逐渐降低,这个趋势符合母源抗体和免疫抗体消长规律。阴性场公猪、一胎母猪、初产母猪、经产母猪群的抗体阳性率都为100%,且gE抗体阴性,说明该场种猪群的gB抗体来自疫苗免疫,免疫效果较好,抗体水平高且整齐;整体上阴性场各阶段猪群抗体阳性率普遍较低,且gE抗体阴性,说明野毒感染对猪群抗体水平变化产生了显著影响。

表2 阳性场不同阶段猪群PRV gB抗体检测结果
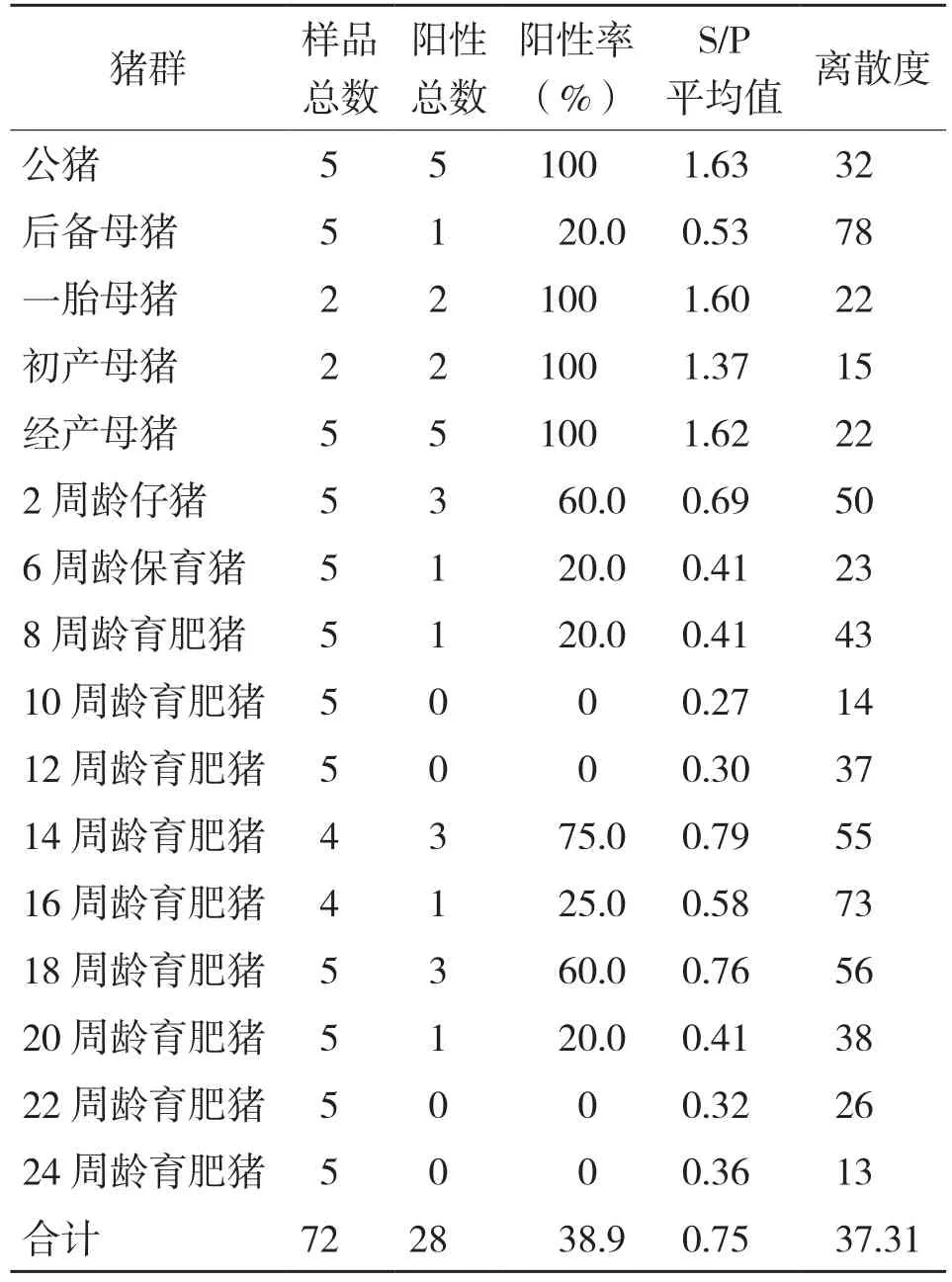
表3 阴性场不同阶段猪群PRV gB抗体检测结果
2.3 不同阶段猪群样品PRV gE抗原检测结果
用PCR方法对阴性场不同阶段猪群采集的样品进行检测,结果显示,阴性猪场的血清、初乳、精液、唾液、鼻拭子和肛拭子等共308份样品均未检测出PRV抗原阳性,说明该场没有PRV野毒感染。而阳性场中生产过的母猪、3周龄仔猪到10周龄育肥猪、20周龄到22周龄育肥猪检测到了PRV抗原(图1)。针对不同类别样品而言,3周龄仔猪唾液样品阳性率为10%;一胎和经产母猪鼻拭子样品阳性率分别为20%和18.3%,3周龄仔猪到10周龄育肥猪阳性率从8.3%升高到30.8%;经产母猪肛拭子样品阳性率为9.1%,3周龄仔猪到10周龄育肥猪阳性率为7.7%~16.7%不等(表4)。不同样品比较来看,脐带血的阳性检出率最高、达80%,其次是初乳、33.3%,鼻拭子、肛拭子、唾液、血清阳性率较低,精液为阴性(图2)。以上结果表明,PRV带毒主要在母猪和仔猪、保育猪阶段,其排毒方式多样,以脐带血、初乳为主,也就是说PRV垂直传播风险极高。
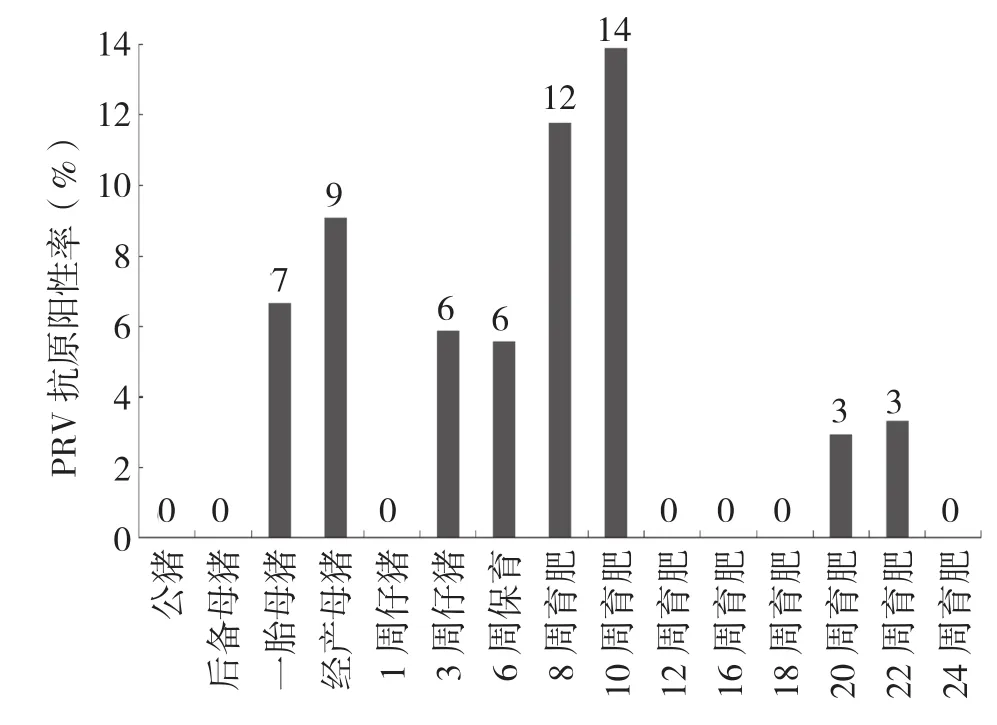
图1 阳性场不同阶段猪群PRV抗原阳性率比较
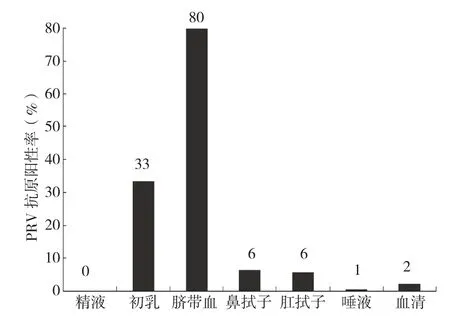
图2 阳性场猪群不同样品中PRV抗原阳性率比较
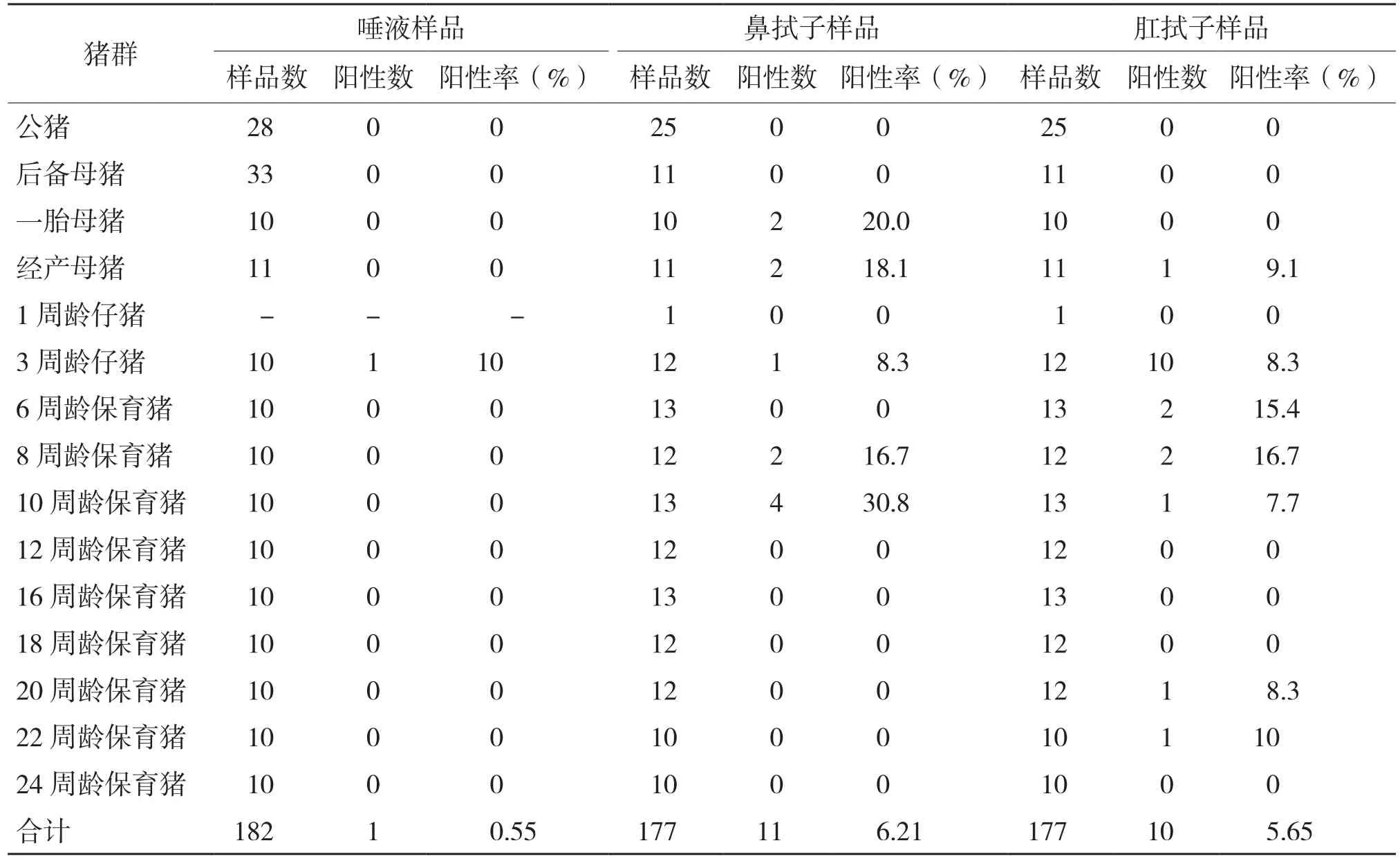
表4 不同阶段猪群不同样品中PRV抗原检测结果
2.4 猪伪狂犬病排毒情况与gE、gB抗体之间的关系
本研究的阳性场、阴性场均免疫了gE缺失疫苗,因此gE抗体代表了野毒感染情况,gB代表母源抗体或免疫抗体水平。以阴性场为参考,分析猪伪狂犬病排毒情况与gE、gB抗体之间的关系,结果如图3所示,猪伪狂犬病排毒对gE、gB抗体的影响显著,gE抗体变化趋势与病毒感染呈现一定的正相关性,有猪群,如后备母猪gE阳性率100%,gE抗原阳性率为0%,这可能是由于使用普通PCR方法不够灵敏造成的。对于gB抗体而言,阴性场gB抗体只是代表了母源抗体和免疫抗体消长情况,但是对于阳性场,gB还受到了病毒感染的影响,表现在1周龄仔猪到10周龄育肥猪阶段,此时应该是母源抗体消退,但阳性场gB抗体表现异常,到10周龄时,其阳性率依然高达40%;另外就是表现在育肥阶段,免疫抗体应该较低,阳性场gB抗体阳性率却异常高,甚至达100%,因此,猪伪狂犬病排毒对gB抗体的影响主要是使猪群在各阶段抗体水平偏高。
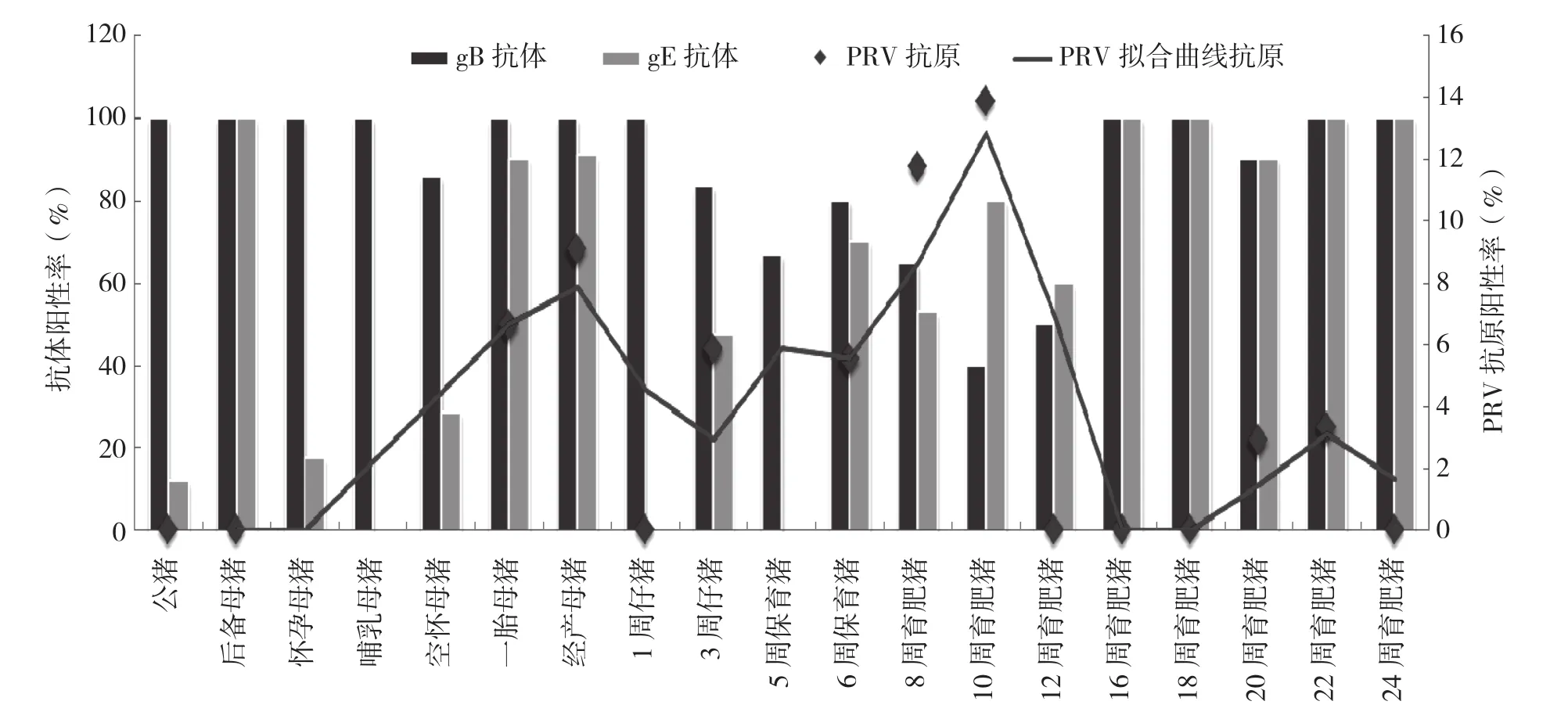
图3 阳性场猪伪狂犬病排毒情况与gE、gB抗体之间的关系
3 结论与讨论
猪场猪伪狂犬病的快速转阳给广东省养猪业带来了巨大的经济损失。猪伪狂犬病毒可以感染各个阶段猪群,易感猪、免疫猪都可能潜伏感染或隐性感染情形[7-8],这为该病防治造成极大困难。使用gE 基因缺失疫苗不仅有效控制PRV的流行,也为血清学区分免疫猪和自然感染猪提供便利[9]。本次研究以gE缺失疫苗免疫猪群为对象,以PRV野毒阴性场为参考,分析PRV野毒排毒对gE抗体、gB抗体水平的影响。
研究发现,阴性猪场猪群血清样品的PRV gE抗体全部为阴性,而阳性场总体阳性率高达56.7%。阴性场PRV gB抗体变化与刘明亚等[10]报道一致,总体上看,新生仔猪PRV抗体水平较高,之后缓慢下降,8周龄疫苗免疫后,抗体呈加速下降,阴性场在3周龄和8周龄时出现大幅度下降,这也与朱玲等[11]的报道一致,在2~3周龄、5~8周龄2次出现较大幅度下降。相比之下,阳性猪场PRV gB抗体出现明显异常,尤其是16~24周龄育肥猪阶段,阳性率达100%,1周龄仔猪到10~12周龄育肥猪,抗体阳性波动下降,但最低仍有40%。育肥猪高水平的gE抗体阳性更能客观地反映出猪伪狂犬病感染的实际情况,由于猪伪狂犬病 gE 抗体在90~120日龄会慢慢消失[12],因此种猪和育肥猪的野毒抗体呈阳性是PRV感染导致的结果,再根据排毒检测结果推断,这与PRV在3周龄和10~12周龄高感染率有直接关系。
本研究结果显示,后备母猪、一胎母猪和经产母猪的野毒抗体阳性率为93.6%,在16~24周育肥猪群中,PRV野毒抗体阳性率高达98%,且通过核酸检测结果可以看出,种猪主要通过初乳和脐带血进行排毒,并且本试验已经从初乳样品中分离到了PRV[13],被感染的育肥猪群则可以通过口鼻及生殖道分泌物进行排毒,而公猪gE抗体阴性但能在血清中检测到PRV,说明血液也是PRV的排毒途径之一。这一检测结果表明PRV在该阳性场的种猪舍和肥育舍特别活跃,gE抗体水平介于0.04~0.05之间的带毒猪能够通过不同途径向外排毒、散毒,因此可以说带毒猪是阳性猪场内病毒不断循环的警示器。
自2011年起,猪伪狂犬病的阳性猪场明显增多,而近年来几乎所有的规模化猪场都通过使用 gE 基因缺失疫苗对猪群进行强化免疫。从周绪斌等[1]、邱美珍等[14]的伪狂犬病野毒抗体调查报告得知,使用gE基因缺失疫苗进行免疫获得了较理想的效果。因此,定期的疫苗免疫接种仍然是当前控制病毒性疫病的主要办法,免疫前后定期监测猪伪狂犬病 gB 抗体滴度是检测疫苗是否能有够效保护猪群不受感染的方法[15]。
综上分析,PRV排毒和猪群gE抗体水平呈现一定的正相关性,并干扰gB抗体,主要表现在8~12周龄、16~24周龄育肥阶段猪群gB抗体异偏高,波动较大。PRV感染猪群后,排毒途径多样,但是以母猪带毒、排毒感染仔猪危害最大。猪伪狂犬病野毒阳性场和阴性场疫苗免疫应该根据其血清学检测结果及阴、阳性场的特殊性制定合理的免疫程序,对于阳性场还要狠抓野毒攻击点,以达到减少损失的目的。
