三磷腺苷合酶抑制因子1基因敲除对小鼠成纤维细胞中三磷腺苷水平及脂肪细胞分化的影响
2018-08-28关丫丫梁银明叶建平
关丫丫,梁银明,王 辉,叶建平,3
(1.新乡医学院医学检验学院,河南 新乡 453003;2.河南省分子诊断与医学检验技术协同创新中心,河南 新乡 453003;3.美国路易斯安那州立大学Pennington生物医学中心,路易斯安那州 巴吞鲁日市 70808)
三磷腺苷合酶抑制因子1(adenosine triphosphate synthase inhibitory factor 1,ATPIF1)是与三磷腺苷(adenosine triphosphate,ATP)合酶相互作用的由细胞核编码产生的线粒体蛋白[1]。传统观点认为,ATPIF1与ATP合酶的F1区相互作用[2],主要抑制ATP合酶的水解活性。但目前有研究表明,ATPIF1也能抑制ATP合酶的合成活性[1]。ATPIF1的活性在生理条件下受能量供需关系的动态调节[3]。在能量需求高的细胞如小鼠心肌细胞中,大部分ATPIF1处于失活状态。在牛心肌线粒体中,ATPIF1蛋白单体无活性,无法与ATP合酶F1区结合;当ATPIF1蛋白形成同源二聚体时被活化,产生抑制ATP合酶的作用[4]。目前,关于小鼠ATPIF1基因表达的研究较少,在能量代谢方面的表型研究更少。有研究显示,ATPIF1基因敲除小鼠的体质量和体脂量均降低,提示ATPIF1敲除可能对代谢产生影响[5]。此外,在肥胖和2型糖尿病患者骨骼肌中ATPIF1表达增加,提示ATPIF1可能影响脂质代谢[6]。还有研究表明,ATPIF1基因参与胰岛素分泌的负调控机制,抑制胰腺β细胞对葡萄糖的反应[7]。在大多数人类常见肿瘤中,ATPIF1基因过表达,使氧化磷酸化转变为糖酵解,促进了肿瘤进展[8]。但ATPIF1基因敲除对脂肪细胞分化的影响还未见报道。本研究通过比较ATPIF1敲除小鼠和野生型小鼠白色脂肪细胞在体外分化的差异,探讨ATPIF1敲除对脂肪细胞分化的影响。
1 材料与方法
1.1实验动物取5只ATPIF1基因敲除小鼠作为观察组,另取5只C57BL/6小鼠作为对照组,小鼠体质量22~24 g,所有小鼠均由新乡医学院动物实验中心提供,饲养于湿度40%~50%、温度(24.0±1.0)℃的独立通气笼系统,昼夜比为 12 h12 h。给小鼠喂食低脂饲料,其中粗脂肪含量≥4%,粗蛋白质含量≥20.5%,粗纤维含量≤5%。
1.2主要试剂与仪器达尔伯克改良伊戈尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)购自美国HyClone公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,胰岛素干粉、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松、吡格列酮和吲哚美辛购自美国Sigma公司,Ⅰ型胶原酶购自美国Worthington公司,中性蛋白酶Ⅱ购自瑞氏Roche公司,ATP检测试剂盒购自美国Thermo Fisher公司,低脂饲料购自上海普路腾生物科技有限公司,三酰甘油(triacylglycerol,TG)检测试剂盒购自南京建成公司。酶标仪购自美国Molecular Devices公司,4 ℃低温离心机购自美国Beckman Coulter公司。
1.3溶液配置
1.3.1消化液配制50 mL的磷酸盐缓冲液(phosphate buffered solation,PBS)中加入40 mg 的Ⅰ型胶原酶和125 mg中性蛋白酶Ⅱ,放入37 ℃水浴器中过夜,待完全溶解后,用0.22 μmol·L-1的滤器过滤,分装后-20 ℃冻存备用。
1.3.2白色脂肪细胞诱导剂Ⅰ配制50 mL 33 mmol·L-1完全培养基中加入1.73 mmol·L-1胰岛素50 μL、0.5 mmol·L-1IBMX 50 μL、1 mmol·L-1地塞米松50 μL、2 mmol·L-1吲哚美辛5 μL、10 mmol·L-1吡格列酮 5 μL,混匀后4 ℃冰箱保存。
1.3.3白色脂肪细胞诱导剂Ⅱ配制50 mL 33 mmol·L-1完全培养基中加入1.73 mmol·L-1胰岛素50 μL,混匀后4 ℃冰箱保存。
1.4细胞收集与培养异氟烷麻醉并处死2组小鼠,剪下耳组织,体积分数75%乙醇消毒3次,PBS将耳组织上残留的乙醇冲洗干净,在超净工作台内将耳组织剪成1 mm左右的碎块,将碎块收集到 15 mL 离心管中,加入3 mL消化液;37 ℃水浴器中消化2 h,在此期间每5 min摇晃离心管1次,使组织碎块与消化液充分接触。加入3 mL完全DMEM终止消化作用,1 500 r·min-1离心5 min,弃上清液;再加入 1 mL 完全DMEM重悬细胞,1 500 r·min-1离心 5 min,弃上清液。最后,加入 1 mL 完全DMEM重悬细胞沉淀,将细胞悬液移入10 cm 的细胞培养皿中培养。细胞传代1~2次后,待细胞长满再接触抑制3 d左右,更换含白色脂肪细胞诱导剂Ⅰ的细胞培养基诱导4 d,再更换含白色脂肪细胞诱导剂Ⅱ的培养基诱导4 d。在诱导前及诱导4、8 d分别检测成纤维细胞内ATP和TG水平。
1.5成纤维细胞中ATP水平检测将6孔细胞培养板置于冰上,用预冷的PBS洗2次,每孔中加入细胞裂解液120 μL,用细胞刮收集成纤维细胞至1.5 mL的小离心管中,冰上放置30 min,用组织破碎仪将细胞充分破碎,4 ℃ 12 000×g离心10 min,取上清液。如果细胞裂解后TG较多,离心以后可以看到上层漂浮有大量的油脂,小心去除油脂,取上层清液,必要时重复离心1~2次,直至上层清液中没有油脂层。采用ATP检测试剂盒测成纤维细胞中ATP水平,操作步骤严格按照试剂盒说明书进行。
1.6成纤维细胞中TG水平检测在6孔细胞培养板的每个孔中加入500 μL胰蛋白酶消化液,放置37 ℃细胞培养箱30 s,小心吸出胰蛋白酶消化液,PBS洗2次,缓慢清洗不要使细胞脱落,加入100 μL体积分数2% TritonX-100稀释液,冰上放置30 min,用组织破碎仪将细胞充分破碎;采用TG检测试剂盒检测成纤维细胞中TG水平,操作步骤严格按照说明书进行。

2 结果
2.12组小鼠成纤维细胞中ATP水平比较结果见表1。诱导前,对照组小鼠原代成纤维细胞中ATP水平明显低于观察组,差异有统计学意义(P<0.05);诱导4、8 d,对照组与观察组小鼠原代成纤维细胞中ATP水平比较差异无统计学意义(P>0.05)。
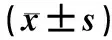
表1 2组小鼠原代成纤维细胞中ATP水平比较Tab.1 Comparison of the ATP level in fibroblasts of mice between the two groups
2.22组小鼠成纤维细胞诱导过程中TG水平比较结果见图1和表2。诱导4、8 d,对照组小鼠成纤维细胞中TG水平低于观察组,差异有统计学意义(P<0.05)。
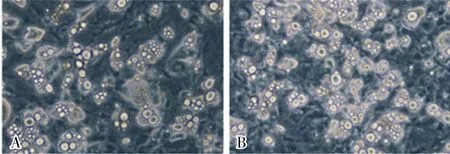
A:对照组;B:观察组。
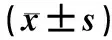
表2 2组小鼠成纤维细胞诱导过程中TG水平比较Tab.2 Comparison of the TG level in fibroblasts of mice between the two groups
3 讨论
ATPIF1是线粒体ATP合酶的内生性抑制蛋白,其与ATP合酶结合以后,可以抑制ATP合酶的合成和水解作用[9-12]。NAKAMURA等[13]研究了ATPIF1基因敲除纯合子小鼠在正常饮食条件下的生长发育情况,结果发现,ATPIF1基因敲除纯合子小鼠的体质量和体脂量与野生型小鼠相比无明显差异,线粒体超微结构、自噬、代谢产物以及细胞内ATP水平也无明显变化。而欧洲条件性基因突变鼠组织培育了ATPIF1基因敲除小鼠,正常饮食后发现该小鼠在脂肪组织、代谢稳态、生长发育及体型上是有改变的[1]。由于ATPIF1基因敲除的表型还不清楚,而且关于ATPIF1基因敲除对脂肪细胞分化的影响还未见报道。因此,本研究将ATPIF1基因敲除小鼠的原代成纤维细胞诱导为脂肪细胞,观察ATPIF1基因敲除对脂肪细胞分化过程中成纤维细胞中ATP水平的影响以及对脂肪细胞分化的影响。
ATPIF1基因是ATP合酶的双向抑制剂,可以抑制ATP合酶的合成和水解ATP的功能。ATPIF1可选择性抑制ATP合酶的水解活性,比如在心脏缺血时,ATPIF1抑制ATP合酶的水解活性,维持心肌细胞内ATP水平,保护心脏[14]。在转基因小鼠中,神经元和肝细胞中表达活化型ATPIF1(H49K突变蛋白),抑制ATP合酶的合成活性,使细胞内ATP水平降低[15-16]。本研究结果表明,ATPIF1基因敲除提高了成纤维细胞中线粒体的活性,促进了成纤维细胞内ATP的合成,而ATP的增加也促进了脂肪细胞的分化。ATP是细胞生理活动所需能量的直接来源,成纤维细胞被诱导为脂肪细胞的过程需要消耗ATP。随着诱导的进展,脂肪细胞数目逐渐增多,储存TG的量逐渐增加,导致线粒体的数量和合成的ATP减少。在脂肪细胞诱导过程中,ATPIF1基因敲除小鼠成纤维细胞中高水平的ATP逐渐降低,促进了脂肪细胞分化。
综上所述,ATPIF1基因敲除促进了成纤维细胞中ATP的合成,并且促使成纤维细胞分化为脂肪细胞,储存更多的TG。本实验通过成纤维细胞诱导为脂肪细胞,首次验证了ATPIF1基因敲除对脂肪细胞分化的影响。
