雷帕霉素对动脉粥样硬化小鼠斑块面积影响及机制探讨*
2018-08-28王青龙姜希娟范英昌庞晓丽
王青龙,姜希娟,范英昌,庞晓丽
(1.天津中医药大学研究生院,天津 300193;2.天津中医药大学中西医结合学院,天津 300193;3.天津中医药大学护理学院,天津 300193)
动脉粥样硬化(AS)是冠心病、脑梗死、外周血管疾病的主要原因。研究显示炎症反应可以促进粥样斑块进行性发展,继而破裂出血引发急性心脑血管事件[1]。因此,控制炎症反应可抑制斑块的发生发展。近年来,很多学者认为AS属于慢性免疫-炎症反应[2-3],从免疫角度探讨AS发生发展中的炎症反应机制成为目前研究的热点之一。雷帕霉素作为一种免疫抑制剂,在抗AS方面的研究已经取得了一些进展[4-5]。然而,其具体作用机制尚未完全阐明。故实验通过建立小鼠动脉粥样硬化模型,探讨雷帕霉素对粥样斑块面积的影响及机制,以期为临床研究提供借鉴。
1 材料与方法
1.1 药物准备 根据说明书,基于体表面积换算人鼠等剂量,并将药物溶入适量生理盐水中。
1.2 实验动物与分组 选取健康ApoE基因敲除(ApoE-/-)雄性小鼠 30 只,体质量 25~30 g,6~8 周龄(国家卫生研究院提供)。动物适应性喂养2周后,采用随机数字表法将小鼠分为3组:模型组10只、雷帕霉素组(RAPA)10只,阳性药物(瑞伐他汀)组10只,另饲养C57小鼠10只作为空白对照组。空白对照组给予正常饮食,其他3组均给予高脂饮食12周。12周后,RAPA组和阳性药物组给予相应剂量药物灌胃4周,模型组与空白对照组给予等剂量生理盐水灌胃4周。4周后处死取材。
1.3 观察方法与指标 1)处死小鼠后取主动脉窦斑块,冰冻连续切片后油红O染色,观察各组斑块内脂质情况。2)取主动脉窦及主动脉弓斑块,石蜡连续切片后苏木精-伊红(HE)染色,利用图像分析仪评估斑块面积。3)取小鼠外周血,离心后取上清,采用酶联免疫吸附(ELISA)法测定外周血中肿瘤坏死因子 α(TNF-α)、γ 干扰素(INF-γ)、白介素-6(IL-6)、白介素-10(IL-10)、转化因子 β(TGF-β)含量。
1.4 统计学分析 采用SPSS 19.0统计软件包进行分析,计量数据采用均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD法行配对t检验,以P<0.05定为有统计学差异。
2 结果
2.1 油红O染色 模型组、雷帕霉素组及阳性药物组均形成动脉粥样硬化斑块,其中模型组形成的粥样斑块具有较大脂核,见图1。
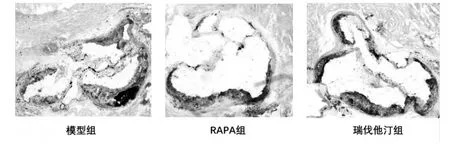
图1 各组斑块主动脉窦油红O染色(×40)Fig.1 Aortic sinus imaging of Oil red staining among groups(×40)
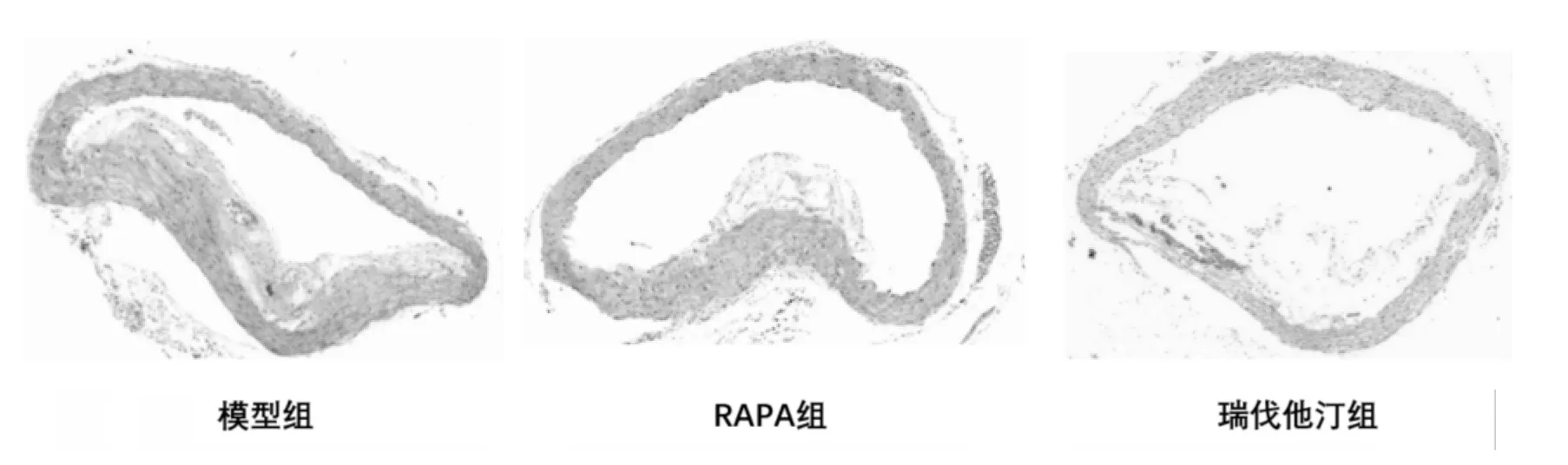
图2 各组斑块主动脉弓HE染色(×40)Fig.2 Aortic arch imaging of Hematoxylin and eosin among groups(×40)
2.2 斑块面积 基于HE染色利用图像分析仪计算各组斑块面积及占管腔的百分比。结果显示,与模型组比较,雷帕霉素组斑块面积及狭窄程度明显小于模型组,有统计学意义(P<0.05);瑞伐他汀组虽然斑块面积与模型组比较无统计学意义(P>0.05),但在狭窄程度方面有统计学意义(P<0.05),见表1。雷帕霉素组与瑞伐他汀组比较,两组差异无统计学意义(P>0.05)。见图2。
表1 各组斑块面积及占管腔面积百分比比较(±s)Tab.1 Comparison of the plaque area and lumens area account among groups(±s)

表1 各组斑块面积及占管腔面积百分比比较(±s)Tab.1 Comparison of the plaque area and lumens area account among groups(±s)
注:与模型组比较,*P<0.05,**P<0.01。
组别模型组RAPA组瑞发他汀组动物数10 10 10斑块面积(mm2) 斑块面积百分比(%)651.30±145.81 0.384±0.500 502.32±184.75* 0.297±0.600**625.82±170.46 0.339±0.400*
2.3 外周血中 TNF-α、INF-γ、IL-6、IL-10、TGF-β含量 结果显示,模型组与空白对照组比较,促炎因子明显升高,而抗炎因子明显降低,差异有统计学意义(P<0.05);雷帕霉素组与模型组比较能有效降低促炎因子含量,增加抗炎因子表达,差异有统计学意义(P<0.05);瑞伐他汀组与模型组比较除IL-10外,差异均匀统计学意义(P<0.05)。见表 2。
3 讨论
近年来很多学者认为AS属于慢性免疫-炎症性疾病,斑块内大量巨噬细胞、淋巴细胞(主要为CD4+T细胞)、炎症因子聚集引发免疫炎症反应,可导致斑块进行性发展[6-7]。研究显示,雷帕霉素靶蛋白(mTOR)信号通路激活后可促进巨噬细胞增殖、迁移及CD4+T淋巴细胞向效应性T细胞分化,进而导致AS炎症反应放大[5,8]。因此,调控mTOR通路可抑制免疫炎症反应,进而抑制AS斑块进展。
表2 各组外周血中炎症因子含量测定比较(x±s)Tab.2 Comparison of inflammatory factors in peripheral blood among groups(±s)pg/mL
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。
组别空白对照组模型组RAPA组瑞伐他汀组动物数10 10 10 10 TNF-α INF-γ IL-6 IL-10 TGF-β 1 237.19±331.84 1 112.14±399.52 1 341.82±336.34 553.23±126.18 976.89±161.77 2 438.26±920.70* 1 778.02±177.12* 1 963.73±387.36* 411.43± 20.98* 484.52±152.52**1 054.38±273.69# 1 055.50±108.16## 1 541.07±107.77# 481.26± 38.21# 1 031.66±193.83##1 065.59±347.33# 1 208.98± 61.40# 1 446.71±268.97# 476.90± 68.11 1 104.39±294.54##
雷帕霉素为免疫抑制剂,可通过抑制mTOR通路达到控制免疫反应的作用[4]。本研究油红O及HE染色显示,雷帕霉素组斑块脂核明显小于模型组。基于HE染色图像分析结果证明,该药可有效减小动脉粥样硬化小鼠体内斑块面积,降低血管狭窄程度,与临床治疗AS阳性药物-他汀类效果相同。说明一方面,AS进展过程中确实存在免疫反应;另一方面,这种免疫反应与mTOR通路关系密切。
在免疫引发的炎症反应方面,研究表明mTOR通路激活后,一方面可促进巨噬细胞增殖,增殖的巨噬细胞会释放大量炎症因子如TNF-α、INF-γ、IL-6 等,加剧 AS 炎症反应[6,9]。另一方面,可促进CD4+T亚群细胞向效应性T细胞分化,降低调节性T细胞(Treg)数量,进而导致Treg细胞分泌的抗炎因子 IL-10、TGF-β 表达降低,炎症反应放大[10-11]。本研究结果显示,雷帕霉素可有效降低动脉粥样硬化小鼠外周血中 TNF-α、INF-γ、IL-6 含量,增加 IL-10、TGF-β含量。因此,推测这可能与该药抑制巨噬细胞增殖、增加Treg细胞数量有关。综上所述,雷帕霉素可通过增加抗炎因子含量、降低促炎因子含量来调控炎症反应,进而抑制斑块发展,降低血管狭窄程度。
总之,雷帕霉素为抗真菌感染、抗移植免疫反应药物,在治疗AS方面的研究尚处于起步阶段。本研究从炎症角度探讨该药对AS的作用机制,但在免疫炎症具体作用靶点方面还需进一步研究。
